כ 180 ליטר ליום עוברים דרך הנפרונים של הכליה, כדי לנקות את נוזלי הגוף מרעלים [מקור]. כמות דם זו עלולה לצאת החוצה כי הנפרונים הם צנרת שמייצרת שתן ונוזל שיוצא מהגוף החוצה. לו תצא כמות נוזל כזו מהגוף הדבר הזה עלול הוביל להתייבשות מידית ומוות. בתוך הנוזל חומרי הזנה ויסודות מאוד חשובים להפעלת מערכות ותת מערכות בגוף האדם. אם היא, רובה או חלקה על תכולת הנוזל שבו היא נמצאת לא תישאר בגוף במהלך הסינון והניקוי שלו, האלקטרוליטים– תרכובות אנאורגניות (כולל מגנזיום (2+Mg), נתרן (+Na), אשלגן (+K), סידן (2+Ca), כלוריד (–Cl), פוספט (PO4-3), ומימן קרבונט (–HCO3).) חומצות אמינו גם גלוקוז אוליגופפטידים (אוליגו-, "כמה" פפטידים), חלבונים, ויטמינים, חומצת חלב, אוראה, חומצת שתן וחומצה פחמתית (carbonic acid – ביקרבונט) הגוף לא יתפקד. הסינון לכשעצמו הכרחי – כך, בעזרת הכליות אנשים נפטרים ביעילות מעודפי מים ומוצרי פסולת שנכנסים לגוף למשל דרך האוכל [מקור].
הגוף שמקבל את המזון אל תוכו מעבד את המזון וכן את כל הדברים שאנשים אוכלים ושותים, בהחלט לא הכל "מזין", חלק מהמזון מייצר אנרגיה, בחלקו מכיל את אבני הבניין השונות שכל אחד מאתנו חייב כדי לשמור על צמיחה, תיקון פגמים, קרעים שנוצרים בגוף במהלך פעילות מאומצת, בריאות הרקמות והאיברים שמפעילים את הגוף כמו למשל הלב או הכבד והכליות. תוך כדי כך, מיוצרים מגוון חומרים וחלקם, למשל יתר חלבונים, לא ניתן להשתמש בהם או לאחסן אותם לאחר מכן, חומרים שלא נתן לאחסן או להשתמש בהם יש לסלקם ולא תתרחש בגוף הצטברות של רעילים.
בנוסף למוצרי פסולת, התזונה כיום מכילה לרוב יתר חומרים, בכללם גם מזון של ממש, בכמויות שהן הרבה מעל לצרכי הגוף ביום יום (חלבונים, סוכרים, מלח, פחמימות ושומנים). אנשים רבים מכורים לתרופות, גם בנטילת תרופות כרונית יתר חומרים ובנוסף נוצרים רעלים אורמיים בגלל תרופות במערכת העיכול. בעזרת מערכת העיכול נפטרים ממוצרי פסולת שאינם מסיסים במים והם יוצאים החוצה בצואה (למשל, סיבים וחיידקים לא מעוכלים), אבל מוצרי פסולת מסיסים במים למשל תרופות מגיעים לכליות ובעזרת מערכת הסינון שלהן הם מסולקים החוצה, חומרים כאלו יכולים לשנות את צבע השתן; כמו שקורה למי שאוכל סלק, או פטל שחור וריבס. צבע ורוד או אדום זה מעיד על כך שהכליות פעלו כאן וסילקו את הפיגמנטים המסיסים הם הצבעים שבשתן שלך. בשתן מסולקים גם קריאטינין ואוראה ואלקטרוליטים (כגון נתרן ואשלגן) [מקור].
הערה": קריאטינין הוא תוצר פסולת של חילוף החומרים של קריאטין. הוא מיוצר בשריר כאשר קריאטין עובר חילוף חומרים ליצירת אנרגיה. קריאטינין אינו נספג מחדש או מופרש, אלא מסונן אך ורק דרך הכליות, כך שקצב ההפרשה שלו מזרם הדם הוא מדד שמלמד וקשור ישירות למידת היעילות של הכליות כמסננות. על ידי מדידת כמות הקראטינין בדגימת הדם, ובעזרת נוסחא חכמה שהתפתחה ברבות השנים אליה מכניסים את גילך, מוצאך האתני (לבן, שחור בלבד בשלב זה), מגדר, גובה ומשקל כל אחד יכול להעריך את קצב הסינון הגלומרולרי שלו (GFR), התוצאה בהחלט יכולה לתת מושג לגבי תפקודן של הכליות שלך. כל מספר שמופיע לך במחשבון ה- GFR מתחת ל- 90 מחייב טיפול מידי, כי מחלת הכליות הורגת וקל מאוד לטפל בבעיה עם מזון כתרופה בתחילת הדרך – למחשבון GFR אפשר להגיע – כאן.
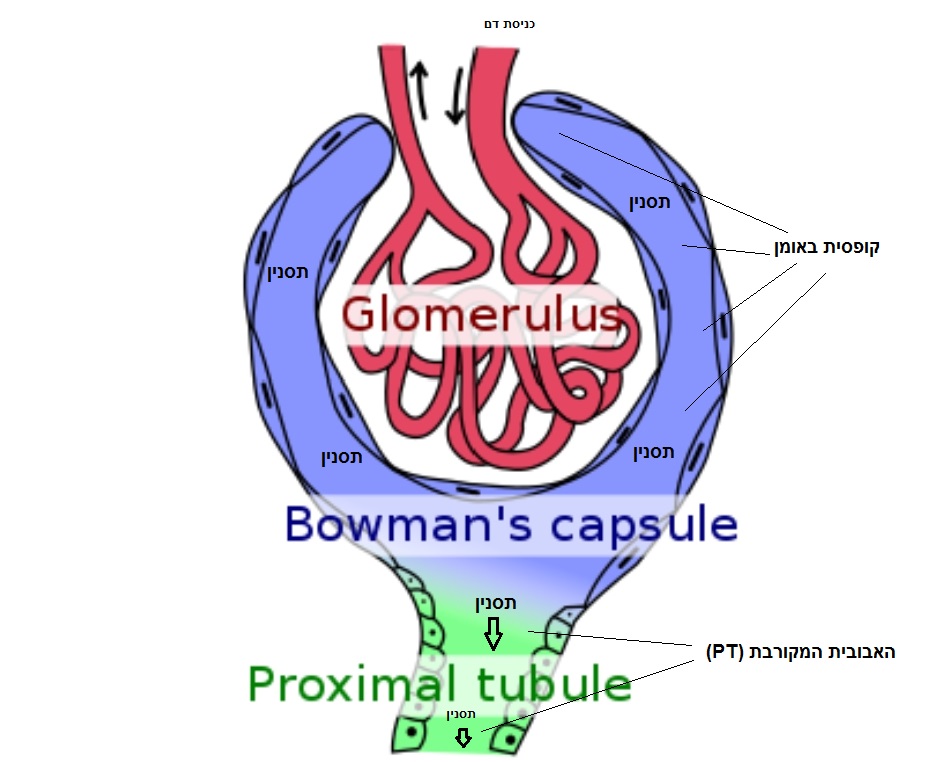
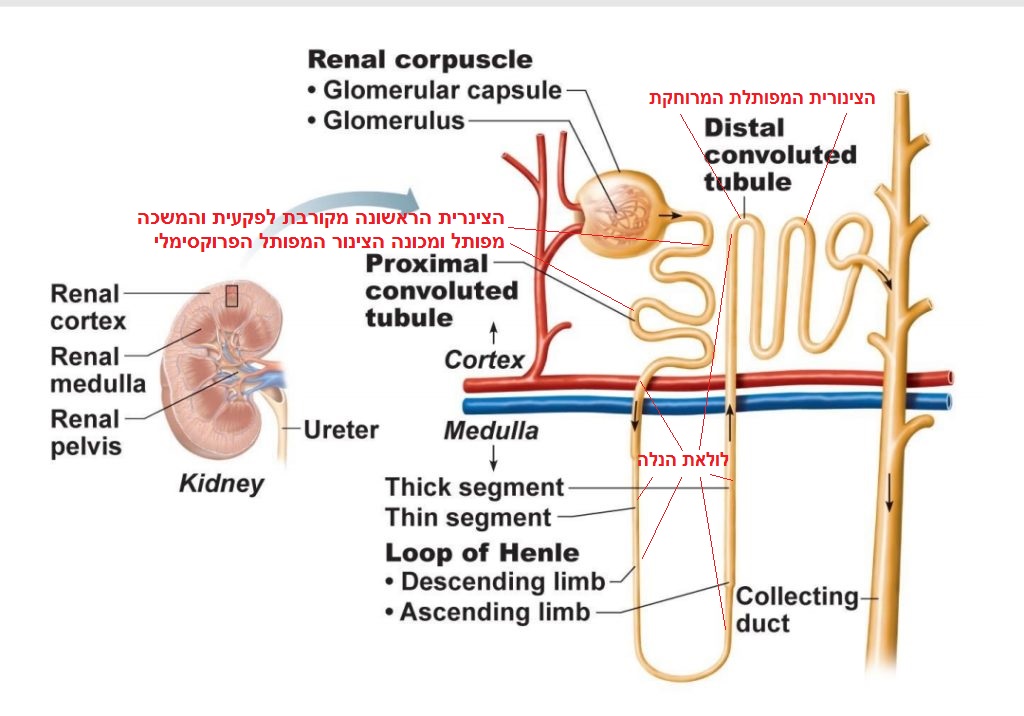
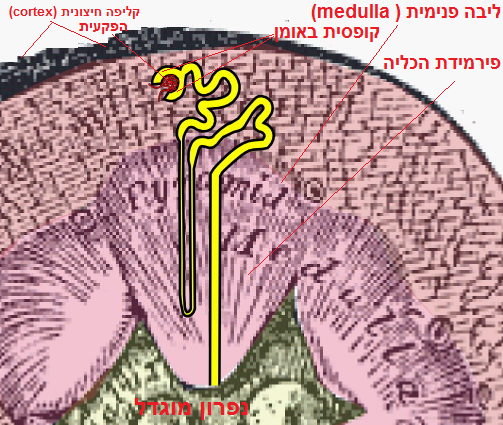
חומרי שימור, צבע, יתר מלח, יתר סוכר, יתר מים, יתר פחמימות גם יתר סוכר ותרופות על הרעלים האורמיים מסולקים מהגוף. דרך הריאות מסולקים חומרים כמו זיהום אוויר, אבל רעלים רבים ויתר מזון שמגיחים דרך מנות האוכל והחטיפים ושאר דברים באלו מטפלות הכליות והאברונים שמסייעים בעדן. במקביל כל החומרים ההכרחיים לתפקוד הגוף ממוחזרים. על כולם להישאר בגוף, גם בזאת הכליות מטפלות. הדם העובר בכליות על תכולת מרכיביו (הדם מטופל בכליות על ידי הנפרונים – רשת צינורות ניקוז מאוד חכמה שנמצאת שם) בכליות הוא עובר סינון בהמשך מכונה החומר תסנין ובסוף שתן [מקור]. יצירת שתן היא תהליך מסובך, וכדי לעשות זאת, כל אחת מהכליות מפעילה כמיליון צינורות מאוד מיוחדים, הנקראים נפרונים. השלב הראשון שלו מתרחש בפקעית (בלטינית: Glomerulus; גלומרולוס). מכול מקום הכרח שמרכיבים אלו, כולל הדם עצמו ומים רבים שנמצאים בו גם האלקטרוליטים יישארו לשימוש הגוף והזנת התאים [מקור1, מקור2, מקור3]. הצעד הראשון בהכנת נוזל סילוק הרעלים מהגוף = שתן בהפרדה. הכליות מפרידות את החלק הנוזלי של הדם (פלזמה – נוזל בצבע קש, עשיר בחלבונים), המכיל את כל המומסים המומסים, מתאי הדם [מקור]. כ-20% מהפלזמה הנכנסת לגלומרולוס מסוננת ועוברת דרך מחסום הסינון שבנימים (בו ידובר להלן) אל חלל השתן (US) בשלב התחילי היא נמצאת בתוך הקפסולה של באומן.
מחסום הסינון
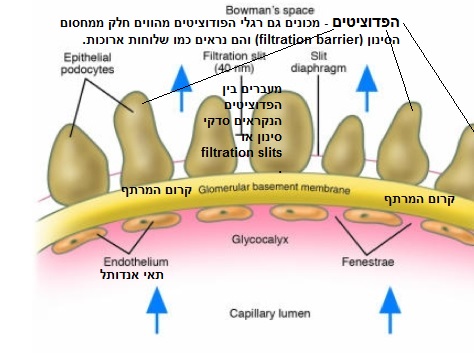
בגופיף הכליה [renal corpuscle שמורכב מהגלומרולוס, ומהקופסית ע"ש באומן- אשר תוחמת את הגלומרולוס), בצדו החיצוני של הנים אשר מרכיב את הפקעית, נמצאים תאי האנדותל (the glomerular endothelial cell ). תאים אלו של הנימים מורכבים ממברנה בסיסית (קרום המרתף או מברנת המרתף הגלומרולרית, ראו באיור: "חדירות קרום המרתף" – למטה.) המוקפת בתאי פודוציטים (שכבת אפיתל חיצונית), ומכונים תאי כף רגל. הם עוטפים את החלק החיצוני של נימי הגלומרולוס – אלו הם תאים אפיתליאליים שונים מהרגיל יש להם רגלונים שמגיעים עד לקרום הבסיס של הנימים הללו. רגלים אלו. רגלי הפודוציטים מהוות חלק ממחסום הסינון (או ה- filtration barrier) הן גם מטרה למחלה קשה בשם המינימלי צ'יינג.
האנדותל עצמו של הנימים, הממברנה הבסיסית שלו (קרום המרתף) ושלוחות הפודוציטים יוצרים מחסום סינון. אנדותל זה הוא שמהווה את שכבת הסינון הראשונה. בשכבה זו נמצאים פנסטרציות (או פנסטרות fenestrae אלו הם חורים בקוטר של 70-100 ננומטר.) הפנסטרציות (החריצים) אלו הם למעשה מרווחים שנוצרים בין תאי כף הרגל (הפודוציטים) שמפוזרים בצמתים בין תא לתא ונקראים דיאפרגמות חריצים [מקור]. החריצים האלו, או הפנסטרציות מאפשרים מעבר של מולקולות קטנות דרך הדופן הנימית עצמה – רוחב הפנסטרציות הם כאמור לעיל בין 70 ל-100 NM. תאי השטח של האנדותל מבטאים מולקולות כגון HLA, IL1, אנגיוטנסין 2, אנדותלין וכן NO, ובנוסף קיים כאן ייצור של תרומבומודולין (אנ'). למעשה, האנדותל חדיר למים ולמומסים קטנים כגון נתרן או גלוקוז, וכן למולוקולות חלבון קטנות. מכיוון שהנקבים באנדותל גדולים יחסית, הם יכולים לפעול בעיקר כמחסום נגד תאים [מקור]. נפרין הוא חלבון טרנסממברני בחלבון העל-משפחתי של אימונוגלובולינים המצוי במעברים, בחריצים או בדיאפרגמות [מקור]. כיום מניחים כי האינטראקציה של חלבון זה (נפרין) עם נפרין (הומולוגי) מפודוציט סמוך או neph-1 (הטרולוגית) היא ה"נקבובית" של החריצים [מקור]. התחום התוך תאי של נפרין מקיים אינטראקציה עם פודוקין וחלבונים רגולטוריים אחרים כדי לעזור או הקל על סיפוח של אקטין [מקור1, מקור2]. הסיפוח וגם אופן הסידור המיוחד של חוטי האקטין (חוטי חלבון בציטופלזמה של תאים אוקריוטיים – תאיים בעלי גרעין ואברונים שמהווים חלק משלד הנוזל הציטופלזמתי הנמצא בתוך התאים) הם נושא מרכזי וההמפתח לארכיטקטורת תהליך כף הרגל של תאי האפיתל המכונים פודוציטים. נושא זה מוזכר כאן כי הוא גם גורלי וחיוני להבנת הטיפול להחלמת הכליות בכל הקשור במחלת הכליות עם התסמונת הנפרוטית התורשתית – מחלה זו היא מחלה סופנית עם פגיעה חריפה בכליות עקב גלומרולופתיה ראשונית. הווה אומר פגיעה בגלומרולוס עצמו נושא עלי פרסמתי – כאן. במקרים בהם מקור המחלה גנטית (המינימלי צ'יינג') המחלה הזו פוגעת בבני נוער בעיקר ובילדים. ההפרעות מתרחשות בתהליך כף הרגלים (פדוציטים) שמופיעים כאן, בפקעית ובמחסום הסינון. הפרעות אלו נובעות ככל הנראה ממוטציות של גן בודד במספר חלבונים קושרי אקטין המעורבים בסיפות (פילמור) האקטין כגון α-actinin-4 ו INF2 inverted formin 2 [מקור1, מקור2] זו הסיבה לשימוש באבקת קליפת רימונים – PPF כשמבקשים החלמה ממחלה איומה זו על ידי מזון כתרופה.

לסיכום תאי האנדותל הגלומרולרי, ה- GBM וחריצי הסינון בין הפודוציטים (שמהווים את רירית האפיתל של הקפסולה של באומן), וכן השכבה השלישית של הדופן בנפרון אשר דרכם מתרחשת מלאכת סינון הדם של הכליה, מתבצעות את פונקציות הסינון של הנפרונים (גלומרולוס), שבקפסולת באומן. ודווקא הם שמהווים את נקודת האכילס במחלות כרוניות שלפנינו [מקור]. כאן מנקים ומפרידים את הדם מהפסולת שבתוכו [מקור].
לכליה תפקיד מרכזי בשמירה על איזון אלקטרוליט ונוזלים מדוייק של הגוף ו/או החוץ-תאי וכן של הומאוסטזיס של לחץ הדם, בעיקר דרך מקטעי הנפרונים הצינוריים הפרוקסימליים והדיסטליים שלה [מקור].
עוד על נושא זרימת הדם בתוך הכליות אפשר לקרוא במאמרי: "זרימת דם כלייתית" – כאן.
כאמור לעיל כ-20% מהפלזמה הנכנסת לגלומרולוס (מסוננת) ועוברת לשם סינונה דרך מחסום הסינון שבנימים אל קופסית באומן, [הפוריות, (Pores] . 80% הנותרים מהפלזמה וכל תאי הדם שבה עוזבים את הגלומרולוס דרך העורק שמכונה גם הוא העורק האפרנטי (EA), efferent arteriole בהבדל מה-afferent arteriole (AA) הוא מסומן EA, באיור למעלה בצד ימין. אוסיף לנושא זה רק עוד פרט קטן שקשור במבנה הפקעית – הפקעית (גלומרולוס) מכילה שלושה סוגי תאים ותפקידם העיקרי הוא לאפשר מעבר של מולקולות קטנות (רעלים, מלחים) לחלל הקופסית תוך שמירה על רוב רובם של החלבונים.
שלושה מרכיבים של הגלומרולוס תורמים למחסום הסינון הגלומרולרי, ומונעים בריחת חלבונים לחלל השתן, עליהם להלן: תאי אנדותל (E), רקמת החיבור של הפקעית – מורכבת מהתאים המזנגיים – המזנגיום (Mesangial cells),(M) והפודוציטים
- תאי אנדותל (E)
תאי אנדותל (E) שמצפים את הנימים מבפנים ומספקים לנוזל משטח זרימה חלק המאפשר זרימה נינוחה וטובה לדם. שכבת האנדותל – מכילה גם נקבוביות גדולות יחסית (קוטר 70-100 ננומטר), ומומסים, כחלבוני פלזמה ונוזל יכולים לעבור דרכם, אך לא תאי דם [מקור]. יצוין כי תאי אנדותל אלו שבפקעית (גלומרולריים) הם תאים מאוד חשובים לסינון. ומשום כך הם גם מגודרים ושונים משכבות אנדותל אחרות בגוף [מקור1, מקור2]. תאי אנדותל גלומרולריים הם תאי המטרה העיקריים של גורם גדילה אנדותל וסקולרי A ( vascular endothelial growth factor A – VEGFA, נושא שמבוטא על ידי הפודוציטים, נושא שיובא מיד להלן,) [מקור1, מקור2] ונקשר בירידה של כמות החמצן [מקור1, מקור2, מקור3]. התפתחות הפרוטאוריה – יתר חלבון בשתן היא מחלת כליות אצל עד 20% מהחולים הנוטלים מעכבי VEGFA, היא מענינם של המבקשים להחלים ללא תרופות ונושא שמסביר מדוע עם תרופות למשל אלו אי אפשר להחלים מפרוטאוריה (proteinuria).
הערה – VEGF הוא חלבון "מאותת" המיוצר על ידי תאים שמעודדים יצירת כלי-דם חדשים לעקיפת כלי-דם סתומים collateral circulation. כאשר VEGF מבוטא ביתר על המדה, VEGF-A מהווה חומר כימוטקטי לגבי מקרופאגים וגרנולוציטים, וכן מרחיב כלי-דם (ואזו-דילטנט) באופן בלתי-ישיר על ידי הגברת הפרשה של NO. יש לו השפעה גם על אים אפיתליאליים של הכליות. הוא עלול לגרום למפגעים בריאותיים, כגון האצת תהליכים גרורתיים של גידול סרטני ויצירת עודף כלי-דם ברשתית העין, או באזורי גוף אחרים. תכשירים כגון aflibercept, bevacizumab, ranibizumab ו-pegaptanib sodium (שם מותג Macugen) יכולים לעכב פעילות VEGF ולהאט התפתחות כלי דם מזיקים אלה, כאמור 20% מהחולים הנוטלים מעכבי VEGFA, לקו בפרוטאוריה.
מתחת לשכבת האנדותל מזהים את קרום המרתף (Basement membrane) – אבר זה מורכב משלוש שכבות. תפקידו של קרום המרתף למנוע מחלבוני הפלזמה לצאת מהדם נושא שמכונה להיות מסוננים מזרם הדם.
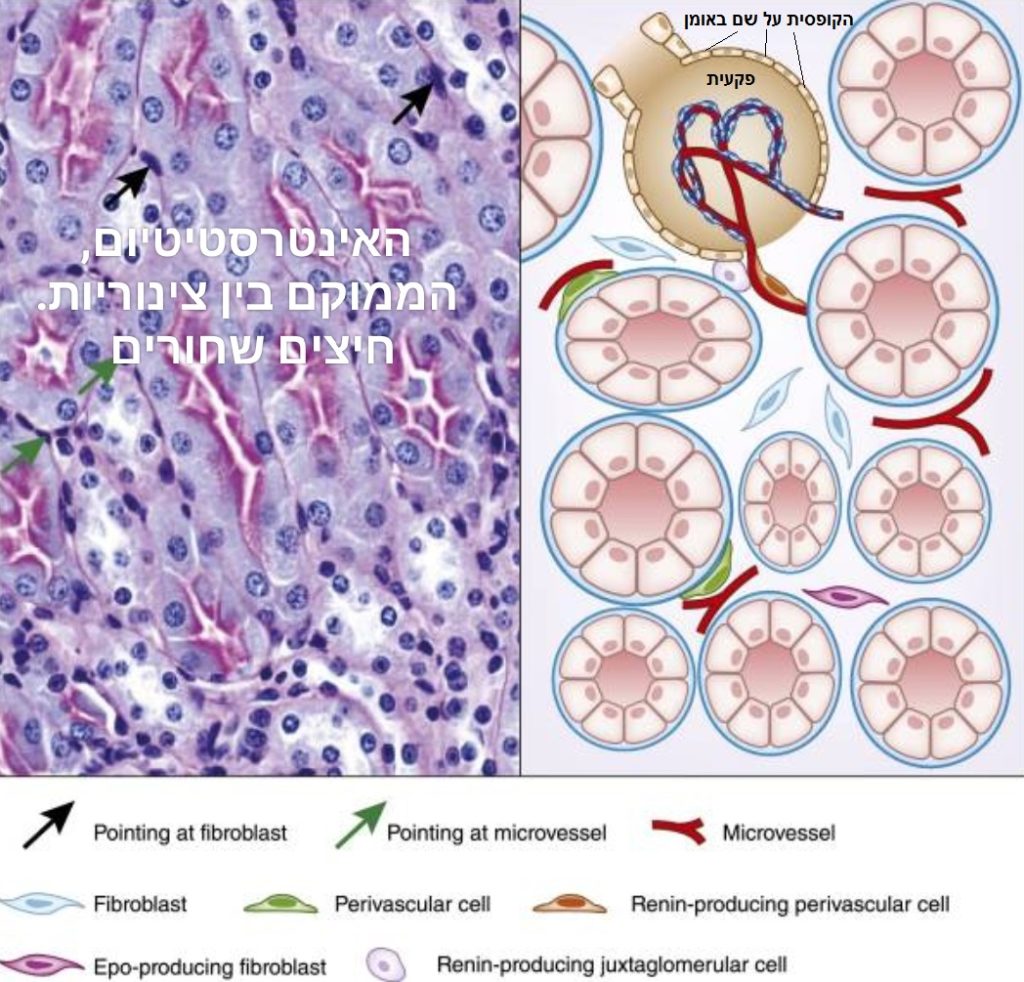
האינטרסטיטיום הכלייתי – זר הנימים שנמצא בתוך הקפסולה של באומן ומעצב את הפקעית מורכב מנימים שונים ומאוד מיוחדים בכך שהם היחידים בגוף שמוקפים ברקמה אינטרסטיציאלית (interstitial tissue. האינטרסטיום הכלייתי הוא מרחב ימי ביולוגי, חלל רציף מלא בנוזל שקיים בדרך כלל בגוף שלנו בין מחסום מבני כלשהו, כגון קרום התא או העור, לבין מבנים פנימיים, כגון איברים, למשל שרירים ומערכת הדם [מקור1, מקור2]. האינטרסטיטיום הכלייתי ייחודי ושונה מהרגיל. האינטרסטיטיום הכלייתי תחום מכל הצדדים על ידי ממברנות בסיס צינוריות וכלי דם והוא מלא בנוזל ובתאים. מדובר למעשה במטריצה חוץ תאית ויש המכנים נוזל בין תאי [מקור]. בנוסף לכך רקמת החיבור הפרי-עורקית וה-Extraglomerular Mesangium גם היא נחשבות לאינטרסטיציה נוסף וגם הוא מוגדר ייחודי [מקור]. קיים גם האינטרסטיטיום של קליפת המוח של הכליה (cortical) וליבת הכליה (המדולה הכלייתית מופיעה כאזורים משולשים (פירמידות, בתוכם פועלת לולאת הנלה, חלקו ההמשכי של הנפרון) הנקראים גם renal pyramids, מהם מתנקז השתן) שוב וגם הם נמצאו לאחרונה שונים, ייחודיים ומוגדרים כישויות נפרדות [מקור]. לאינטרסטיטיום הצינורי של הכליה מייחסים כיום חלק מהתפקודים האנדוקריניים הבולטים ביותר של הכליה [כמקורות לאריתרופויאטין (Epo) ולרנין] דלקת כליות אינטרסטיציאלית היא הפרעת כליות שמקורה על-פי רוב בתרופות (למשל מיקרופירין 100 שהוא למעשה אספירין או תרופות נוגדות דלקת לא סטרואידיות – NSAIDs), ובחיידקי מעיים: Proteus, Klebsiella, E. Coli. במחלת כליות אינטרסטיציאלית המרווחים בין צינוריות הכליה מתנפחים (מכנים זאת דלקתיים). מצב כזה יכול לגרום לכשל פעולת הכליות. הוא אחד הגורמים שמחייבים תרופות נוספות אם הטיפול מיושן וממסדי ולא יעיל בטווחים הארוכים וזאת בשל הופעת תסמינים של בצקות. הבצקות הן אחד התסמינים של דלקת כליות אינטרסטיציאלית (וכן של הפרשת יתר אלבומין מהגוף, נושא שקושר בין יתר אלבומין עם דלקת האינטרסטיטיום, יתר אלבומין יוזכר בהמשך). כל התרופות המשתנות, שמוצעות נגד התופעה מחבלות בקצב הסינון עצמו ומביאות להורדה של ה- GFR כלומר הן לכאורה מקדמות דיאליזה, לכן הן לא יעילות בטווח הארוך לדעתי. בהמשך אפרסם מה נתן לעשות במצב זה (מניסיוני) כדי להחלים ללא תרופות.
אין להתעלם מהתופעה שתרופות מחמירות את מחלת הכליות החריפה – AKI.
[מקור].
האריתרופויאטין הוא הורמון שמיוצר בכליות באזור שבין הצינורות החשובים ביותר למלאכת הסינון באינטרסטיטיום. באיור למטה הוא מתואר בצבע סגול. האריתרופויאטין (EPO) הורמון שאחראי על ייצור כדוריות הדם האדומות בגוף האדם, העדרו מוביל למחלת אנמיה כרונית וחשוכת מרפה. כתוצאה מכך האינטרסטיטיום נכנס גם למערכת האנדוקרינית
נושא זה רב חשיבות במצבי אנמיה כי האריתרופויאטין הוא גם אחד המרפאים הגדולים של מחלה זו.
למאמרי –
אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש
פרסמתי על הצלחתי להפעיל מחדש ייצור עצמי של אריתרופויאטין באינטרסטיטיום לאחר הפסקה כדי למנוע הזרקה שלו על ידי הנפרולוג של לקוח שטיפלתי בו, לדם. לאחר הזרקה אין אפשרות להחיות מחדש סינטזה של אריתרופויאטין – כאן. [מקור]. נחזור למרחב ימי ביולוגי, שבפקעית מזוית לא אנדוקרינית ובתוכו נמצאים הנימים הזעירים.
הפגועים במחלת כליות קשה ועל ייצור של פרו-קולגן. נושא זה מתחיל שם. והוא גורלי להחלמה כי הפרו-קולגן מרפא פצעים ומסלק דלקת. על ידי נטילת שיבולת שועל כתרופה, כל בקר יכולה שיבולת השועל לתמוך בסינטזה (ייצור מחדש) של מרכיבי מטריצה תאיים שנמצאים בנוזל שבין מנורות הכליה, ובשל השפעתה על ייצורו של הפרו קולגן גם על תיקון פצעים במערכת. כך שבעת מחסור בייצור הורמון האריתרופואטין (בדם). אנו מבינים שקיימת פגיעה באינטרסטיטיום הבין-צינורי, מזהים דלת חמורה בכליות ומדדי אלבומין גבוהים. נושא שניתן לטפל גם בו ללא תרופות במינון נכון של סיבי שיבולת שועל ומניפולציות על הכליות בעזרת סדרה של "לחיצות ההחלמה".
מקור האיור בצילום מסך מהמאמר: "Physiology of the Renal Interstitium" מאת Michael Zeisberg and Raghu Kalluri – כאן.
רקמת החיבור של הפקעית – מורכבת מהתאים המזנגיים – המזנגיום (Mesangial cells),(M) תאי המזנגיום ממוקמים בחלק המרכזי של הגלומרולוס ומספקים תמיכה מבנית. במצבי חולי המוכרים כיתר אלבומין – המצאות של אלבומין רב בשתן כידוע יכולה להצביע על בעיה בתפקוד הכליות. יתר אלבומין מצביע על בעיה שיכולה להיווצר כאשר חורי המסננת – הפנסטרציות, שהוזכרו למעלה ונמצאים באופן טבעי בנימי הכליות ויוצרים את מחסום הסינון, שבדפנות הנימים [שמם-הפוריות, ( – נקבוביות Pores)] מתרחבים, ומה שאנו מכנים לרוב "המסננת" מתקלקלת כך גם המטען השלילי הקיים בה באופן טבעי שם נעלם. במצב זה, החלבון אלבומין, אשר במצב תקין נדחה מדפנות הנימים בגלל שהמולקולה שלו גדולה מדי למרווח, או לחריצי הפנסטרציות ובגלל מטענו החשמלי השלילי (מינוס דוחה מינוס), הוא מצליח לעבור ולחדור לתוך גוף הכליה, אל קופסית באומן. מצב זה מאוד רע. חומרי הזנה חיוניים מסולקים מהגוף. הכליה מצליחה במצב זה לסנן רק חלק מהאלבומין ולהוציא אותו דרך השתן, אולם חלקו האחר לא חוזר לשימוש הגוף אלא שוקע בגוף הכליה. המשקעים המדוברים נכנסים אל המזנגיום (Mesangial cells), רקמת החיבור של הפקעית, וסותמים אותה. בנוסף לכך הגוף חווה אובדן אלבומין ככל שמדדיו בשתן עולים.
ירידה בריכוז האלבומין בדם גורמת לבריחת נוזלים מכלי הדם לרקמות, ואז עלולות להיווצר בצקות.
לאלבומין שני תפקידים עיקריים בגוף האדם:
1. האלבומין מהווה גורם עיקרי במניעת היציאה של נוזלי הדם מכלי הדם לרקמות הגוף (הוא יוצר לחץ אונקוטי חיובי). לפיכך, הביטוי העיקרי של ירידה ברמות האלבומין הוא הצטברות נוזלים ברקמות וההופעה של בצקות: ברגליים (בעיקר סביב הקרסוליים), בריאות ובחלל הבטן (מיימת). נושא זה מטופל בתהליכי החלמה הכליות על-ידי שימוש ב"לחיצות החלמה" ונטילת אצות מסוג ווקאמה. בנוסף לשינוי תזונה ומזון כתרופה.
2. תפקידו החשוב השני של האלבומין הוא בקשירת רכיבים חיוניים בזרם הדם, שם הוא משמש כמשאית הובלה עבורם. רכיבים כגון: הורמונים, חומצות שומן, יסודות קורט, ובילירובין נישאים בזרם הדם על גבי האלבומין. כמחצית מכמות הסידן בדם קשורה לאלבומין, המשמש נשא של סידן לרקמות. תסמונת נפרוטית, הוזכרה למעלה. היא מצב בו אלבומין נעלם ממחזור הדם ולא עומד לשרות הגוף. פגיעה זו גם מכונה אובדן מוגבר של חלבון בשתן. רמת אלבומין נמוכה בדם מזוהה עם מצבים של דלקת חריפה או כרונית כגון מחלות ראומטיות, מחלות קולגן, תהליכים גרנולומטיים, ברוב ההדבקות הבקטריאליות, הדבקות נגיפיות הכרוכות בהרס רקמתי, מצבי נמק רקמתי (בעיקר אלה שמתרחשים בממאירות), וסקוליטיס, במחלת מעי מכייבת, בדלקת הקרומים (serositis), וכן באנדוקרדיטיס בקטריאלית תת-חריפה (SBE). מה שפחות מדובר בו קשור בהומוציסטאין, בדרך כלל כשמדד הקריאטינין עולה (בדם) והאלבומין עולה בשתן ומוביל להיפואלבומינמיה רמות האלבומין נמוכות בדם 3.3 – 3.4 ומטה (נושא ששב ומצביע על בעיה בספיגה החלבון אלא שבשלב זה אנחנו מבקשים לפתור את הבעיה, לא לנפק עוד תרופות), הרי שמדובר כאן על מספר אפשרויות אחת מהן תת תזונה ומחסור ביסודות הזנה.
למאמרי
רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
מצב זה הגיוני כאשר הגוף נעדר משאיות הובלה (אלבומין) לצרכי הזנה. כאן ראוי לציין שתרופות רבות מוסיפות נזק על כך כי הן מרוקנות את הגוף מיסודות הזנה חשובים ביותר כך למשל המיקרופירין 100 הוא למעשה אספירין, תרופה שמרוקנת מהגוף ויטמין C, מלטונין, ניאצין (מגן הלב, מוריד כולסטרול), חומצה פולית (שמגנה מפני טרשת עורקים, דיכאון, אנמיה, ויתר לחץ דם), ואת הפירודיקסין (שומר על שמחת חיים). דוגמא נוספת – טימולול – דורזולאמיד – כדור נפוץ ששיך למשפחת חוסמי בטא ומצוי בטיפות עיניים ומשמש להורדת לחץ תוך-עיני מוגבר המאפיין את מחלת הגלאוקומה. החומר אחראי על ייצור יוני ביקרבונאט – התרופה מרוקנת את מאגרי ה- Q10 מהגוף ואת מאגרי המלטונין. חסר באבות מזון (תת-תזונה) משתקף אף הוא בבצקות. בתפריט תזונה מחלימה ממלאים חסרים אלו כדי להגיע למדדי אלבומין תקינים. נושא זה שב ומוכח בקליניקה של "לחיצות ההחלמה" כקל להשגה. אבל ההומוציסטאין (Hcy) הוא נושא מרכזי ומשום שבארץ לא מודדים אותו, ולמרות שידוע כי חולים עם מחלת כליות נוטים להיות היפר-הומוציסטינמיים [מקור]. במחקר שנעשה בישראל עצמה ודווח עליו בשנת 2014 הוכח כי הירידה השנתית ב-eGFR הייתה גבוהה ב-25% בנבדקים עם Hcy מוגבר [מקור1, מקור2]. ראיות מסוימות מצביעות במחקרים על כך ש-HHcy מגביר את הלחץ החמצוני [מקור], שעלול לגרום לתפקוד לקוי של תאי אנדותל ומסנגיאל (MC), לגרום ללחץ תוך-גלומרולרי מוגבר ו/או לירידה במטען הגלומרולרי ובסלקטיביות הגודל, ובכך לגרום למיקרואלבומינוריה במיוחד בקרב נבדקים שאינם חולי סוכרת [מקור]. מכל מקום בשלב זה בישראל למטפלים כמוני נתן רק להעריך את מצבו של ההומוציסטאין בגוף בדרכים עקיפות: תאווה לסוכר נקשרת באלבומין נמוך בדם ולהפרשת האלבומין בשתן שמקורן באינסולין לא מאוזן, כלומר בתנגודת לאינסולין – שנמצאת מעל 2 – נושא שאני מתאר ב"תוכנית לשיקום הכליות". הטיפול של הכליות בקריאטינין דומה לזה של ההומוציאסטין, כך שאפשר להבין מהפרשת הקריאטינין בשתן על מצב ההומוציאסטין בגוף [מקור1, מקור2, מקור3]. מדובר בצורה מאוד מורכבת של אבחון אשר מטרתו להביא להחלמת הכליות ובמקרה שלפנינו לשפר ולתקן את המסנגיום שבפקעית, גם להצר מחדש את המרווחים שמפרידים בין הפודוציטים.
מזון כתרופה – מחסור בגורמים תזונתיים, כגון חומצה פולית – ויטמין B9 (מק"ג), ויטמין B6 או B12, פוגעים במסלולים המטבוליים של ההומוציאסטין Hcy ועלולים לגרום למדדי יתר –HHcy [מקור]. יותר מכל לחומצה פולית (אבוקדו, ברוקולי, ואספרגוס, גם אפונה, עדשים וכוסמת ירוקה) יש את ההשפעה החזקה ביותר של הורדת הומוציאסטין Hcy במחזור הדם [מקור]. חומצה פולית, B12 ו-B6 ( ויטמין B6 יעיל מאוד בצורתו הטבעית – מהתפריט המחלים והבריא. הוא נספג מהמזון באופן פסיבי ב-ileum וב-jejunum, והוא נמצא באבוקדו, תפוח אדמה חי, אפונה ושעועית גם בלחם מקמח מלא, שמרי בירה, גזר וריקוטה – גבינה). תוספת יומית של 0.5-5.0 מ"ג חומצה פולית ע"פ הניסיון מורידה בדרך כלל בתוך זמן קצר את רמות Hcy בפלזמה בכ-25%. כאשר האדם מוסיף על כך ונוטל 1000 מ"ג ויטמין B12 מסוג מתילקובלמין ומנת כוסמת ירוקה לצד תפוח אדמה חי תוצאות ההחלמה מהירות יותר (תלוי במצב תחילת הטיפול כמובן) כאשר אנחנו שבים ומזהים העדר קצף או בועות, בעת הטלת שתן, אנו יודעים שאנחנו בדרך ההחלמה גם בסוגיה זו [מקור]. בדיקות דם בשלב זה מאשרות את חזרת האלבומין לטווח הנורמה מה שמשקף תיקון הכליות הסוררות במרחב מחסום הסינון, גם את שיבתו של ההומוציאסטין מסורו. על ההומוציאסטין אפשר לקרוא עוד –כאן וכאן.
קליפת רימון מחזקת את קרום המרתף, נושא שהוזכר למעלה, ובכוחה לשנות מצב זה ביחד עם גורמי החלמה נוספים, אשר חלקם הוזכר למעלה. בנוסף מצב של סילוק יתר של אלבומין מזרם הדם עלול להתבטא במחלות כגון: סוכרת, מחלות ממאירות (לימפומה, ליקמיה, מלנומה), זאבת אדמנתית מערכתית ובמחלות זיהומיות שונות גם באי ספיקת כליות. מה שמחייב בתהליכי החלמת הכליות להביא ראשית כל להחלמה ממחלה הסוכרת. נושא זה שב והוכח כאפשרי.
הערה: Reactive oxygen species) ROS) נמנה על הרדיקלים המחמצנים והמזיקים ביותר בגוף האדם – הוא תוצר של יתר הומוציאסטין. הROS נמנה על האויבים העיקריים של צנרת הגוף בכלל והכליות בפרט. הוא בעל יכולת פגיעה בחלבונים תאיים, ליפידים, תאי האנדותל גם ברקמת החיבור של הפקעית – ובתאים המזנגיים – המזנגיום שמרכיבים אותה, ו- DNA, מה שמוביל לנגעים קטלניים שמתבטאים בירידה חמורה של ה-GFR. כולל פגיעה בתאי האנדותל שתורמת לדלקות, קשיות עורקים, דלקת עורקים, צנרת של הכליות העליונה (מיקרואלבומינוריה – מבטאת פגיעה זו ומובילה אל חשד בפגיעה במערכת חריצי הסינון בין הפודוציטים [מקור].), בנוסף לייצורם של חומרים מסרטנים וכן מי שמעודד שבץ מוח, התקפי לב, פגיעה בצנרת הדם – קרעים, פיצוצים, התרחבויות וירידה בחוזק העצם, גם ירידה בתפקוד הכליות. קשה להבין מדוע הוא נעדר מרוב בדיקות הדם בארץ [מקור].
אלבומין בדם – 3.50 -5.50 (תקין) הופעת חלבון בדם (אלבומין) או דם בשתן מלמדת שכלי הדם הללו שבנפרון נתקפים. יש ותרופות אנטי דלקתיות מקור הבעיה. תוספת של כורכום (3 כפיות ליום, בקר, צהריים וערב) יכול להוריד במשך הזמן את הדלקת שנוצרה כאן. לחלופין אם בדיקת השתן מראה 0, = שאין אלבומין בשתן הבעיה הכלייתית לא דלקתית ולא בכלי הדם הקטנים שבנפרונים. הנפרונים שלמים אבל אם מדד ה- GFR ירד את ה- 90 הנימים שבפקעית מתקשות לעבוד כראוי ויש חשד ליתר הומוציסטאין בדם.
אלבומין בשתן עולה הוא גם אות אזהרה. אם הוא עולה על 30 מיליגרם ל-24 שעות = דלקת בדופן הנפרון. מדד זה רוצה לומר קלוטו – על קלוטו אפשר לקרוא עוד כאן.
2. רקמת החיבור של הפקעית – מורכבת מהתאים המזנגיים – המזנגיום (Mesangial cells),(M)
תאי מסנגיאל – Mesangial cells – כיווץ כלי דם בכליה, למעלה הוזכרו כיעד לפגיעה על ידי ההומוציאסטין. טיפול בנושא זה קשור בתפריט שמבוסס על "צום חלבונים" נושא עליו פרסמתי מאמר – כאן.
מאחרי הקלעים של חלק ניכר מחולי יתר לחץ דם נמצאת הפרעה כליתית ראשונית ונסתרת המתבטאת בספיגת מלח מוגברת (sodium retention), או בכיווץ כלי דם בכליה וירידה בהמשך הדרך בסינון הגלומרולרי [מקור1, מקור2, מקור3].
תאי המסנגיאל הם מהיסודות החשובים להבנת מקורותיו של יתר לחץ דם ללא קשר לאנדותל
נפרוסלרוזיס
[מקור]. תאי מסנגיאל, mesangium עלולים לגרום נזק לכליות, בשל תפקידם לשחרר ציטוקינים דלקתיים. כך הם ובעקיפין מביאים להרמת לחץ דם לצד דרדורו של ה-GFR, לאי ספיקת כליות בשלב הסופי. בהתדרדרות מצבם של תאי רקמת החיבור המסנגיאל נמצא אחד היסודות להבנת מקורותיו של יתר לחץ דם ללא קשר לפגיעה באנדותל, אובדן גמישות העורקים בדרך כלל נקשרת בפגיעה באנדותל, שמביאה בהמשך הדרך בסיוע מערכת של רדיקלים חופשיים פוגענית להסתיידות העורקים [מקור1, מקור2, מקור3, מקור4, מקור5]. רקמת החיבור של הפקעית (המסנגיאל) גם יכולה להתקשות, כך שגמישותה של הרקמה הולכת ואובדת. התעבותה של רקמת החיבור בכליות מכונה: נפרוסלרוזיס nephrosclerosis [מקור]. היצרות כלי הדם המשכה, ופירושה פחות דם מגיע לרקמה עצמה ובהמשך מתעורר לחץ מורכב של חוסר חמצן – פחות חמצן מגיע לתאים המזנגיים שמרכיבים את רקמת החיבור של הפקעית והמחלה מתעצמת.
מדובר בחבלה ישירה באספקת חמצן וחומרי הזנה לתאי הפעלה כולל לאיברים בוגרים
[מקור]. מתחילים לזהות מוות של תאים ברקמות (איסכמיה ischemia – הגבלה בזילוח דם לרקמה). נוצר מרחב צמיחה לגורם גדילה אנדותל וסקולרי A אשר תאי אנדותל גלומרולריים מושכים אותו אליהם ומשמשים לו קו מטרה [מקור] אבל גם תאי האנדותל בהיפופיזה משמשים לו קו מטרה דומה [מקור]. האינטראקציות התאיות של גורם גדילה אנדותל וסקולרי A בין אנדותל כלי הדם ומערכת אבר הכליה, בנוסף לתפקידו של Vascular endothelial growth factor (גורם גדילת אנדותל כלי דם ( A VEGF) כגורם חדירות כלי דם (VPF) [מקור] שותפות בוויסות ההתנהגות של אוכלוסיות תאים לא אנדותליות על מנת ליצור שיבוש [מקור]. מדובר בחלבון איתות שמעורר צמיחת כלי דם מכלי דם קיים (סירקולציה צדדית) כדי לעקוף כלי דם חסומים. הוא נושא מרכזי בצמיחה של מחלות כרוניות שהרי הרחבת רשת נימי דם הנה גם הרחבת הובלת מזון מה שיכול לתרום למחלות קשות עוד יותר. סוגי סרטן הרסניים לא יכולים לגדול מעבר לגודל מסוים אלא אם כן תיווצר להם אספקת דם מספקת. סוגי סרטן שמבטאים את הפעילות של VEGF מסוגלים לגדול ולעשות גרורות במוח, ברשתית העין ובכליות גם בלב, ובעצם. [מקור1, מקור2, מקור3, מקור4, מקור5]. יצוין כי לחץ הזלוף הגלומרולרי עולה בנפרונים המתפקדים, או הבריאים שנותרו על מנת לתקן ולסייע או ליצר סינון יתר מפצה על הנעדר ומה שמעלה כאן, בעקיפין את יתר לחץ הדם הכללי [מקור1, מקור2, מקור3]. גורם גדילת אנדותל כלי דם A (VEGF) הוזכר למעלה כמי שפוגע בתאי האנדותל וגורם חדירות יתר בתאי אפיתל. תאים פגועים שנראים באיור למטלה (B) הם נושא מרכזי ויעד לטיפול תרופתי (כושל) במערך הנפרולוגי. אפשר לראות באיור למטה, במרכזו (C) תהליך החלמה ובניה מחדש של דופן אַבּוּבִית הַכִּלְיָה (טובול), הבנויה תאי אפיתל שנארגים מחדש. מאחרי תיקון זה של דופן הנפרון שתוצאותיו סילוק דלקת ופגיעה בדופן הנפרון העליון (האבובות המקורבת), וכן פיטוכימיקלים בשם סולפורפאן (sulforaphane) שנחשפו בשנת 1992, על-ידי החוקר היהודי טלאלאיי [מקור]. בפועל עומדת כאן מנת נבטי ברוקולי, שמן נבטי ברוקולי או גרעיני ברוקולי בהתאם למימון הנדרש גם פרחי ברוקולי. החלמת הכליות המודלקות מתחילה למעשה מהשלב בו הגוף מתחיל ליצר את הגלוטתיון בעצמו – הגלוטתיו הוא מעין מרפאה צמודה ורופא נייד שמתרוצץ בגוף ומתקן כמעט כל מה שהתקלקל בו כולל מתן סיוע לתאים פגועים באַבּוּבִית הַכִּלְיָה (טובול), כפי שנראה באיור למטה (דופן צנרת הכליה). תאים פגועים יכולים (בעזרת מנת ברוקולי) להשיב לדופן הצנרת את כושרי פעילותה, כפי שרואים זאת בפועל, ומזה זמן רב בקליניקה של "לחיצות ההחלמה", בה אני פועל. בנוסף למעלה דובר בהרחבה על פגיעה באינטרסטיטיום הצינורי. אחת הסיבות לפגיעה זו עלולה לנבוע מצטבר של מעיים: Proteus, Klebsiella, E. Coli. ככלל מעבר של חומרים לא רצויים לגוף מוגדר על ידי הגוף עצמו כפלישה או חדירה של חומרי רעל, זר אל מחזור הדם. כשמערכת החיסון מזהה את אותם רכיבים שהוגדרו רעלניים, היא תוקפת אותם, עוד טרם הגיעו לפקעית הנפרון. כך למעשה מתחילה תגובה דלקתית-חיסונית, שיכולה להשפיע על שאר מערכות הגוף. קרול ל. רוברטס מגסטרואנטרולוגיה, המכון לרפואה, באוניברסיטת ליברפול, L69 3GE ליברפול, בריטניה, הראה במאמר שפורסם בשנת 2013, כי סיבים צמחיים מסיסים מסוג אלו שנמצאים בברוקלי או בבננה פלאטנו עשויים גם לשפר את הבריאות של דופן המעי עצמו על ידי עיכוב הדבקת האפיתל ומניעת טרנסלוקציה (החלפה של מידע גנטי בין כרומוזומים של תאי ההגנה של המעי ואחרים) של תאי מערכת החיסון ונטרולה על ידי חיידקים פתוגניים שתוקפים אותה [מקור].
בעזרת צרור נבטי ברוקולי 3 פעמים בשבוע כתוספת לסלט.
אפשר למנוע מעבר או התקפה של חיידקי מעי על האינטרסטיטיום הצינורי ובהמשך למשל למנוע חבלה בסינטזה של אריתרופויטין (EPO) Erythropoietin.
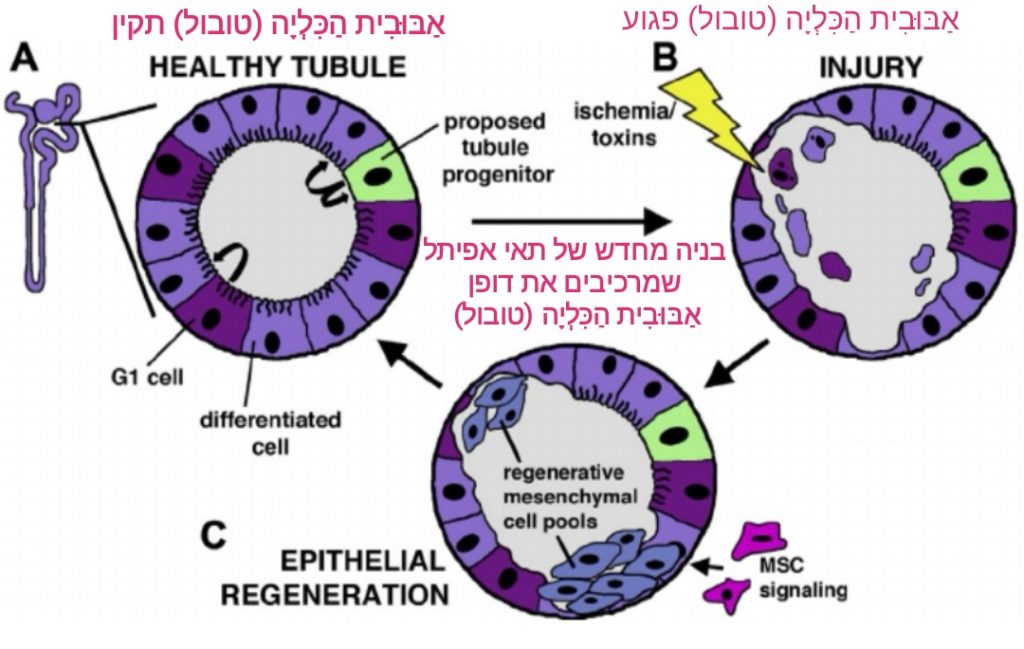
נחזור להעדר או מחסור בחמצן. הוא יסוד הבעיה כאן וחובה על המבקש להביא להחלמת מערכת הסינון ויצירת השתן בכליה לפתור גם אותה.
3. הפודוציטים
הפודוציטים – הסוג השלישי של התאים שאני מבקש לציין במסגרת הפרק: שלושה מרכיבים של הגלומרולוס אשר תורמים למחסום הסינון הגלומרולרי, ומונעים בריחת חלבונים לחלל השתן.
הפודוציטים (PO – the podocytes) – תאי רגליים. תאים אלו הם תאי אפיתל מיוחדים שממוקמים בקפסולה של באומן והם עוטפים את הנימים של הגלומרולוס שבתוכה בעזרת רגליים ארוכות שיש להם – רגלים שמכונות פדיקלים (The pedicels), הפודוציטים מהווים את רירית האפיתל של הקפסולה של באומן, הם גם השכבה השלישית שדרכה מתבצע סינון של דם שם [מקור]. רגלי הפדוציטים עוטפות את הנימים, אבל משאירות חריצים קטנים, רווח ביניהן. דם מסונן דרך חריצים אלה, המכונים חריצי סינון, או נקבובית חריץ. גם כאן מווסתים סינון של חלבונים, מונעים מהם לצאת מזרם הדם אל הנפרונים. המרווחים האלו שבין רגלי הפדוציטים – הפדיקלים גדולים מספיק כדי לאפשר לסוכר ולמים לעבור דרכם אבל קטנים מכדי לאפשר לחלבונים לעבור. מעבר של חלבונים פרושו מרווחים מוגדלים שסיבתם מחלה. מרווחי יתר מתרחש במצבים של מחלת כליות ואי ספיקת כליות נושא שניכר ביתר חלבון (אלבומין) בשתן ומזהים אותו בקצף או בועות, בעת הטלת שתן [מקור]. יש להניח שהפרוטאינוריה (פרוטאין = חלבון, ביוונית: πρώτα פְּרוֹטָה) מתרחשת בשל חדירה של חלבוני פלזמה דרך המרווחים שמפרידים בין הפודוציטים במצבים של אובדן או פגיעה ברגלי הפדוציטים ( foot process effacement) הוכח שתהליך זה הפיך [מקור]. לרפואת הממסד אין עדיין מענה לבעיה זו, הגם שהיא מאוד קלה לפתרון בשיטת המזון כתרופה שמלווה ב"לחיצות ההחלמה" – על נושא זה רמזתי ויותר מכך עד כאן ואפשר לקרא עליו עוד – כאן, וכאן.
אפשר לקרוא עוד על כך במאמרי – התכנית לשיקום הכליות
להיספג מחדש – פעולת ההישארות. הישארותם של מרכיבים חיוניים לגוף מכונה להיספג מחדש.
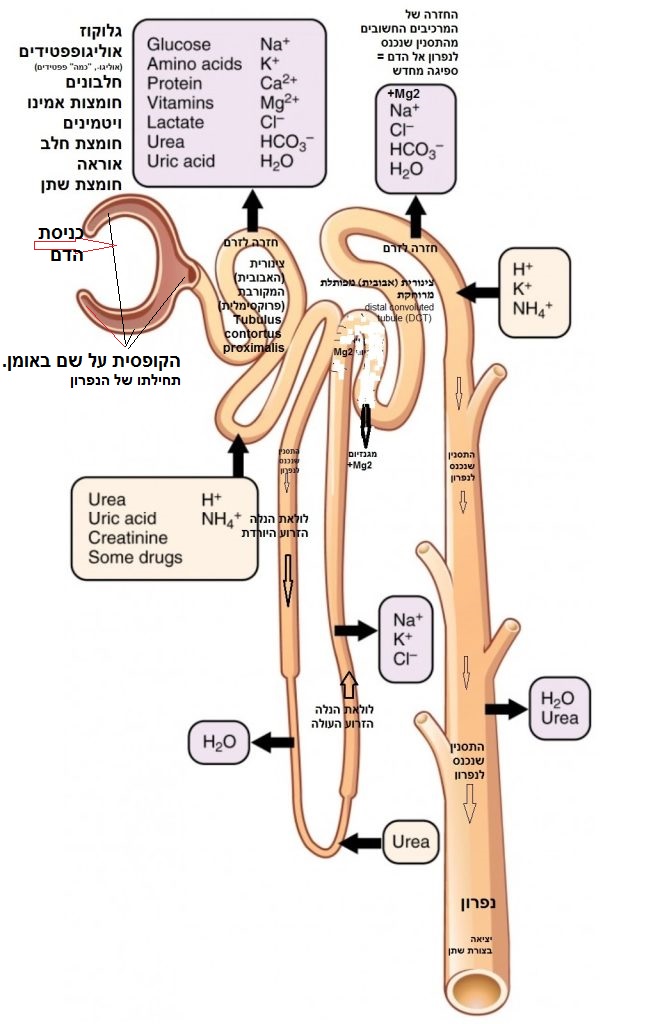
החומרים עוברים מהדם לפקעית וממנה הם ממשיכים אל הנפרון, אבל החשובים בהם לתפקוד הגוף ותחזוקתו חוזרים אליו. הם חוזרים אל הגוף נקיים ומטופלים, למעשה הם ממוחזרים לדם, ובעזרתו הם שטים אל רחבי הגוף להזנתו. בהיספגם מחדש יסודות ההזנה הללו זורמים בנהר דם שנוקה בכליות למען פעילותו התקינה והמיטבית של הגוף.
סינון – תחילת התהליך בכניסת הדם למסננת כדי לעבור סינון – הסינון הזה כולל את המתכות: אבץ, ברזל ומגנזיום ומתרחש באזור הכליות שמכונה פקעיות הכליה, מדובר באזור שופע נימי דם קטנים, רשת צפופה של נימי דם כאן המגנזיום ומרכיבים חיוניים נוספים, כמו סידן עוברים מהדם לצנרת הניקוי – אבל החלבונים נשארים בדם – הם לא עוברים ניקוי, הם לא עוברים סינון. החלבונים גדולים יותר מחורי המסננת שבפקעית מדובר בהמוגלובין ובאלבומין בשל היותם גדולים מדי הםן אינם עוברים בפקעית לצנרת הכליה – לנפרון. הפקעית שנמצאת בתחילת הנפרון לא מוצגת באיור למעלה שמראה את הנפרון מקופסית באומן ואת אתרי הספיגה החשובה (החזרתם של המרכיבים החיוניים בכללם המגנזיום, נתרן, אשלגן, סידן לשימוש הגוף והזנת התאים.).
ספיגה חוזרת – או הספיגה מחדש – חזרה של מרכיבים חיוניים לגוף – תחילה חזרה לדם. קימות כמה צורות של ספיגה חוזרת:
ספיגה טרנס/אינטרא צלולרית- ספיגה אשר עוברת דרך הדופן של צינור הנפרון.
ספיגה פראצלולרית- ספיגה אשר עוברת בין התאים בדופן הנפרון ולא דרכם [מקור].
לחץ הידרו סטטי – המולקולות הגדולות – החלבונים נשארים כאמור בנימים. נושא זה מעלה את הריכוז בנוזל הדם. ואפשר לדבר על לחץ הידרו סטטי. לחץ הידרו סטטי מתאר כלי המכיל נוזל (הכלי הזה הוא העורק או הנפרון, במקרה שלפנינו). גם כשלא מפעילים על הנוזל שבכלי לחץ חיצוני, שורר בכל נקודה בו לחץ כתוצאה ממשקל הנוזל עצמו – הוא הלחץ ההידרוסטטי. את הלחץ הידרו סטטי רושמים P. מכנים את הלחץ הזה סטאטי משום שמדובר במצב ניח. כלומר כשאין תנועה של הנוזל. בנוסף מתרחש כאן עקב הפרש בריכוז המומסים בין שתי התמיסות: הדם שמכיל חלבונים ונוזל התסנין שמכיל מולקולות זעירות נוצר לחץ אוסמוטי. הוא הוא הלחץ שמפעילה תמיסה על ממברנה חדירה למחצה (דופן הנימים בפקעית) שמפרידה בינה לבין התמיסה האחרת, התסנין שבנפרון. בנוסף לכך קיים גם הפרש בין קוטר הנימים הAפרנטים לנימים הEפרנטים (שיוצאים מהכליה עם דם נקי), וכתוצאה מכך ישנו לחץ הידרו סטטי שמאפשר סינון, כאשר הלחץ יורד מערכת וויסות של רנין אנגיוטנסין אלדוסרטון משמרת אותו [מקור].
הדם מהנימים הגלומרולריים נאסף אל העורקים האפרנטיים, המתחלקים לנימים הפריטבולריים. מערכת נימית שנייה זו מאוד חשובה –
הנימים הפריטבולריים הם ובעזרתם מתבצעת הספיגה מחדש. הם נמצאים מאוד קרוב לתאי האפיתל הצינוריים שבנפרון ויכולים לקבל אל תוכם את החומרים שמבקשים לחזור אל הדם (הספיגה מחדש). מערכת נימים זו הפריטבולריים בעלת לחץ הידרוסטטי נמוך [מקור] והיא אחראית להחזרת הנוזל והאלקטרוליטים שנספגים כאמור, מחדש למחזור הדם.
ההבדל כאן בקוטר הצנרת. שינוי הקוטר הזה, כאן של העורקים הAפרנטיים והEפרנטיים מאפשר גם, לכליה להסתגל במהירות לשינויים סביבתיים ולנתק את הסינון הגלומרולרי משינויים בלחץ הדם הכללי. רוצה לומר ללחץ הדם הכללי של האדם אין השפעה על לחץ הדם התוך כלייתי [מקור1, מקור2, מקור3, מקור4] .
מכל מקום הבדלי הקטרים יוצר גם לחץ הידרו סטטי שמאפשר סינון. נושא זה חשוב, כי
כאשר הלחץ יורד מערכת הוויסות של רנין אנגיוטנסין אלדוסרטון קמה לפעולה ומשמרת אותו.
במקרה של מחלת כליות כרונית (CKD), מנגנוני ויסות הכליות עשויים להיות לא מספיקים כדי לאזן את מהלכי הספיגה והסינון גם יחד.
רוצה להחלים ממחלת כליות כרונית ללא תרופות? – כאן.
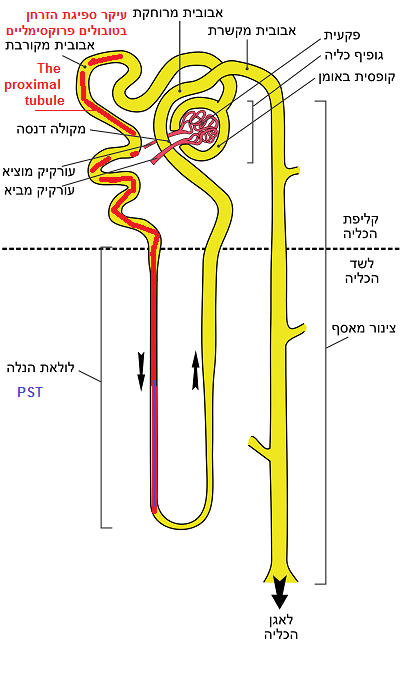
צינורית מפותלת פרוקסימלית (PCT) שמה נגזר מקרבתה לפקעית (גלומרולוס)
הצינורית המקורבת לפקעית מרופדת אפיתל קובייתי פשוט (cuboidal epithelium) שמסייע בהגדלת שטח הפנים שלה למטרת הספיגה מחדש. נהוג לסווג את רקמת האפיתל לשלוש צורות: קשקשי (squamous), קובייתי (cuboidal) ועמודי (columnar). אפיתל קובייתי פשוט הוא סוג של אפיתל המורכב משכבה אחת של תאים קובייתיים – הם מרובעים (דמוי קובייה) וגרעיניהם יותר עגולים. האפיתל הקוובידי הפשוט נמצא על פני השחלות, רירית הנפרונים, דפנות צינוריות הכליה, גם בחלקי העין, בבלוטת התריס ובבלוטות הרוק וכאמור לעיל באבובית המקורבת.
לצינורית הפרוקסימלית של הכליה (PT) יש שני תפקידים עיקריים. לספוג מחדש את רוב החומרים החשובים שנמצאים בתסנין הגלומרולרי וכמה מומסים ספציפיים, כולל חלבונים קטנים במשקל מולקולרי נמוך (LMWP), חומצות אמינו, פוספט, גלוקוז וביקרבונט, שעבורם תהליכי הובלה בנפרון הדיסטלי אינם קיימים או שהם מוגבלים במיוחד [מקור]. שנית, לסלק ולהפריש תרופות מולקולות קטנות ללא שינוי, הכליה מטפלת במטבוליטים מצומדים רבים, שרובם מיוצרים על ידי מטבוליזם של שלב 1 ושלב 2 בכבד (למשל, תוצרים של הידרוקסילציה, סולפטציה ותגובות גלוקורונידציה) [מקור]. יחד עם הכבד, הצינורית המקורבת לפקעית ה-PT משמשת כלי ומסלול עיקרי שבו קסנוביוטיקה (xenobiotic) כלומר חומרים זרים, מלאכותיים, חומרים כימיים שנמצאים בתוך אורגניזם ושלא מיוצרים בהם באופן טבעי או צפויים להיות נוכחים שם כגון זיהומים ורעלים גם רעלנים אורמיים (אינדוקסיל סולפט), כספית, חומצה אריסטולוכית. כולל יתר חומרים שהם למעשה נמצאים בריכוז גבוה בהרבה מהרגיל (חומצת שתן). תרכובות טבעיות יכולות גם להפוך לחזקת זרות לגוף האדם, לכליות אם הן נקלטות על ידי אורגניזם אחר, כגון ספיגת הורמונים אנושיים טבעיים על ידי דגים שנמצאים במורד הזרם של מתקני טיהור שפכים, או דיוקסינים וביפנילים פולי-כלוריים גם ההגנות הכימיות המיוצרות על ידי אורגניזמים מסוימים כהגנה מפני טורפים, אנטיביוטיקה והורמונים שמגיעים דרך בשר נרכש [מקור]. מכל מקום חומרים כאלו שאינם מסוננים כלומר שהגוף לא רוצה אותם בכלל בתוכו – עוברים חילוף חומרים ומופרשים החוצה דרך השתן. כדי לבצע זאת, תאי PT מטפלים במספר מעבירי תרופות ואנזימים כולל בחילוף החומרים של תרופות שלב I (חמצון על ידי ציטוכרום P450s) ושלב II (צימוד לגלוטתיון – conjugation to glutathione). -מעבירי תרופות המתבטאים באבובית המקרבת ה -PT כולל מעבירי אניון אורגני בזולטרלי (OAT-1) וקטיונים (OCT-2) המתווכים את הספיגה מהדם של נפרוטוקסין PT פוטנציאליים כגון טנפוביר אנטי-רטרו-ויראלי והציטוטוקסיים cisplatin ואיפוספמיד, בהתאמה. כמו גם מעבירי זרימה אפיקלית כגון P-glycoprotein transporter (P-gp), חלבון עמיד רב-תרופתי (MRP) ו-Multi-Drug Required Human Extrusion-1 (hMATE1), שיכול להוביל ולגרום להפרשת התרופה והצטברות תוך תאית (אפשר לראות זאת באיור –כאן) [מקור1, מקור2, מקור3].
הצינורית הפרוקסימלית של הכליה היא האתר של חיסול וסילוק של מספר עצום של מולקולות קטנות. אלה כוללות תרופות (למשל, אנטיביוטיקה, אנטי-ויראלים, משתנים, תרופות נוגדות דלקת לא סטרואידיות ותרופות אנטי-סוכרתיות). מטבוליטים חשובים מבחינה פיזיולוגית (כגון חומצה פולית, אלפא-קטוגלוטרט, אוראט וקרניטין), חומרים מזינים (כגון ויטמינים ופלבונואידים), מולקולות איתות (למשל, חומרי ריח, נוקלאוטידים מחזוריים ופרוסטאגלנדינים), רעלנים אקסוגניים (כגון, מצומדים כספית וחומצה אריסטולוכית), מוצרי מיקרוביום של המעי (למשל, kynurenine), ורעלים אנדוגניים (מה שנקרא רעלנים אורמיים, כגון אינדוקסילפט)
[מקור1, מקור2, מקור3, מקור4, מקור5].
פעמים רבות תמצאו, שחוקרי כליות, פיזיולוגים של כליות מחלקים נפרונים במאמרים שלהם לנפרונים פרוקסימליים (קרובים) ודיסטליים (רחוקים יותר). הנפרונים המקורבים הפרוקסימליים הם שנמצאים בקטע הצינורי שבין הגלומרולוס לצינור של הנלה. הצינורות הפרוקסימליים S3 (the S3 proximal tubules) כפי שניתן לראות גם באיור למטה נחלקים ל3 חלקים נוספים: S1, S2. S3. בחלק המפותל הקרוב ביותר לפקעת הסינון S1– מתחיל מסע יצירת השתן, פינוי הרעלים והחזרת היסודות החיוניים לגוף.
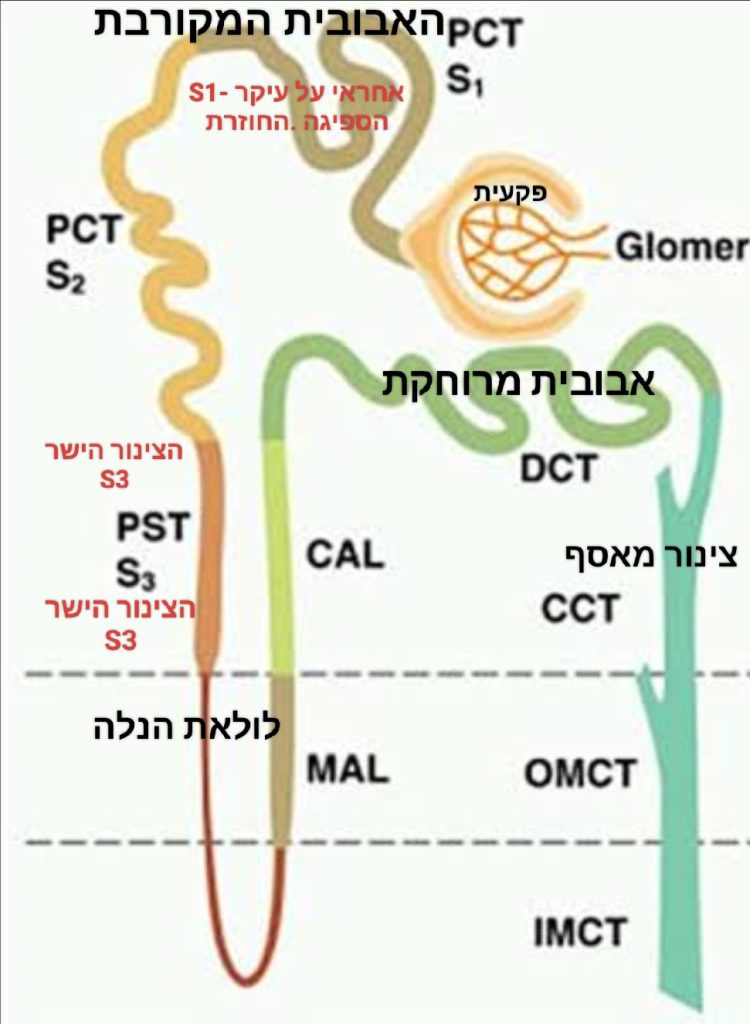
מיד, בתחילת מסע הניקוי של הדם בצינור קטן, שמרכיב את הנפרון ומכונה אבובית המקורבת (Proximal tubule PT), הוא הצינור שמתחיל את הצנרת מיד לאחר הפקעית או הקופסית של באומן נספגים בחזרה 50–60 אחוזים מהנתרן המסונן (כלומר שעבר לנפרון), כל הגלוקוז וכל האוליגופפטידים (אוליגו-, "כמה" פפטידים) וחומצות האמינו, 80 אחוזים מהזרחן, 80 אחוזים מהביקרבונט, ו-50 אחוזים מהסידן [מקור] גם הקסנוביוטיקה (xenobiotic) שהוזכרו כלומר חומרים זרים, מלאכותיים, רעלים דיאוקסין, כספית, הורמונים, תרופות… כולם מטופלים כאן. נושא המגנזיום ייחודי ואחר. ספיגת המגנזיום (Mg) שחוזר מצנרת הניקוז (הנפרון) אל הגוף, ומגיע בתחילתו את הגוף מהתזונה דרך המעי הדק העליון [מקור], מתרחשת עכשיו (בחלקה) באבובית מקורבת, באזור בו מתרחשת הספיגה מחדש גם של הזרחן, ביקרבונט והסידן שהוזכרו לעיל [מקור], יצוין כי אזור זה גם נמצא תחת השפעה של ההורמון הפארא-תירואידי (PTH). נושא עליו אפשר לקרוא בהרחבה – כאן וכאן. אזור הנפרון שבהמשך הדרך ומכונה: אבוביות המפותלות המרוחקות (שבאיור למעלה) הוא אזור מאוד מיוחד וחשוב של ספיגת מגנזיום והחזרתו לזרם הדם. ככלל ספיגת מגנזיום עדינה ויכולה להשתבש למשל במצבי אלכוהוליזם, וטיפולים כימותרפיים בציספלטין, לחסר מתכת דו ערכית. רוב המגנזיום נספגים מחדש (על-מנת להישאר בגוף) בלולאה של הנלה (Loop of Henle) [מקור] ובחלקו גם בצינורית המפותלת המרוחקת (הדיסטלית – tubule distal convoluted – DCT), שמשורטטת באיור למעלה.
באבובית המקורבת (PT) נספגים בחזרה 50–60 אחוזים מהנתרן המסונן, כל הגלוקוז וחומצות האמינו, 80 אחוזים מהזרחן, 80 אחוזים מהביקרבונט, ו-50 אחוזים מהסידן. ספיגה חוזרת של מים לגוף מתבצעת שתי דרכים- בין התאים (פארא-צלולרית- 30 אחוזים מהספיגה החוזרת) ודרך התאים (אינטרא צלולרית- 70 אחוזים מהספיגה)- על ידי תעלות מים מסוג אקווהפורין 1 (תעלות דומות מסוג 2 נמצאות בצינור המאסף והן תלויות בפעילותו של הורמון נוגד השתנה.
[מקור].
הובלת תרופות באבובית הפרוקסימלית (המקורבת PT). גם התרופות מגיעות לכליה לסינון דרך זרם הדם. הספיגה החוזרת שלהן קשורה במומסים מסוננים (S) על פני הממברנה הקודקודית של הצינורית הפרוקסימלית (PT) והיא מחוברת במיוחד לזו של נתרן (Na+), תוך שימוש בשיפועים תוך תאיים הנוצרים על ידי ה-Basolateral Na+/K+-ATPase. תרופות נלקחות מהדם באמצעות מעבירי אניונים וקטונים אורגניים בזולטראליים (OATs ו-OCTs, בהתאמה) ומופרשות אל השתן (כלומר מסולקות מהגוף במערכת הניקוז – כשתן) באמצעות טרנספורטרים ABC בעלי ביטוי אפיקלי, כגון P-glycoprotein (P-gp), חלבונים עמידים מול התרופות (MRPs) וגם תרכובת רב תרופתיות ורעלנים -1 (hMATE1). אנדוציטוזיס [בליעה תאית (endo=בתוך, cytos=תא) היא קליטת חומר אל תוך התא על ידי כליאתו בהתקפלות של קרום התא כלפי פנים, וסגירת ההתקפלות כשלפוחית.] בתיווך קולטן מספקים נתיב כניסה אפיקי לתרופות מסוננות כגון אמינוגליקוזידים (קבוצות אנטיביוטיות עיקריות. קבוצה של חומרים אנטיביוטיים הפועלים על-ידי התערבות בייצור חלבונים של חיידקים מזיקים [מקור]).
חלק מהתרופות העוברות בתאי PT הן רעילות למיטוכונדריה, ועלולות לשבש את אספקת ה-ATP ל-Na+/K+-ATPase,
וכתוצאה מכך הן מביאות גם להתמוטטות בהובלה ולבזבוז של מומסים שנשלחים אל השתן (תסמונת כליית Fanconi) ללא הבחנה [מקור].
הצינורית המפותלת הדיסטלית (DCT) בעברית האבובית המרוחקת – היא הקטע הקצר ביותר של קצה הנפרון שבכליה, המשכה הצינור המאסף.
הנפרון הדיסטלי הוא חלקה המרוחק יותר של צנרת הניקוז. אזור זה מורכב משני חלקים: מחלק תחילי (DCT1) ומאוחר יותר (DCT2). תאי הצינורית המפותלת הדיסטלית (DCT) עשירים במיטוכונדריה. (המיטוכונדריות הן המנוע שמספק חשמל למנוע כאן הצינורית המפותלת הדיסטלית שבכליות. הצורך במיטוכונדריות גדולות מרמז על עומק העבודה שמתבצע כאן ובמקביל על גודל הנזק עקב נטילת התרופות שמתרחש כאן) תאי DCT אטומים ברובם למים, וסופגים מחדש נתרן וכלוריד על פני הממברנה האפיקית דרך מסלולים אלקטרו-נוטרליים לזרם הדם הכללי, תאים אלה ממלאים גם תפקיד מפתח בספיגה חוזרת של מגנזיום, (המגנזיום חוזר לזרם הדם) המתרחשת בעיקר, דרך ערוץ פוטנציאלי של קולטן חולף (TRPM6) נושא שמיד יוזכר [מקור]. ה-DCT משמשת גם יעד להורמונים אנגיוטנסין II ואלדוסטרון; נראה שתאיה מגיבים גם לגירוי עצבי סימפטי ולשינויים באשלגן שמתרחשים בפלזמה [מקור]. בצינורית הזעירה הזו נמצאים מספר חלבוני תחבורה, כמו ה-NaCl cotransporter הרגיש לתיאזיד – ומהווה יעד של תרופות משתנות (מכונות הואפטנים) כמו דיזותיאזיד, אוקסאאר פלוס, אטקנד פלוס, וקטור פלוס, טריטייס קומפ, פמיד, שנמצאות בשימוש נרחב (Na+-Cl- cotransporter, NCC או NCCT, או בתור קוטרנספורטר Na+-Cl- רגיש לתיאזידים, ותרופות דמויות תיאזיד שתפקידו אמנם לספוג מחדש יוני נתרן וכלוריד ממסלול הובלת המלח העיקרי בממברנה הקודקודית של תאי הצינוריתה המפותלת המרוחקת (DCT) בה ידובר להלן, בבני אדם, הוא מקודד על ידי הגן SLC12A3 – היפומגנזמיה (ירידה בערכי המגנזיום) קשורה בחוסר תפקוד של חלבון הובלה זה) [מקור1, מקור2]. תאים אלה כאמור ממלאים גם תפקיד מפתח בספיגה חוזרת של מגנזיום, המתרחשת בעיקר, דרך ערוץ פוטנציאלי מושרה על ידי קולטן חולף של תעלת המגנזיום האפיתל (TRPM6), ותעלת המגנזיום האפיתל (Mg2+) (TRPM6) – Epithelial Mg2+ channel TRPM6. יסודות תחבורה אלו באים לידי ביטוי באופן בלעדי בצינורית המפותלת המרוחקת (הדיסטלית) בה ידובר להלן,. נושא זה הופך את ה-DCT לאתר העיקרי למעשה של ספיגת Mg2+ טרנס-תאית פעילה שקובעת את ההפרשה הסופית של האלקטרוליטים בשתן. בעקבות זרימת Mg2+ דרך תעלת המגנזיום האפיתל TRPM6- הממוקמת על פי הקודקוד, מגנזיום – Mg2+ תוך תאי נשלף בממברנה הבסיסית, שם הוא מוחדר אל תא הדם באמצעות טרנספורטרים Mg2+ שעדיין נחקרים ולא מזוהים. בשנים האחרונות היו עדות לפריצות דרך בתחום הספיגה החוזרת של Mg2+. גורם גדילה אפידרמיס ואסטרוגן זוהו כהורמונים מגנזיוטרופיים בשל השפעתם על תעלת המגנזיום האפיתל TRPM6. בבחינה תוך תאית, נמצא שהקולטן של חלבון קינאז C 1 משופעל ואדנוזין טריפוספט מעכב את פעילות TRPM6 דרך תחום ה-α-kinase שלו. יתר על כן, חוסר ויסות או תפקוד לקוי של ספיגה חוזרת של Mg2+ בין תאית ב-DCT נקשרו להפרשת יתר עד כדי בזבוז Mg2+ בכליות. מוטציות ב-TRPM6 אחראיות להיפומגנזמיה עם היפוקלצמיה משנית. פגם בתת-יחידת ה-γ של ה-Na+/K+-adenosine triphosphatase גורם להיפומגנזמיה דומיננטית מבודדת שנובעת מסילוק יתר של מגנזיום Mg2+ על ידי הכליות. יתרה מכך, בתסמונת גיטלמן, מוטציות ב-NCC גורמות גם לפגיעה בספיגה מחדש של Mg2+ transcellular ב-DCT.
ספיגה חוזרת של מגנזיום או הפרשה כוללים הובלה פעילה, דיפוזיה, דיפוזיה קלה, הובלה פעילה משנית ואוסמוזה. [מקור].
חסרים ממושכים במגנזיום עלולים להופיע ולגרום להפרעות בתפקודי עצב-שריר, פרכוסים, ומסוכנת מכול ההפרעה לקצב הלב.
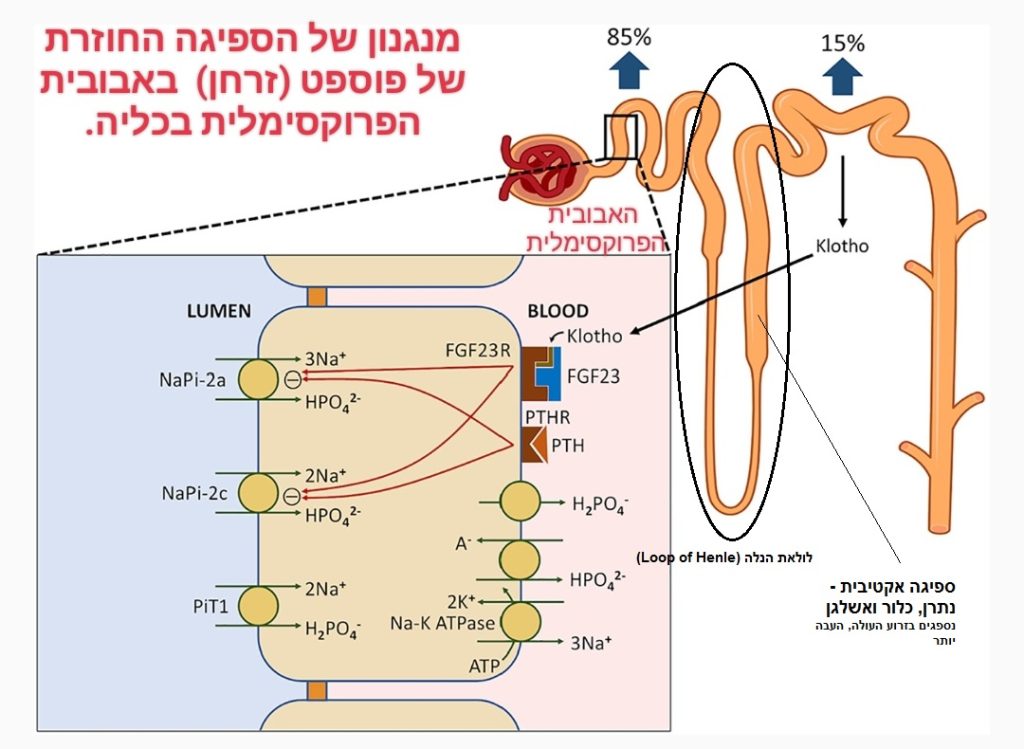
Clinical Kidney Journal, Volume 14, Issue 11, November 2021, Pages 2304–2315
– כאן.
לולאת הנלה (Loop of Henle) היא המשכית לאבובית המקורבת (Proximal tubule PT). היא מורכבת מזרוע יורדת דקה ומזרוע עולה. הזרוע העולה (TAL) מורכבת מחלק תחתון דק ומחלק עליון עבה יותר, כנראה באיור למעלה [מקור]. דפנות הזרוע היורדת עבירים (חדירים) מאוד למים ולמומסים המפעפעים דרכן ונספגים בחזרה בזרם הדם ובעזרתו מגיעים אל הגוף [מקור], כחמישית מהמים המסוננים נספגים בחזרה דרך הזרוע היורדת – הזרוע הדקה יותר של לולאת הנלה. כאן נספגים בחזרה גם כמויות לא משמעותיות של מומסים שעברו ניקוי וסינון. דפנות הזרוע העולה שבנלה, החלק העבה יותר, אטומים למעבר מים אך מאפשרים מעבר של מומסים, בחלקה העבה של הזרוע העולה מתבצעת ספיגה חוזרת מסוג שונה. ספיגה זו מכונה
ספיגה אקטיבית כרבע מהנתרן, מהכלור ומהאשלגן שבתסנין חוזרים כאן לדם לאחר שנוקו היטב. לאחרונה נמצא שגם הברזל שנמצא בתסנין חוזר לדם (ספיגה חוזרת) בלולאהת הנלה ומשמש לצרכי הגוף.
חזרתם זו כאמור פעילה והיא מאוד מיוחדת. כמויות משמעותיות נוספות של מגנזיום, שהוזכר למעלה וכן ביקרבונט וסידן נספגות כאן גם הן בחזרה לדם. כולם עוברים לדם מאותו אזור. מהלך זה מכונה כזכור הספיגה החוזרת, במהלכו מופרשים יוני מימן לתוך התסנין.
הפרשה – מעבר של חומרים מנימי הדם אל אבובית הנפרון, ההפרשה במערכת הכליה היא בעיקר מעבר של יוני מימן ואשלגן וכן שתנן (Uric acid) מנוזל הדם אל הנפרון כדי לעבור סינון וטיהור [מקור].
הגפה העולה של הנלה (TAL) נקראת לעתים קרובות המקטע המדלל (the diluting segment). האבובית העולה של הנלה בפועל תופסת מיקום אנטומי ותפקודי מרכזי בפיזיולוגיה הכלייתית. נמצא בה פעילות חיונית והכרחית להגנה על נפח הנוזל החוץ תאי, על מנגנון ריכוז השתן, הומאוסטזיס של סידן ומגנזיום, הומאוסטזיס ביקרבונט ואמוניה – Ammonia היא גם מגוננת על ההרכב של החלבון בשתן [מקור]. כאמור לעיל הצינורית העולה אטומה למים אך היא סופגת מחדש כמויות ניכרות של מלח, וכתוצאה מכך מתרחשת הפרדת של המלח מהמים. המלח נלכד במדולה של הכליה (יש להדגיש שהנפרון מונח בכליה כך שחלקו מגיע למדולה, המשולש ההפוך, הפירמידה ההפוכה שבאיור למעלה – בצבע סגול, הנפרון שם צבוע בצבע צהוב ולולאת הנלה במדולה בולטת – באיור למעלה- שם). לא כל הנפרונים שווים. נפרונים שונים ומסווגים לשם הגדרת השינוי ביניהם לפי מיקומם בקליפה החיצונית (קורטקס) או לפי אורכה של לולאת הנלה, שנרשמת: כבעלת מקטע קצר או ארוך [מקור]. נפרונים קצרי לולאת הנלה, כמו אלו שמכונים נפרונים שטחיים (משום שקליפת המוח של הכליה בה הם נמצאים שטחית) ואלו שהם אמצע קורטיקליים (מגיעים עד לאמצע קליפת הכליה) הם בעלי צינורית דקיקה אשר יורדת למטה פחות מהאחרים, אבוביות אלו נמצאת רק בתוך הפס הפנימי של המדולה החיצונית. נושא שאפשר לחזות בו באיור – כאן [מקור1, מקור2]. לעומת זאת, לנפרונים בעלי לולאות ארוכות שמקורם בפקעית בגלומרול ה-juxtamedullary ויש שמכנים אותם נפרונים עמוקים (juxtamedullary nephrons) יש גפה דקה עולה שהיא יותר ארוכה [מקור]. בנוסף לאמור בנפרונים קצרי הלולאה הצינורית היורדת מקבילה לאבובית העולה, אך אין להם בכלל איבר דק (אבובית) אין צינורית דקה שעולה; הצינורית הדקה שיורדת אצלם מתמזגת עם הגפה העולה בסמוך לפניית סיכת השיער (אפשר לראות זאת באיור – כאן). ברגיל מקובל שבקרב בני האדם רבים יותר הנפרונים קצרי לולאה מאשר הארוכי לולאה [מקור]. הסידור האנטומי של צינוריות הכליה במדולה מאוד חשוב ואפילו מכריע לגבי כל הקשור במנגנון ריכוז השתן [מקור].). נחזור אל הצינורית העולה היא כאמור לעיל, אטומה למים אך היא סופגת מחדש כמויות ניכרות של מלח, וכתוצאה מכך מתרחשת הפרדת של המלח מהמים. בעוד שהמים נסחפים אל תוך הקורטקס, הקליפה החיצונית שבאיור למעלה (משורטטת באפור) שם בקורטקס המים עלולים לחזור למחזור הדם. הטרנספורטר הספציפי לכניסת הנתרן Na+ במקטע זה הוא הקוטרנספורטר luminal Na+-K+-2Cl−, שהוא היעד של משתנים (תרופות שהורסות את הכליות ומורידות את מדד הסינון ה-GFR של הכליה) כמו פורוסמיד פוגעות בזרוע העולה של לולאת הנלה (משתני לולאה – פוזיד, פורובניר, פורוזמיד, פורוסמיד). מזהים ספיגה חוזרת של אשלגן בלולאה של Henle ו<10% מהעומס המסונן (חודר מהדם לנפרון) מגיח אל הצינור הדיסטלי המוקדם [הנפרון הדיסטלי שבהמשך הנלה מורכב משני חלקים: מחלק מוקדם (DCT1) ומחלק מאוחר יותר הכוונה כאן לחלק שמכונה DCT1] [מקור]
ה- TAL – האבובית העולה – מכילה שני תת-סוגי תאים: סוג תאים בעלי משטח מחוספס (תאי R) עם מיקרוווילי אפיקליים בולטים וסוג אחר של תאים בעלי משטח חלק (תאי S) אשר משופעים בשלפוחיות תת-אפיקליות [מקור1, מקור2] (האיור שבקישור – כאן מראה זאת)
האינטרסטיטיום הבין-צינורי שנמצא סמוך לזרוע העבה של לולאת הֶנְלֶה סופג אמוניה מחדש וממנו היא עוברת אל הגפה העולה העולה. כתוצאה מכך העברת אמוניה לנפרון הדיסטלי מהווה כ-20% עד 40% מהאמונה הסופית בשתן [מקור].
לצמתים ההדוקים (צמתים הדוקים, הפועלים כ'גדרות' נגד דיפוזיה טרנסממברנית [מקור].) של הגפה העולה ב'נלה' יש אטימות רבה יש שמעדיפים את המינוח החדירות שלהם נמוכה יחסית. התאים האלו משתלבים בתהליכים של תאים בזולטרליים, הקשורים למיטוכונדריה גדולות שמספקות את האנרגיה לתהליכי תחבורה טרנספיתל. רוצה לומר מיטוכונדריות גדולות שאבר זה זקוק להשקעת אנרגיה רבה במיוחד כדי לבצע את פעולתו. במקביל שימוש בתרופות משתני לולאה – פוזיד, פורובניר, פורוזמיד, פורוסמיד מכוונות לאזור זה. הפגיעה שלהן במיטוכונדריות הן למעשה פגיעה הרת אסון בתפקוד הכליה ומחסום מרכזי לתהליחי החלמה. נושא נוסף שקשור לנזק התרופתי שנוצר כאן הוא אבנים בכליות רוצה לקרוא עוד על תהליכי החלמה של הכליות – כאן. התאים האלו מסנתזים חלבון ספציפי, החלבון Tamm-Horsfall, ומשחררים אותו לתוך הלומן הצינורי. חלבון תהליך זה חשוב למניעת היווצרות אבנים בכליות.
אמוניה מיוצרת כמעט על ידי כל תאי האפיתל הכלייתי, מגלוטמין [מקור] אך הצינורית הפרוקסימלית (המקורבת) מייצרת אמונה (NH4+) בכליות באופן משמעותי [מקור]. מבחינה כמותית, חילוף החומרים של כל מולקולת גלוטמין מוביל ליצירת 2 יוני NH4+ ו-2 HCO3− כאשר גלוטמין עובר חילוף חומרים באמצעות גלוטמינאז תלוי פוספט (PDG), גלוטמט דהידרוגנאז (GDH) ו-phosphoenolpyruvate carboxykinase (PEPCK) במהלך חמצת מטבולית [מקור]. כאשר חמצת מטבולית (מצב בו הגוף מייצר יותר מדי חומצה) רק מגבירה את שיעורי האמוניה שמסונטזים באבובות הפרוקסימלית [מקור]. יותר מכך הצינורית הפרוקסימלית מהווה 60% עד 70% מכלל ייצור האמוניה הכלייתי בתנאים הרגלילם ולפחות 70 עד 80% בתנאים של חמצת מטבולית (דיאגרמה שבקישור – כאן – מראה זאת) [מקור]. חילוף החומרים של אמוניה כרוך בתפקוד משולב של חלקים מרובים של הכליה ומזהים כאן מספר מסלולי ייצור באבובית הפרוקסימלית [מטבוליזם של גלוטמין באמצעות גלוטמינאז תלוי פוספט (PDG) וגלוטמט דהידרוגנאז (GDH) ומערב פוספואנולפירובאט קרבוקסיקינאז (PEPCK) שהוא המרכיב המשמעותי ביותר מבחינה כמותית של אמוניאזיס כלייתי והמסלול העיקרי שמושפע מחמצת מטבולית.]. רק כמות מינימלית של אמוניה בשתן נובעת מסינון גלומרולרי, מה שהופך את האמונה לייחודית בין התרכובות העיקריות הקיימות בשתן. מבחינה כמותית, בהנחה של ריכוז אמוניה בפלזמה של 20 מיקרומול/ליטר ו-GFR של 120 מ"ל/דקה/1.73 מ"ר (התקין), כמות האמוניה המסוננת היא כ-3 עד 4 ממול/ד', 60 עד 80% ממנה נספג מחדש. ברוב המקרים, הפרשת אמוניה בשתן נעה בין 30 עד 40 ממול ליום, מה שמעיד על כך שהאמוניה המסוננת מעטה ורק מרכיב מינורי מכלל האמוניה המופרשת. כאשר אמוניה בשתן עולה על יותר מ-200 ממול/ד' (חמצת מטבולית), רמות האמוניה בפלזמה אינן משתנות באופן משמעותי ואף עשויות לרדת מעט [מקור]. הפרשת אמוניה כלייתית משקפת כמעט לחלוטין ammoniagenesis תוך-כליתית והובלת אמוניה סלקטיבית על ידי תאי אפיתל כליתי אל תוך השתן או אל מחזור הדם [מקור]. אמוניה המופרשת לתוך השתן גורמת להיווצרותו של ביקרבונט חדש. כאשר האמוניה המוחזרת למחזור הדם, עוברת מטבוליזם בכבד; תהליך זה מנצל כמויות שוות-מולריות של ביקרבונט שווה-מולרית, ובכך צורך את הביקרבונט המיוצר במהלך אמוניאגזה כלייתית. תהליך זה של הובלה סלקטיבית וכיוונית הוא מרכיב קריטי בוויסות הכלייתי של הומאוסטזיס על בסיס חומצה. בתנאים בסיסיים, כ-50% מהאמוניה הנוצרת מהכליה מופרשת בשתן וכ-50% חוזרת לוריד הכליה [מקור]. עם חמצת מטבולית, האמוניאגזה הכלייתית עולה, הפרשת אמוניה בשתן עולה, אך החזרת האמוניה למחזור אינה משתנה באופן פרופורציונלי, ולעתים אפילו לא משתנה כלל [מקור]. הובלה סלקטיבית של אמוניה לתוך השתן או מחזור הדם כרוכה בהובלה משולבת באבובית הפרוקסימלית, בגפה העולה של לולאת הנלה ובצינור האיסוף (אפשר לראות זאת כאן באיור).
האינטרסטיטיום הכלייתי – שנמצא בתוך הקפסולה של באומן והוזכר למעלה מקיף גם את הצינורית של נימי הדם הקטנטנים. באזור הלולאה של הנלה ברקמה אינטרסטיציאלית (interstitial tissue. אל החלל שמלא בנוזל שמכונה בדרך כלל מטריצה חוץ תאית זורמת מנימי הדם הסמוכים האמוניה. שם האמוניה נספגת מחדש תחילה היא עוברת מהדם אל האינטרסטיציום, ומשם היא חוזרת לזרוע העבה של לולאת הֶנְלֶה , או חוזרת לצינור המאסף ומשמשת לנטרול המימן.
האמוניה (או יון האמוניום) נוצרת בכליות במהלך הפרוק של הגלוטמין [מקור]. גלוטמין זה המגיע לכליות מהכבד דרך זרם הדם כאשר הנתרן מגיע אליהן מהדם. גלוטמין פלזמה שמגיע לפקעית באמצעות זרם הדם מסונן למעשה ב-100% על ידי הגלומרולוס והגלוטמין המסונן עובר לקופסית על שם באומן אך נספג מחדש די מהר וכמעט לחלוטין על ידי האבובות המפותלות הפרוקסימליות [מקור]. המנגנון/ים של הובלת גלוטמין באבובית הפרוקסימלית נותרו בעיקרם לא ברורים [מקור]. מכל מקום פרוק – מטבוליזם של גלוטמין מתרחש בעיקר באבוביות הקרובות לפקעית, מהלך שמייצר יוני אמוניה. מכל מולקולה של גלוטמין נוצרות שתי מולקולות של אמוניה ואניון דו ערכי אחד. מולקולות האמוניה מופרשות באמצעות הטרנספורטר נתרן/מימן (במקום המימן), כאשר בזרוע העבה של לולאת הֶנְלֶה, האמוניה נספגת מחדש לתוך האינטרסטיציום, ושם חוזרת לזרוע העבה של לולאת הֶנְלֶה, או חוזרת לצינור המאסף ומשמשת לנטרול המימן. במצבי חמצת, נוצר גירוי לאנזימים אשר מפרקים גלוטמין כדי לייצר אמוניום. היכולת של הכליה להפריש אמוניה בשתן גדלה במצב זה והיא יכולה להפריש עד פי 4 אמוניה במצבי חמצת. רמה של אשלגן בדם הנמוכה מ-3.5 מא"ק/ליטר – היפוקלמיה וכן וצריכת חלבון גבוהה מעודדים ביטוי החלבון SNAT3 שמשתתף בהובלת גלוטמין אפיקלית. ביטוי מוגבר של SNAT3 בזולטרלי מעורר ככל הנראה ספיגת גלוטמין מוגברת מהנוזל הפריטבולרי (the peritubular fluid), מה שמאפשר אמוניאגזה מוגברת. נימים פריטובולריים מקיפים את החלקים הקורטיקליים של האבובות הפרוקסימליות והדיסטליות, [מקור]-vasa recta נכנסים לתוך המדוללה כדי להתקרב ללולאה של הנלה.
הכליה לוקחת את הגלוטמין והופכת אותו לאמוניה.
הגלוטמין [מקור] במצב הבריא והרגיל בא לעודד את האנזים השולט על אחסון הגליקוגן בשרירים ובכבד (הגליקוגן משמש דלק ביולוגי). כך מיעל הגוף את פעילות מנגנון הגברת אחסון הגליקוגן. אבל,
יתרונו הברור של הגלוטמין דווקא ביצירת גלוטתיון
– במה שמכנים "מעגל הגלוטתיון" הידוע גם כמעגל ה-γ-glutamyl – מסלול יצירת גלוטתיון מגלוטמין, ציאסטין ווגליצין [מקור1, מקור2]. הוא אחד מיסודות קו ההגנה הראשון שנדרש להחלמת הכליות, אלא שכאן אנחנו מתבוננים לא במצב הבריא אלא בחריגה ממנו בו נמצא הגלוטמין בגוף ביתר –
עודף של גלוטמין רע לבריאות ומוביל לייצור הרסני שמצריך מהכליות ליצר אמוניה
– Ammonia אל מעבר לבריא. על אף שכמות האנרגיה האצורה בגליקוגן קטנה מזו שבמולקולות שומן, השרירים זקוקים לו – אבל מקורו של הגליקוגן בגלוקוז – ובגישות להחלמה ללא תרופות מדברים לכן בראש ובראשונה על הפחתת פחמימות כי מקורו מבחינת המחלה אז בתזונה רבת פחמימות, או בכשל גנטי גם בו מטפלים על-ידי מזון כתרופה. במחלה שמוגדרת יתר גליקוגן. אחד מתסמיניה מדד אוראה גבוה. ובהקשר זה בתהליכי החלמה פונים לצום (מ)פחמימות כדי לחדול מגורם המחלה ובוחנים את מדד האוראה התקין בדם. הפחתת אשלגן וחלבונים הכרחיים להשגת מדדי אוראה תקינים, נושא ששב והוכח בקליניקה של "לחיצות ההחלמה". מכיוון שהשלב האנזימטי הראשוני באמוניאגזה כולל את האנזים המיטוכונדריאלי הפנימי, PDG, הובלת גלוטמין למיטוכונדריה היא שלב קריטי. מצבים הקשור להגברת אמוניאזיס (יצירה עודפת של אמוניה) ועם הפרשת אמוניה מוגברת בשתן, כגון חמצת מטבולית, היפוקלמיה ודיאטות עתירות חלבון, ממריצים את ספיגת הגלוטמין המיטוכונדריאלי [מקור1, מקור2, מקור3], השימוש בתוסף מזון Q10, הוא שבא לסייע למגונן על המיטוכונדריה וכשהוא נמצא במינון נכון שהוא בדרך כלל גבוה ממה שעולה על דעת הנפרולוגים, הכרחי ויעיל לתהליכי ההחלמה של האזורים שנפגעו מהתרופות למשל: משתני הלולאה: פוזיד, פורובניר, פורוזמיד, פורוסמיד שפוגעים במיטוכונדריות של תאי הזרוע העולה של לולאת הנלה או תיאזידים ותרופות דמויות תיאזיד– דיזותיאזיד, אוקסאאר פלוס, אטקנד פלוס, וקטור פלוס, טריטייס קומפ, פמיד שפוגעים במיטוכונדריות של תאי הצינורית המפותלת המרוחקת וכן תרופות מסוג מעכבי האנזים קרבוניק אנהידרז – אורמוקס, דורזולמיד, דורזטול, טימודור, טרוסופט, קוסופט שמכוונות אל האבובית המפותלת המקורבת גם משתנים משמרי אשלגן – נגזרות של Pteridine מסוג: קלוריל שמכוונים אל הצינור המאסף, וכן משתנים משמרי אשלגן – מעכבי אלדוסטרון גם הם מכוונים אל הצינור המאסף. בין התופעות שניכרות בשל נזקים אלו: התייבשות גורמת גם בעיות מערכת עיכול כגון עצירות, כאב בטן, רפלוקס, צרבת, חסימת מעי ואף דלקת לבלב וכמובן עליה במדדי הקריאטינין וחיסול מהיר של מדד הסינון ה- GFR.
ספיגה של נתרן אשלגן ומים
החוקרים מצאו כי הכליה משמרת או משחררת מים על ידי איזון רמות נתרן, אשלגן ופסולת אוריאה.
[מקור] כך דיאטה עתירת מלח מעלה את רמות הגלוקוקורטיקואידים, וגורמת לשרירים ולכבד לשרוף יותר אנרגיה לייצור אוריאה, אשר משמשת אז בכליות לשימור מים [מקור].
כשני שלישים מהמים, מהנתרן ומהכלור שסוננו לנפרון נספגים בחזרה בעזרת מנגנונים פעילים וסבילים בדפנות האבובית, בדרך כלל במהלך הצמוד למעבר אקטיבי (פעיל, תוך השקעת אנרגיה) של נתרן. גלוקוז וחומצות אמיניות נספגים בחזרה כמעט לחלוטין. מהאבובית המקורבת נספגים בחזרה גם אשלגן אך את מירב האשלגן מוסתת האבובית הרחוקה. האבובית המקורבת עוזרת גם באיזון רמת חומציות הדם: במצב של עודף פחמן דו-חמצני בגוף, נוצרים ביקרבונט ויוני מימן. הוספת מרכיב בסיסי (ביקרבונט) לדם והרחקת עודף CO2 מורידים את רמת חומציות הדם.
במצב תקין, כמות המים והמלח המופרשים מהגוף בשתן שווה לכמות המים והמלח הנצרכים, כך שאין שינוי במשק המים והמלח בגוף (הצריכה הממוצעת התקינה: 2550 מ"ל מים (שתיה, מזון, מים מטבוליים), 10.5 גר' מלח. איבוד בשתן: כ- 1500 מ"ל מים וכ10 גר' מלח המופרשים ביום [מקור]. התוצאה של איזון זה בין צריכה להפרשה נובע בעיקר מוויסות הרכב השתן ומרכיביו: מים ונתרן עוברים מהגלומרולוס לקופסית באומן. שניהם גם עוברים ספיגה חוזרת משמעותית, כ- 99%, אבל לא עוברים בהפרשה. ספיגת הנתרן היא תהליך אקטיבי בעיקרו, ומתרחש בכל חלקי הנפרון: בערך 2/3 מהספיגה החוזרת מתרחשת באבובית המקורבת- proximal tubule, והשאר בלולאת הנלה, אבובית מפותלת מרוחקת ומאספת distal convoluted tubule ו- collecting duct. ספיגה חוזרת של מים מתבצעת ע"י דיפוזיה בעקבות ספיגת הנתרן [מקור]. משאבות נתרן/אשלגן אחראית על התהליך האקטיבי העיקרי בספיגת הנתרן שמתבצע על ידי העברתם של יוני הנתרן מהתסנין שבנפרון חזרה לנימי הדם. תהליך זה נעזר במספר סוגים של חלבוני מעבר.
אשלגן (Potassium) הוא היון הנפוץ ביותר בנוזל התוך-תאי, רק 2% ממנו נמצא בנוזל החוץ תאי השמירה על חלוקה תקינה של אשלגן על פני קרום התא היא קריטית לתפקוד תקין של התא. נושא זה חשוב עד כדי כל שקרום התא אינו חדיר ליוני אשלגן, כדי שהוא יעבור אל מעבר לקרום הזה יש להעביר אותו דרך חלבוני הובלה שיש להם דרך לחצות את הממברנה. עליה בריכוז אשלגן חוץ תאי יכולה לגרום להפרעות קצב בלב. ירידה בריכוז האשלגן החוץ תאי עלולה לגרום לרפיון וחולשת שרירים. האיזון של רמת אשלגן בדם (הומאוסטזיס אשלגן) חשוב ומושגת על ידי שינויים בהפרשה הכלייתית של האשלגן בתגובה לשונות בצריכתו, כשרוב הפרשת האשלגן מתבצעת דרך השתן [מקור].
אשלגן עובר סינון בגלומרולוס, ואילו באבובית המקורבת, ובלולאת הנלה עובר האשלגן ספיגה חוזרת לדם.
[מקור].
אשלגן מופרש באבובית המאספת– cortical collecting ducts שבקצה הנפרון (איור למעלה מראה זאת) מנימי הדם הוא עובר לצינורית הנפרון, ושם מתרחש עיקר הוויסות של ריכוזו בנוזל החוץ תאי. כך, בזמן שיש מחסור באשלגן לא נמצא כמעט הפרשה שלו, ואם יוצא מעט אשלגן עם השתן הרי שמדובר בכמות הקטנה שעברה סינון ולא נספגה מחדש [מקור].
הגורם החשוב ביותר בויסות הפרשת אשלגן הוא אלדוסטרון, שמגביר הפרשת אשלגן.
התאים שמפרישים אלדוסטרון נמצאים בקורטקס האדרנל. תאים אלו רגישים לריכוז האשלגן בנוזל החוץ תאי העוטף אותם, כשהריכוז של האשלגן בדם עולה הם מפרישים אלדוסטרון.
הובלת האשלגן בלולאה של הנלה מורכבת. אשלגן מרוכז בנוזל העובר דרך האבובית היורדת עד כדי כך שהריכוז בנוזל הפיטמית גדול פי ~10 מזה שבפלזמה [מקור]. יתכן שאשלגן שנספג מחדש מהצינורית העולה של הנלה (וכן בצינור האיסוף) נכנס לצינורית היורדת [מקור]. מושג זה, הנקרא מיחזור אשלגן (potassium recycling [מקור]), פירושו שהעברת אשלגן לקצה הפפילרי עשויה להשתוות או אפילו לעלות על זו המסוננת בגלומרולוס. מאחר שבגפיים דקות מבודדות של Henle חסר מנגנון של הפרשת אשלגן פעיל [מקור], מנגנון הכניסה נחשב פסיבי.
לכידת אשלגן על ידי חילופי זרם נגדי בין הגפיים העולות והיורדות של הלולאה של הנלה חשובה לתפקוד הפיזיולוגי הכלייתי. המסלול העיקרי שבו עובר אשלגן המרוכז במדולה הכלייתית ועובר דרך ספיגה חוזרת בצינור האיסוף המודולרי (ראה להלן). הצינור המאסף המדולרי החיצוני חדיר לנתרן ואשלגן, במיוחד כאשר וזופרסין (הורמון המורכב מ-9 חומצות אמינו המכונה גם הורמון נוגד השתנה) גבוה. הקשר הישיר בין הפרשת איסוף אשלגן בצינור לבין ריכוז אשלגן במדולה הוכח בניסוי [מקור].
הצינורית המפותלת הדיסטלית מעבירה את התסנין אל צינורית האיסוף ואחר כך לצינור האיסוף [מקור]. צינור האיסוף הוא החלק הסופי של הנפרון ואורכו כ 20 מילימטרים, והוא עובר דרך הקורטקס והמדולה כדי להעביר את התסנין לאגן הכליה שבקודקוד הפירמידות המדולריות. לפיכך, הוא מחולק לשני אזורים – חלקו האחד נמצא באזור קליפת המוח והאחר במדולרי. כשהחלק המדולרי של צינור האיסוף מחולק לעוד יותר לחלקים: מדולריים חיצוניים וחלקים מדולריים פנימיים. תאי האפיתל של צינור האיסוף משתנים. שינויים אלו מאפשרים להם להשתתף בהובלת יונים ומים. חדירות המים נשלטת בעיקר על ידי וזופרסין (ADH הורמון נוגד השתנה), והובלת נתרן נשלטת על ידי אלדוסטרון. צינורות האיסוף מצופים באפיתל קובודי פשוט באזור קליפת המוח ואפיתל עמודי פשוט במרחב המדולה עם ציטופלזמה שקופה. הם נמצאים בקליפת המוח באזור של הקרניים המדולריות (medullary rays היא החלק האמצעי של אונת קליפת המוח). תאי האבובות הקטנים ביותר הם הקוביים עם גרעין עגול מעניקים גוון כהה לציטופלזמה השקופה. בצינורות האיסוף הגדולים יותר תאי הציפוי הופכים לאפיתל עמודי עם ציטופלזמה חיוורת ומתאר תא ברור. הצינוריות והצינורות המחברים מרכזים את התסנין שבשלב זה הוא כבר שתן ומובילים אותו אל הגביעים של הכליה.
התפקיד המרכזי של צינורית וצינור האיסוף – ספיגה חוזרת של מומסים ומים מכאן שיכולתו לשנות את הובלת המומסים והמים רבה ותורמת באופן משמעותי ליצירת הרכב האוסמולאליות הסופי ונפח השתן. רוב האשלגן המופרש בשתן מגיע מצינור האיסוף. תהליכי ההובלה בתעלות האיסוף מושפעים ומכוונים עדין מהורמונים שהוזכו למעלה: אלדוסטרון, והורמון נוגד השתנה -ADH. צינור האיסוף מכיל שני סוגים של The principal cell of the kidney (תאי p) וCollecting Duct Intercalated Cell (תאי I – אלו תאי אפיתל בעלי תפקידים חשובים בוויסות הומאוסטזיס על בסיס חומצה.). התאים המכונים P סופגים מחדש נתרן ואשלגן, ותאי ה I מפרישים ביקרבונט או מימן. לפיכך, התא הP תורם לחילוף החומרים של אשלגן, ותאים ה-I ממלאים תפקיד חשוב בהחמצת השתן. ספיגת מומס ומים מתעלת האיסוף תלויה בעיקר ביעילות ה-ADH הפועל עליו.
החמצת השתן – התאים הצינוריים הדיסטליים מחמצים את השתן ללא תלות בריכוז הנתרן שלהם. הפרשת הצינורית המפותלת הדיסטלית של מימן מתרחשת על ידי משאבות פרוטונים פעילות. אלדוסטרון מגביר את הפרשת החומצה הצינורית הדיגיטלית על ידי פעולה ישירה על משאבות אלו. התאים מסוג 1 של צינורית מפותלת דיסטלית מקבילים לתאי הקודקוד של הקיבה מכיוון שהם מפרישים חומצה באופן פעיל. תאים אלה עשירים באנהידרז פחמני. מספר משאבות המימן המופעלות בממברנה גדל להפרשת חומצה מוגברת. חלבוני פס 3, חלבון חילופי אניוני הממוקם בממברנה הבסיסית, פועלים כמחליף כלוריד ביקרבונט. הוא מעביר יוני ביקרבונט לתוך האינטרסטיטיום; בכך, הוא שומר על יוני ביקרבונט ושתן מחומצן. מלבד זאת, מימן אשלגן ATPase, במידה מסוימת, מפריש מימן וסופח אשלגן בצינוריות האיסוף [מקור]
ספיגת הברזל – הספיגה החוזרת של הברזל
החוקרים מצאו שרוב הברזל המסונן בכליות נספג מחדש [מקור].
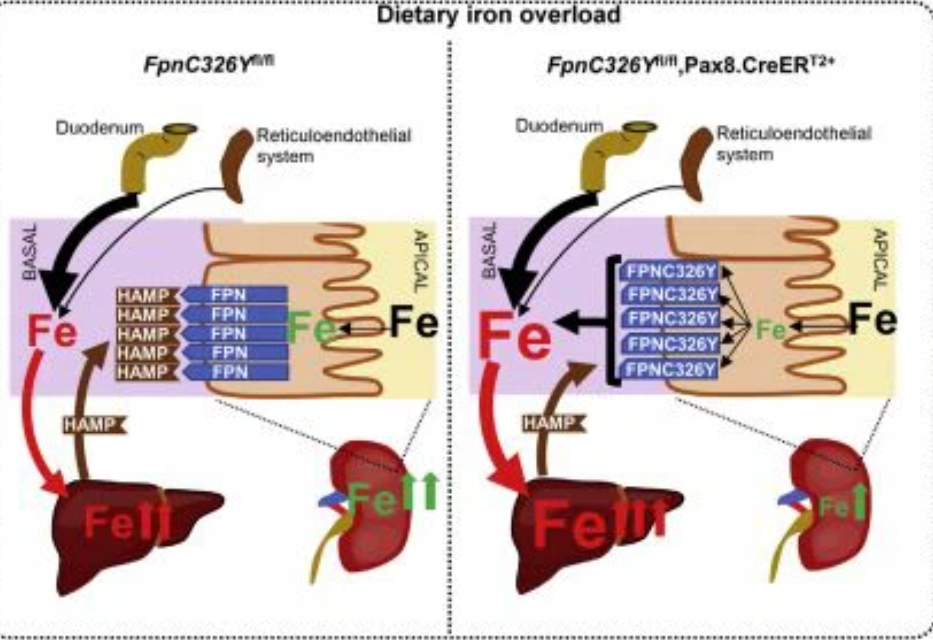
נמצא שתזונה עמוסת ברזל מגבירה את זמינות הברזל בסרום ואת רמות הברזל בפילטרט (התסנין) הגלומרולרי ומגבירה את ייצור ושחרור הפצידין (HAMP) בכבד. הפצידין מוגבר בסרום מעכב ספיגה חוזרת של ברזל על ידי חסימת FPN (ferroportin – יצואן הברזל היחיד בגוף של ברזל ממאגריו) באבובוית הכליות. עיכוב ספיגה חוזרת של ברזל גורם לאגירת ברזל כלייתית תוך הפחתת זמינות ברזל מערכתית וכתוצאה מכך לאנמיה ואף להרעלת כבד בשל עומס ברזל בכבד בו נאגר הברזל קשור לפריטין [מקור].
מתבצעת בתיווך ferroportin. ספיגת הברזל משמעה העברת ברזל לזרם הדם לשימוש הגוף. [מקור1 מקור2 Pan S, Qian ZM, Cui S, et al.מקור3 נושא זה גורלי לחולי האנמיה. ומצביע על כשל ה"טיפול" בהם על-ידי המערכת – לכאורה.
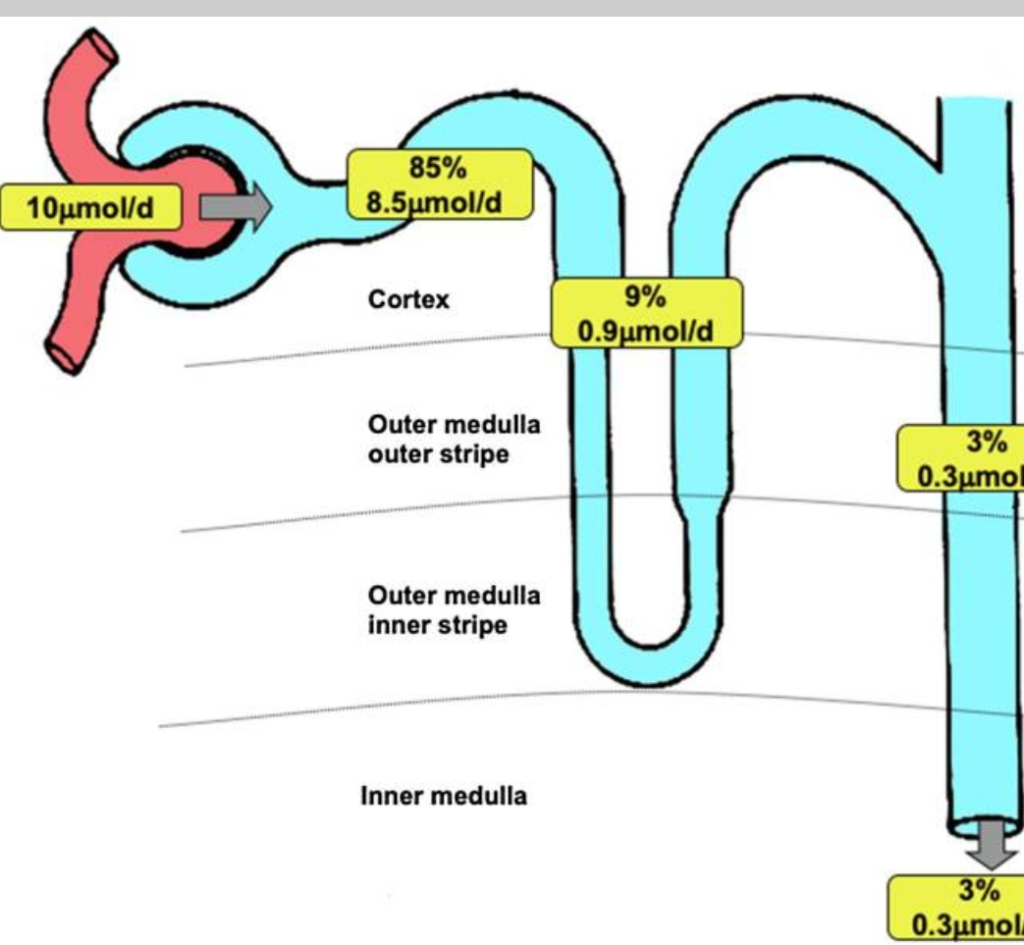
החוקרים מצאו שרוב הברזל המסונן בכליות נספג מחדש בלולאה של הנלה וצינור האיסוף, ובהמשך הברזל עומד לרשות הגוף [מקור]. הלולאה של הנלה וצינורות האיסוף נמצאו כאתרים העיקריים של ספיגה חוזרת של ברזל באבוביות של הכליות (FPN כלייתי תורם לספיגה מחדש של ברזל. מהלך זה מושפע בחולי אנמיה לרעה על ידי ההפצידין שנוצר בכבד.
החלשה של ההפצידין היא מטרת העל של הטיפול ללא תרופות במחלת אנמיה, כאשר הפריטין תקין – כלומר מאגרי הברזל בגוף מלאים. יש ברזל בגוף, אבל בחלקו הוא לא זורם בדם אלא ממשיך בתסנין ויוצא בשתן.
החלשה של ההפצידין אם כן, היא מטרת העל ומי שאמורה לחזק את תפקודו של FPN כלייתי [מקור]. על מנת שברזל יחזור אל הגוף. עד כה היה ידוע שברזל נספג רק במערכת המעי ומגיע ממערכת העיכול (תריסריון, ג'חנון ומעי דק עליון). החידוש בכך שברזל שמגיע למשל ממיחזור תאי דם אדומים זקנים ממשיך עם זרם הדם לכליות ונספג מחדש בכליות בלולאה של הנלה וצינורות האיסוף הם שנמצאו כאתרים העיקריים של ספיגה חוזרת של ברזל באבוביות של הכליות [מקור].
מספר הנפרונים בכליה נמצא בויכוח אך הוערך לראשונה על ידי אייזנהרדט (Eysenhardt) ב-1818 (131; 212) [מקור1, מקור2]. כיום סבורים שבכל כליה אנושית פועלים בין -800,000 למיליון נפרונים [מקור].
בזכות פעולת הכליות הרכב הדם נשמר קבוע יחסית לאורך הזמן וכך גם ההרכב של הנוזל הבין תאי ברקמות השונות. הסביבה היציבה מבטיחה תפקוד יעיל של התאים.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
For the avoidance of doubt, consult a physician (who knows in detail the general health of each patient or yours) before using any medicine, food, extract or any exercise. The information on Yaron Margolin's website or the "Healing Presses" website (on Facebook or MARGOLINMETHOD.COM), in the above article and in Yaron Margolin's articles are material for thought – philosophy neither recommendation nor public guidance to use or cease to use drugs – no information on this site or anyone You should always consult with a qualified physician or pharmacist regarding pain, bad feeling, or goals and how to use foods, ointments, extracts and even exercises, or other remedies that are mentioned as such
מאמרים אחרונים
- מבנה (אנטומיה) של מערכת הסינון של הדם בכליות ויצירת השתן, ודרכים חדשות להחלמת מפגעיה
- ירידה בתפקוד הכליות – מה לעשות?
- התכנית לשיקום הכליות – כאן.
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- תפקוד הכליה בשעות הלילה: השפעת המקצב הצירקדי על הפילטר הביולוגי
- טעם מר מעודד הפרשת רעלים מהכליות – רשימת צמחים בעלי טעם מר מאת ירון מרגולין
- הלשון של הכליות
- כיצד הכליה מטפלת בחלבונים
- אינסולין ותפקיד הכליות במטבוליזם ופינוי
- עוצמתם של נבטי הברוקולי כתרופה לחולי כליה
- תפקוד הכליה כבלוטה הורמונלית: סקירה מדעית
- מיאמוטו מוסאשי: הסמוראי שחרב אחת בידו, ופילוסופיה פורצת דרך בליבו – גדול הסמוראים
- 🧠 אילוף הכליות הסוררות – בשורת הריפוי של ירון מרגולין
- הציות כפתולוגיה: התבוננות מחודשת בהגדרת הבריאות הנפשית
- אטריות שיראטקי – מתכונים
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- שיראטאקי אטריות קונג`אק – מתכונים
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה
- מחקר חדש דילול השכבה הדמית [כורואיד (Choroidal)] ורשתית העין במחלת כליות כרונית קשור באופן ישיר לירידה ב-eGFR וניתנים לשינוי עם הטיפול התזונתי.
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- אמנות ההחלמה האבודה
- הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה.
- Lecithin לציטין – מזון כתרופה ומולקולה שומנית, שמגינה על המוח, הכבד, הלב, ועל דופן המעי
- תפליט פריקרדילי הצטברות של מים סביב הלב
- שבטבט וסודות התימינאז
- תנגודת לאינסולין (insulin resistance) מאת ירון מרגולין
- שעועית הקטיפה הקסומה – המקונה פרריינס או קִטְנִיּוֹת ההצלה והתשוקה – מזון החלמה שיכול להציל חולי פרקינסון – Mucuna
- מערכת הסינון של הדם בכליות ויצירת השתן
- חומצת שתן נמוכה, או היפואוריצמיה (Hypouricemia)
- התערבויות בניהול רגשות, מחשבות ואורח חיים כדי להתמודד עם מגיפה של מחלות כליתיות
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- דיוקסינים במזון
- פחות מתים – טכניקת דיאליזה חדשה שבולמת את קצב המתים ומגבירה את ההישרדות בכשל כליות.
- נאטו (פולי סויה מותססים יפניים) מתכון
- הקשר של כבד שומני, ומחלת כליות כרונית – מחקר חדש.
- טאורין: חומצה אמינית מסתורית ומסקרנת
- מלטונין הוכח שהורמון השינה נוגד חמצון רב עוצמה ויעיל כתרופה בקרב חולי כליה
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- שיראטאקי אטריות קונג`אק – מתכונים
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש
- מחקר חדש דילול השכבה הדמית [כורואיד (Choroidal)] ורשתית העין במחלת כליות כרונית קשור באופן ישיר לירידה ב-eGFR וניתנים לשינוי עם הטיפול התזונתי.
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- אמנות ההחלמה האבודה
- Lecithin לציטין – מזון כתרופה ומולקולה שומנית, שמגינה על המוח, הכבד, הלב, ועל דופן המעי
- שעועית הקטיפה הקסומה – המקונה פרריינס או קִטְנִיּוֹת ההצלה והתשוקה – מזון החלמה שיכול להציל חולי פרקינסון – Mucuna pruriens
- דלדול עצם – אוסטאופורוזיס (Osteoporosis) מה אפשר לעשות כדי לחזק את העצמות ללא תרופות?
- תפליט פריקרדילי הצטברות של מים סביב הלב
- שבטבט וסודות התימינאז
- תנגודת לאינסולין (insulin resistance) מאת ירון מרגולין
- תסמונת קרדיווסקולרית-כלייתית-מטבולית (CKM).
- התקף לב / אירוע לבבי בעקבות מחלת כליות – מסלול איתות שמגן על הלב בשם "VEGFA" משתבש בגלל מחלת כליות כרונית.
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- חרדה וצ'יפס
- רוצה להחלים מאי ספיקת כליות – יש להגיע לטיפול מחלים כליות מהר ככל האפשר
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- תוסף מזון על האסטקסנטין astaxanthin
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- עצירת ההזדקנות והבלות של הגוף – השיטה של אלכסנדר מיקולין
- 8 חסרים תזונתיים שכיחים
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- סמן ביולוגי אמין (ביו-מרקר)
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- ויטמין D
- מדללי דם טבעיים ויטמין E קאיין, שום, פולי סויה מותססים (נאטוקינאז) וכורכום
- אגוז מרפא ביבהיטקי
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות – פרק א'
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- להתסיס שיבולת שועל – מתכון וכל הסודות
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו "שומר הגנום" גן p53
- דלקת כליות אינטרסטיציאלית – השתמשו במי שעורה.
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו"שומר הגנום" גן p53.
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- סמן ביולוגי אמין (ביו-מרקר)
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- ריפוי פצעים וצמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית לצורך תרומה או טיפול
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
קכקסיה – הרזון הקטלני של חולי כליות בדיאליזה - זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- הפרעה אנדוקרינית
- לאוקון – יצירת מופת
- אן-לואי ז'ירודה דה רוסי-טריוזון
- סימון וואה
- תולדות האמנות החילונית ואמנות הריקוד באיטליה
- ג'ונטו פיזאנו מייסד הרנסנס האיטלקי בציור מאת ירון מרגולין
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- פייר בושאן – האיש שהציל את חגיגת הנישואין של לואי ה-14 מאת ירון מרגולין
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
- ולנטין דה בולון צייר גאון – ירון מרגלין בפתח התערוכה בפריז של ולנטין דה בולון
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון
- מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- חרדה
- מגילת רות האלמנה שיצאה ממרחב הנוחות
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה – סדרת מאמרים.
- למה אני לא מצליח להתמיד – והסוכר
- על ההזנחה –
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- חזרה לבסיס – עקרונות צירופי המזון
- ניתוק רגשי – על הקורוציונה
- די לכאב
- ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
- התודעה השלילית
- ביקורת מבזה
- איך לצאת ממצבי תקיעות בחיים – שיטת שלוש השאלות בגובה העיניים
- נמאס לי מהחיים מה עושים
- על היכולת להשתקם, לקום מאבק הדרך ומכאב הפרידה
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- מדד חדש לבריאותך – ביטול האסרוסקלרוזים
- לראשונה, מדענים הצליחו לתרגם לטקסט את הפעילות המוחית של אדם עם שיתוק שאינו מסוגל לדבר.
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- מחסור בברזל
- קרום התא – הממברנה והדלקת הכרונית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- מהו אימון שלפוחית השתן?
- פסוריאזיס, האם הימנעות מגלוטן מסייעת לחולי הפסוריאזיס
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- על הנקמה – פנטזיות נקמה לאחר חווית אירועים טראומטיים
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 18
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 17
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- גלוטתיון כל האמת
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות – פרק א'
- אכל נקי
- אי ספיקת כליות – טיפול ללא תרופות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- אילוף הכליות הסוררות
- גודש נוזלים בריאות – בקרב חולי כליה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית.
- גודש נוזלים בריאות – בקרב חולי כליה
- דלקת כליות אינטרסטיציאלית – השתמשו במי שעורה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מעגל המוזר – התפתחות ה"אני" בשנה התשיעית לחייו
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- מהו אימון שלפוחית השתן?
- פסוריאזיס, האם הימנעות מגלוטן מסייעת לחולי הפסוריאזיס
- על הנקמה – פנטזיות נקמה לאחר חווית אירועים טראומטיים
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 18
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 17
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות – פרק א'
- אכל נקי
- אי ספיקת כליות – טיפול ללא תרופות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- אילוף הכליות הסוררות
- גודש נוזלים בריאות – בקרב חולי כליה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית.
- גודש נוזלים בריאות – בקרב חולי כליה
- דלקת כליות אינטרסטיציאלית – השתמשו במי שעורה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- לאוקון – יצירת מופת
- אן-לואי ז'ירודה דה רוסי-טריוזון
- תולדות האמנות החילונית ואמנות הריקוד באיטליה
- ג'ונטו פיזאנו מייסד הרנסנס האיטלקי בציור מאת ירון מרגולין
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- פייר בושאן – האיש שהציל את חגיגת הנישואין של לואי ה-14 מאת ירון מרגולין
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
- ולנטין דה בולון צייר גאון – ירון מרגלין בפתח התערוכה בפריז של ולנטין דה בולון

כתיבת תגובה