מיטוכונדריה – מאמר עומק מאת ירון מרגולין מאסטר בהחלמת הכליות והפחתת כאב
למאמרי –
הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- צרבת כרונית – רוצה להחלים ללא תרופות?
- יתר שומנים בדם היפרליפידמיה – חשש לצורך בצנתור
- מהי תסמונת מטבולית (MetS)?
- חדשות הרפואה – חוקרים יצרו דרך לזהות את סרטן הלבלב (PC) וגם את התפתחותו של סרטן הערמונית באמצעות בדיקת שתן, בדיקה שיכולה לסייע בגילוי מוקדם.
- אילוף הכליות הסוררות
- בריאות הנפש ואריכות ימים – מאמר על הטלומרים והשפעת הרגשות עליהם
ספרות עדכנית מציעה ששינויים בדינמיקה של המיטוכונדריה מעורבים בפגיעה בכליות ובהתקדמות של מחלות כליות
[מקור]. הבנת ההשפעה של המיטוכונדריה על התקדמות מחלת הכליות משנה את אסטרטגית הטיפול מקצה לקצה.
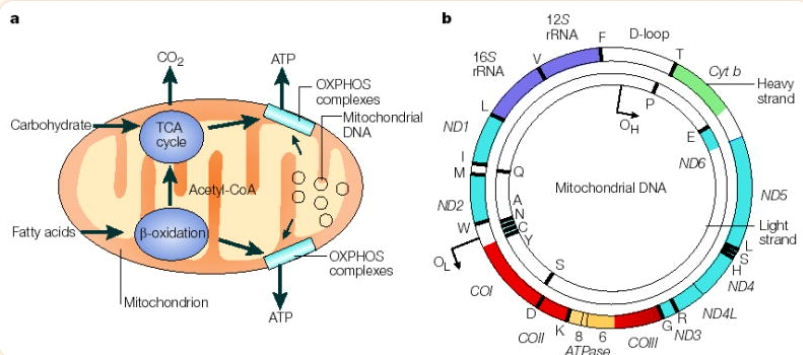
המיטוכונדריה (יחיד – מיטוכונדריון) הינן אברון קטן ומיוחד אשר תפקידן העיקרי והחשוב ביותר – הפקת אנרגיה. מדובר בתהליך ביוכימי מורכב מכונה: הנשימה התאית (Cellular Respiration), כלומר, ייצור של אנרגיה כימית המשתחררת עם פירוקם של פחמימות, חומצות שומן וחומצות אמינו (חלבונים) שמגיעים מהמזון – התהליך מכונה גם מטבוליזם חמצוני. כלומר חילוף חומרים בסיסי (מטבוליזם), כולל את סך פעולות הפירוק והבנייה המתרחשות בגוף. הוצאות האנרגיה בגוף נחלקות לשלושה חלקים: הוצאת אנרגיה במנוחה, RMR, שתפקידה להמשיך בפעולות קיום החיים; הינו כמות האנרגיה הדרושה בשביל גופנו במצב מנוחה, לצורך תחזוק הגוף (זרימת דם, פעילות המוח, תפקוד כליות, משאבת לב וכל שאר המערכות העובדות בגוף כולל ניקוי הדם והפרשת הרעלים בשתן על ידי הכליות). הוצאת אנרגיה הנובעת מפעילות גופנית הנשלטת על ידינו; למשל ריקוד, שחיה דיבור וקריאה. והוצאת אנרגיה בתהליך עיכול המזון. פעילותן של הכליות דורשות אנרגיה רבה והן מועשרות במיטוכונדריה – כאן במיטוכונדריון מתבצעת תעשיית האנרגיה פרוק ובניה של חומרי המזון ומולקולות נושאות אנרגיה – משל היו אלה שקיות בנזין קטנות לשימוש המנוע לניקוי הרעלים שבכליות. במיטוכונדריה הזו, במרכז ייצור האנרגיה מתחילה פעמים רבות גם מחלת הכליות. הסיבה לכך במעבר אלקטרונים ותהליכי חימצון ויתר מחמצנים שמתרבים ומגיעים במקרי מחלה לכמות שגדלה על כשרי המיטוכונדריון למנועה אותה [מקור1, מקור2, מקור3, מקור4].
פגיעה במיטוכונדריה היא שעומדת בבסיס ליקוי, הרס ומות נפרון גם בבסיס הרס שמתרחש בעצבים (נירופתיה).
הכליה דורשת מספר רב של מיטוכונדריה כדי להסיר פסולת מהדם ולווסת את מאזן הנוזלים והאלקטרוליטים [מקור]. תפקוד לקוי של המיטוכונדריון נקשר בהעדר אנרגיה, בירידה בייצור באנרגיה ובמחסור של – ATP, הנושא הזה גורר לשינויים במבנה התא, בתפקידיו ובהמשך לאובדן נפרון וכשל בתפקוד הכליות, בהמשך המצב עלול להוביל לכשל בתפקוד הלב או המוח גם הריאות – תלוי באיזה אבר פועל המיטוכונדריון המתחמצן וכן באיזה עצב הוא פגע. מינֵי חמצן תגובתי – שהם שם כולל לאוקסידנטים – מסמנים: ROS פועלים כאן. מדובר במגוון של מולקולות ורדיקלים חופשיים (מינים כימיים עם אלקטרון אחד לא מזווג) שמקורם בחמצן מולקולרי [מקור]. חמצן מולקולרי הוא –צורתו השכיחה של החמצן בטבע, הצורה בה הוא קיים באטמוספירה או במצב היסוד הוא דו-רדיקל (O2). חמצן מולקולרי מכיל שני אלקטרונים בלתי מזווגים בקליפה החיצונית (מכונה גם מצב שלישייה). מכיוון שלשני האלקטרונים הבודדים יש את אותו ספין, חמצן יכול להגיב רק עם אלקטרון אחד בכל פעם ולכן הוא לא מגיב עם שני האלקטרונים בקשר כימי. מצד שני, אם אחד משני האלקטרונים הבלתי מזווגים משנה את הספין שלו, המין שנוצר (המכונה חמצן יחיד) והופך לחמצן רב עוצמה מכיוון ששני האלקטרונים עם ספינים מנוגדים יכולים להגיב במהירות עם זוגות אלקטרונים אחרים, במיוחד כפול קשרים.
נחזור אל המיטוכונדריה
מיטוכונדריה מייצרות את מרבית האנרגיה שהתאים שלנו צריכים כדי לתפקד כראוי. הן
מפעל אנרגיה ביולוגית (bioenergetics factories) שפועלת בגוף ונמצא בכמויות גדולות באיברים הזקוקים לאנרגיה רבה במיוחד בהם הלב, המוח והכליות
[מקור]. אולם יש לכך מחיר: ייצור אנרגיה מלווה בשחרור של חומרים מזיקים, כמו למשל מינֵי חמצן תגובתי (ROS). ROS – הוא שם כולל למחמצנים חזקים שנוצרים במהלך חילוף החומרים (המורכב) במיטוכונדריה [מקור]).
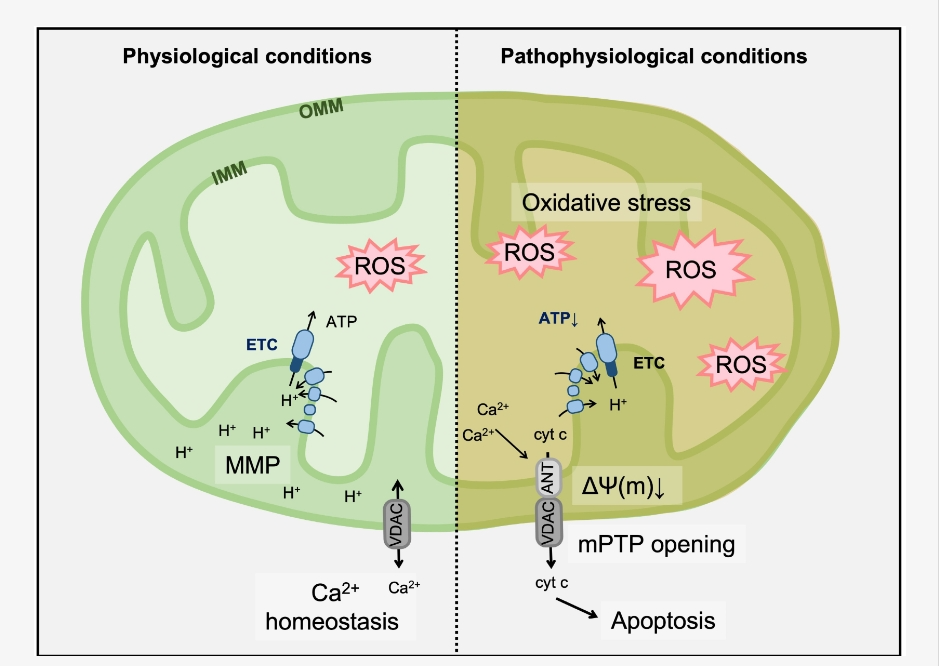
מינֵי חמצן תגובתי ROS אלה יכולים להזיק לרכיבים בתוך המיטוכונדריון, בכלל זה חלבוני תחזוקה מרכזיים שפועלים בתוך האברון, מה שמהווה קרקע פוריה לחולי ובהמשך אפילו להוביל למוות תאי, חיסול נפרון שמביא לשיבוש האבר ויצירת מחלה כרונית כאי ספיקת כליות. מאחרי המחלה עומדות פעמים רבות מיטוכונדריה שניזוקו ויוצרות כמויות גדולות של ROS. אנטי אוקסידנטים – נוגדי חמצון עשויים להגן על הכליות גם במצב זה ואפילו לאחר CKD או AKI, כיוון שנוגדי חמצון יכולים להרוס ROS והגוף יודע לתקן עצמו, אם הוא מקבל אספקה סדירה של חומרי בנייה. המזון כתרופה נכנס למטרה זו.
המיטוכונדריה מוכרות כספק אנרגיה מרכזי אבל חשיבותן מורכבת בהרבה – כך הן למשל אחראיות לצמיחת תאים, בכלל זה לצורך תהליכי החלמה. מיטוכונדריה גם מתאמות את הביוסינתזה של שומנים, של חומצות אמינו וקבוצה של תרכובות אורגניות (נוקלאוטידים) אשר מרכיבות, בין השאר, את החומר התורשתי. בנוסף לאלה המיטוכונדריון משתתף בתהליכים ביו-אנרגטיים כגון מחזורי חומצה טריקרבוקסילית (TCA), מערכות הובלה של אלקטרונים (ETS) וחומצות שומן (FA) β-חמצון [מקור1, מקור2]. במהלכם של תהליכים אלה נוצרים מיני החמצן התגובתיים (ROS). חשוב לציין כי המיטוכונדריה עצמה זקוקה ל-ROS, אמנם לרמות נמוכות של ROS, אבל היא זקוקה לו כדי לווסת איתות סלולרי, להגן על עצמה אבל רק אם הן נשארות נמוכות כאשר רמת מיני החמצן התגובתיים (ROS) עולה במקביל לכך מתחילה הבעיה.
לחץ חמצוני – הוא יסוד ופתח לאי ספיקת כליות. עקה חמצונית (oxidative stress – OS) מוגברת, משמעה יתר ROS ומשמעותה הרחבה יותר – מחלת הכליות שמקורה חימצון במיטוכונדיה [מקור]. חוסר איזון בין ייצור והסרה של מיני חמצן תגובתיים עקב ייצור מוגבר של מיני חמצן תגובתי (ROS) ו/או ירידה בפעילות ההגנה של נוגדי חמצון שמאזנים אותו כגון סופראוקסיד דיסמוטאז, קטלאז או גלוטתיון פרוקסידאז [מקור1, מקור2, מקור3, מקור4] פוגעים במיטוכונדיה. המיטוכונדריה יודעות, עד גבול מסויים לטפל בבעיה זאת. לא כשהתופעה כאמור לעיל מחריפה וגולשת אל מעל לאיזונם של המחמצנים בה. האדם מוצא עצמו מוצף בגורמים מחמצנים, בהמשך נוצרו תחילה כדי לעזור אבל העודף של ROS קם נגדו וגורם ללחץ חמצוני (OS) [מקור]. נושא זה הוא יסוד טיפול באי ספיקת כליות כאשר מקור המחלה מיטוכונדרי ואחת הסיבותלאזלת ידה של רפואת הממסד.
מיני חמצן תגובתי (ROS) מטוכונדריים מקדמים פגיעה כלייתית ומחוללי מחלות של טרשת עורקים ואי ספיקת כליות AKI או מחלת כליות כרונית CKD [מקור1, מקור2]. בנוסף, מערכת הפעלה מוגברת של עקה חימצונית (OS) מעודדת סיבוכים כגון יתר לחץ דם, טרשת עורקים, אובדן גמישות העורקים, דלקת ואנמיה בחולים בשלבים מתקדמים של CKD [מקור]. הנושא האחרון מכשיל גם אברים רחוקים כגון: לב, ריאות, מערכת העיכול ומקדם דיאליזה ומוות.
תפקוד לקוי של המרחב מיטוכונדריאלי יכול לעודד דליפה של אלקטרונים משרשרת הולכת האלקטרונים (ETC), ולהוביל בהמשך לעלייה במתח החמצוני במיטוכונדריה [מקור1, מקור2] על נושא זה בהמשך המאמר.
מוטציות ב-DNA המיטוכונדריאלי (mtDNA) הן גורם חשוב למחלה תורשתית
הגנום המיטוכונדרי (mtDNA) – מידע גנטי מצוי במיטוכונדריה ומשמש כמנהל לתהליכים שהיא מבצעת. המידע הזה הוא רק חלק קטן מתוך כלל הגנום הקיים בתא האנושי והאאוקריוטי בכלל (שיש לו גרעין), כאשר מרביתו מצוי בגרעין [מקור]. כאשר התא מתחלק, המיטוכונדריון שנמצא בתא המתחלק משתכפל באופן עצמאי ונפרד מן הגרעין, בפועל הוא יוצרות אוכלוסייה תוך תאית [מקור1, מקור2]. בנוסף לכך החומר הגנטי שבמיטוכונדריה של הצאצאים מקורו באם של האדם בלבד (האב לא משפיע גנטית על המיטוכונדריה) [מקור1, מקור2], וכך שרצף הדנ"א המיטוכונדרי ידמה רק לזה של האם מלבד מוטציות שיכולות להיווצר ולהצטבר בחלק מאוכלוסיית המיטוכונדריה במהלך החיים. ה-DNA המיטוכונדריאלי (mtDNA) רגיש יותר מזה שנמצא בגרעין התא, למרות שיש לו מנגנון של תיקון, יכולת התיקון בו מוגבלת [מקור1, מקור2]. מחקרים על האוכלוסייה הבריטית מצביעים על כך שהמוטציות בגנום המיטוכונדרי (mtDNA) שכיחות וכ-1 מתוך 3,500 אנשים חולים במחלת mtDNA או נמצאים בסיכון לפתח אותה [מקור1, מקור2, מקור3]. הערכות אלו אינן כוללות את הקשר הנראה לאחרונה בין מוטציות בגנום מיטוכונדריאלי mtDNA ומאפיינים קליניים נפוצים (לדוגמה, יתר לחץ דם, כך שלאם יכול שלא להיות יתר לחץ דם ולצאצאיה כן [מקור]. כאשר מספרן של המוטציות אשר מתרחשות במיטוכונדריון גובר מעל סף מסוים (הטרופלסמיה heteroplasmy) מתחיל זיהוי פתולוגיות של גנום מיטוכונדריאלי ומרגע שמספר העותקים של mtDNA שעבר מוטציה מגיע לסף בו הביטוי של המחלה מתרחש [מקור1, מקור2, מקור3], המחלה פורצת באבר בו נמצאת תופעה זו [מקור1, מקור2]. בכלל זה אטרופיה (מוות של תאים או אובדן) בצינורית פרוקסימלית שבאבר הכליה [מקור1, מקור2]. מחלות כרוניות בקרב ילדים כגון נוירופתיה של עצב הראיה, יתר לחץ דם [מקור], סוכרת [מקור], מחלת אלצהיימר (AD) ומחלת פרקינסון (PD) [מקור] או אי ספיקת כליות עלולות להיווצר מסיבה זו [מקור1, מקור2]. לא די במוטציה למחלה במיטוכונדריה כדי שהמחלה תופיע. דרוש לשם ביטוי של המחלה כלומר דרוש גם חלבון שמקודד על ידי הגרעין בתא. מכל מקום מסיבה זו מזהים מחלה בקרב ילדים ואז מזהים גם ייצור מוגבר של מיני החמצן התגובתיים (ROS). לאן שלא נסתכל, כשמדובר במחלת כליות רואים ייצור יתר של מיני חמצן תגובתי ים (ROS) ככלל נזקים למיטוכונדריה הם הבטחה למחלות מיטוכונדריות שנגרמות בשל מוטציות (מורשות או נרכשות) בדנ"א המיטוכונדרי או בדנ"א הגרעיני המקודד לגנים המשמשים לפעילותן של המיטוכונדריה [מקור1, מקור2].

למאמרי – למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה – כאן
- תעוקת חזה מיקרו-וסקולרית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- ויטמין D
- ירידה בתפקוד הכליות
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- איך להתסיס תירס ולהכין טמאל מכסיקאי מסורתי
- אפיגנטיקה ומזון כתרופה ביולוגית להחלמה ממחלות גנטיות
- התכנית לשיקום הכליות – פרק א'
A decrease in mitochondrial fusion promotes fission-induced mitochondrial fragmentation, but a reduction in mitochondrial fission produces excessive mitochondrial elongation.
נשימה תאית היא התהליך להפקת אנרגיה זמינה, תוך ניצול תרכובות אורגניות, אשר מפורקות במהלך הזה. מקורן של תרכובות אלה במזון, לשימוש ביצורים חיים (מטבוליזם). האנרגיה המשתחררת עם פירוק התרכובות משמשת להרכבת נוקלאוזיד מזורחן ATP, (A הוא אדנוזין, T הוא tri (שלוש) ו-P הוא פוספט, אטום זרחן עם 4 אטומי חמצן) מ-ADP (אדנוזין די פוספט, כלומר אדנוזין עם שני יוני פוספט) ו-Pi (פוספט אנאורגני). כשה-ATP מתפרק האנרגיה הנדרשת לתפקוד התא משתחררת.
בתהליך הנשימה התאית מתרחש מעבר של אלקטרונים בין חומרים שונים (החומר שעובר חמצון מוסר אלקטרונים (מחזר) ל'מחמצן') ומעבר זה משחרר אנרגיה. היא הכרחית לייצור ה ATP (מכונה המנגנון הכימואוסמוטי [מקור]).
הערה: כמות האנרגיה במערכת סגורה קבועה תמיד. אנרגיה לא הולכת לאיבוד בה ולא נוצרת יש מאין נושא מוכר תחת הכותרת: חוק שימור האנרגיה. בתא נדרשת אנרגיה ליצור ה ATP. כל פעולה הדורשת אנרגיה חייבת להיות צמודה לאספקת אנרגיה – מצומדת לפעולה שפולטת אנרגיה. יצירת ATP היא פעולה נדרשת אנרגיה לקיומה. אי לכך מצומד לה תהליך המשחרר אנרגיה. הוא המנגנון הכימואוסמוטי – שרשרת של העברת אלקטרונים (ETC) באמצעות תגובות חמצון-חיזור. [מקור]).
הערה: החיזור היא תגובה של קבלת אלקטרונים (חיזור = נתינה) ממולקולה אחת בעלת אלקטרושליליות נמוכה למולקולה אחרת בעלת אלקטרושליליות גבוהה (אלקטרושליליות זו היכולת של חומר למשוך אליו אלקטרונים בקשר קוולנטי). חמצון = מסירת אלקטרונים. לתגובה בה חומר מקבל אלקטרונים קוראים חיזור ולתגובה בה חומר מסר אלקטרונים קוראים חמצון. כידוע מי שמחזר = נותן (פרחים, או שוקלוד), ומי שמחוזר (חיזור) = מקבל פרחים, שוקולד ולפעמים גם יין (מהמחזר). חמצון – חיזור הינן תגובות כימיות משלימות, ולא יכולות להתקיים האחת ללא השניה.
מעבר זה כספק אנרגיה הכרחי ואחד הגורמים המניעים את תהליך ייצור ה-ATP. לכן, לשם מעבר האלקטרונים כל תא חי זקוק לתרכובות התורמות (מוסרות, מחזרות) אלקטרונים ולתרכובות המקבלות אלקטרונים. באדם המזון מספק את התרכובות אשר מוסרות את האלקטרונים (ובראשן – גלוקוז. גלוקוז מתפרק בתאים ומוסר אלקטרונים תוך כדי כך. זוהי תגובת שמכונה: חמצון-חיזור), ואילו החמצן אותו אנו נושמים הוא התרכובת שקולטת את האלקטרונים. זרימת האלקטרונים בתאים שבגופנו מאפשרת את בנית התרכובת – ATP, אשר מכילה קשרים עתירי אנרגיה. כשהתא נזקק לאנרגיה לשם ביצוע תהליכים שונים, מתפרק ה-ATP באמצעות האנזים המתאים לכך. שבירת הקשרים הכימיים של המולקולה הזו מביאה לשחרור אנרגיה. תפקוד לקוי של המרחב מיטוכונדריאלי יכול לעודד דליפה של אלקטרונים משרשרת הולכת האלקטרונים (ETC), ולהוביל בהמשך לעלייה במתח החמצוני במיטוכונדריה [מקור1, מקור2]. ההובלה האלקטרונית, (שאיבת הפרוטונים) וקבלת ה- ATP מתרחשים במיטוכונדריה, הודות לכוח המניע הפרוטוני. שיפוע ה- pH שומר על תנאי החומצה בין הממברנה והמטריצה המיטוכונדריאלית עם תנאי אלקליין (בסיס). האנרגיה המשתחררת בתהליך זה מיוצרת בהדרגה על ידי מעבר של אלקטרונים דרך שרשרת מסוע. כאן מתבצע החימצון. כאן נוצר ה ROS.
הערה: יון מחזר (נותן, מעניק מעצמו) ליון מחמצן (מקבל מה"מחזרים אחריו" – לפעולה של חומר שמוסר אלקטרונים קוראים חמצון. החמצן הוא מקבל האלקטרוני ם הנפוץ.) [מקור]. באיור למטה (מתחם 1, או קומפלקס 1) מתואר אחד המעברים האלה.
הנשימה התאית מורכבת משלושה שלבים:
גליקוליזה שאינו דורש חמצן ומהווה הקדמה לנשימה תאית. הגליקוליזה מתרחשת בציטופלזמה. במהלך הפירוק משתחררת אנרגיה כימית הבונה 2 מולקולות ATP. במקביל NAD (ראשי תיבות של Nicotinamide adenine dinucleotide, ניקוטינאמיד אדנין דינוקלאוטיד) הוא קואנזים המצוי בכל התאים החיים ושותף לתהליכי חיים רבים שלא היו מתקיימים בלעדיו. NAD הופך במקביל לקואנזים NADH [מקור]. NAD הוא אחד משני נשאי אלקטרונים אוניברסליים, המשתתפים בתגובות רבות שמתרחשות בתאים שלנו, השני הוא FAD. שני חומרים אלו הם נוקלאוטידים; הראשון הוא נגזרת של ויטמין B3 (ניאצין) והשני (FAD) – של ויטמין B2 (ריבופלאווין). זו הסיבה לכך שמחסור בוויטמינים: B3 (ניאצין) או B2 (ריבופלאווין) גורם למחלות מטבוליות חמורות. לשני הנוקלאוטידים נטייה לקלוט יון הידריד (–H); זהו יון שלילי של מימן אשר מורכב מפרוטון ומשני אלקטרונים. כשגלוקוז, למשל, מתפרק בתהליך הגליקוליזה, משתחררים ממנו יוני הידריד, אותם קולט NAD שהוזכר למעלה (והופך על ידי כך למחוזר ומרגע שקיבל המחוזר את מתת האלקטרונים הוא "יש" חדש ושמו –NADH); הנשא כמחזר מעביר את האלקטרונים לחמצן בשלב הזרחון החמצוני, (לפעולת מסירת האלקטרונים קוראים חמצון.) השלב האחרון של הנשימה התאית, והופך שוב ל-NAD, אשר מסוגל להשתתף שוב בגליקוליזה [מקור]. כך התא שומר ובכל תא נשמר מאגר קבוע למדי של נשאי אלקטרונים, אשר מתחמצנים ומתחזרים לסירוגין. כלומר מעבירים מתנות אלקטרונים זה לזה ומשנים בכך את מהותם. יש וה NADH לא מסוגל לתרום את האלקטרונים שלו מסיבה כלשהי, במצב מוזר זה גם משתנה מהות שכינינו NAD, שנקשרת בו. במצב זה כאמור לעיל, מידלדל מאגר ה-NAD בתא ותהליך הגליקוליזה אינו מתאפשר. התסיסה שגם היא היא תהליך כימי המשמש להפקת אנרגיה מתחילה. זו גם הסיבה לכך שתסיסה מוגדרת לעיתים כסוג של נשימה אל-אווירנית. ומהווה פתרון לתאים המתקיימים בסביבה ללא חמצן. במקום למסור את האלקטרונים (חיזור) לקולט אלקטרונים חיצוני (חמצן, למשל) נמסרים האלקטרונים (מחמצן) לפירובט (Pyruvate), תוצר הגליקוליזה. פירובט הוא שמה הכימי של חומצה פירובית, מוכרת לרבים בשם חומצת קטו ארוכות שרשרת. השומנים (וליתר דיוק: הטריגליצרידים) שנצרכים דרך המזון מתפרקים בגוף לגליצרול ולשלוש חומצות שומן; הגליצרול, כוהל תלת-פחמני, מומר בסדרת תגובות לפירובט, אשר נכנס ישירות למעגל קרבס – המסלול המוכר ביותר כמי שמשמש להפקת אנרגיה, להלן,. פירובט הוא התוצר הסופי של הגליקוליזה. מולקולת גלוקוז אחת, בעלת שישה פחמנים, שמתפרקת לשתי מולקולות פירובט, ומשחררת אגב כך אנרגיה. גם באנרגיה זו התא יכול להשתמש לשם ביצוע פעולותיו השוטפות. מכל מקום הפירובט מומר לתוצר סופי כלשהו (אפשרויות רבות: אתנול, חומצה אצטית, גם לחומצה לקטית) ואילו NADH ממשיך להשתנות הוא ממוחזר ל-NAD, אשר משתתף ב"יישותו" זו שוב בגליקוליזה.
מעגל קרבס או שלב / מחזור חומצת לימון (Krebs – The citric acid cycle): במעגל קרבס מוצמד הזרחון החמצוני, אשר מתרחש בתוך המרחב הפנימי של המיטוכונדריה. לזרחון חמצוני יש שני חלקים: שרשרת העברת האלקטרונים (ETC) וכימיוזמוזה. ה-ETC הוא אוסף של חלבונים הקשורים לממברנת המיטוכונדריה הפנימית ולמולקולות אורגניות, שהאלקטרונים עוברים דרכם בסדרה של תגובות חיזור, ומשחררים אנרגיה. האנרגיה המשתחררת יוצרת שיפוע פרוטון, המשמש בכמיוזמוזה לייצור כמות גדולה של ATP על ידי החלבון ATP-סינתאז [מקור]. שרשרת העברת אלקטרונים הם חלבונים גדולים המכילים בדרך כלל אטומי מתכת, אשר קבועים בתוך ממברנת המיטוכונדריון, בו מתרחש הזרחון החמצוני. (ביצורים פרוקריוטיים נשאי האלקטרונים נמצאים בממברנת התא). לכל נשא אלקטרונים נטייה שונה לקבל ולתרום אלקטרונים. באדם כבכל היצורים האארוביים, האלקטרונים עוברים דרך השרשרת עד להגיעם לקולט האלקטרונים הסופי – חמצן. החמצן קולט אלקטרונים ופרוטונים והופך למים מטבוליים [מקור].
זרחון חמצוני: זרחון חמצוני קיים רק בנוכחות קולט האלקטרונים הסופי : החמצן, הוא שיוצר ATP, במיטוכונדריון. זירחון החמצן מתרחש על-גבי הממברנה הפנימית של המיטוכונדריון, תוך שימוש במנגנון כימופיזיקלי הקרוי כימיואוסמוזה [מקור], זרימת הפרוטונים על פני הממברנה הפנימית [מקור]. נושא שנקשר בקרום/ממברנה המיטוכונדריאלי הפנימי ובתעלות קטיון שפועלות שם [מקור]) והענקת אנרגיה לתהליך ייצור ה-ATP. השרשרת מורכבת מחמישה חלבונים (ארבעה ציטוכרומים) שמחמצנים את NADH [מקור].
זרחון חמצוני מתרחש לאחר שהמזון עבר גליקוליזה וסיים לעבור במעגל קרבס. במהלך מעגל קרבס, חוזרו מולקולות רבות אשר בשלב זה הן משמשות להנעת הזרחון החמצוני. בהשוואה לשני השלבים הקודמים, בהם מתקבלות מולקולות ATP בודדות, מיוצרות בתהליך הזרחון החמצוני מולקולות ATP על כל מולקולת גלוקוז שנצרכת בתהליך הגלקוליזה[1], ישנם פרוטונים שמצליחים לחמוק דרך הממברנה ללא ניצול האנרגיה שלהם במהלך זה [2].
הערה: מודל כימיוסמוטי – ד"ר פיטר מיטשל הציג הצעה רדיקלית ב-1961 כדי להסביר את המנגנון שבאמצעותו המיטוכונדריה מייצרות ATP. היא ידועה בשם ההשערה הכימיוסמטית והוכחה לאורך השנים כנכונה. מיטשל הציע שסינתזה של ATP במיטוכונדריה תלויה בשיפוע אלקטרוכימי, על פני הממברנה הפנימית של המיטוכונדריה, הנובעת בסופו של דבר מהאנרגיה של נשאי אלקטרונים מופחתים, NADH ו-FADH2 שהוזכרו בשלב הראשון הגליקוליזה של הנשימה התאית [מקור]. הובלת אלקטרונים לסינתזה של ATP (נקרא זרחון חמצוני)
מתחם I
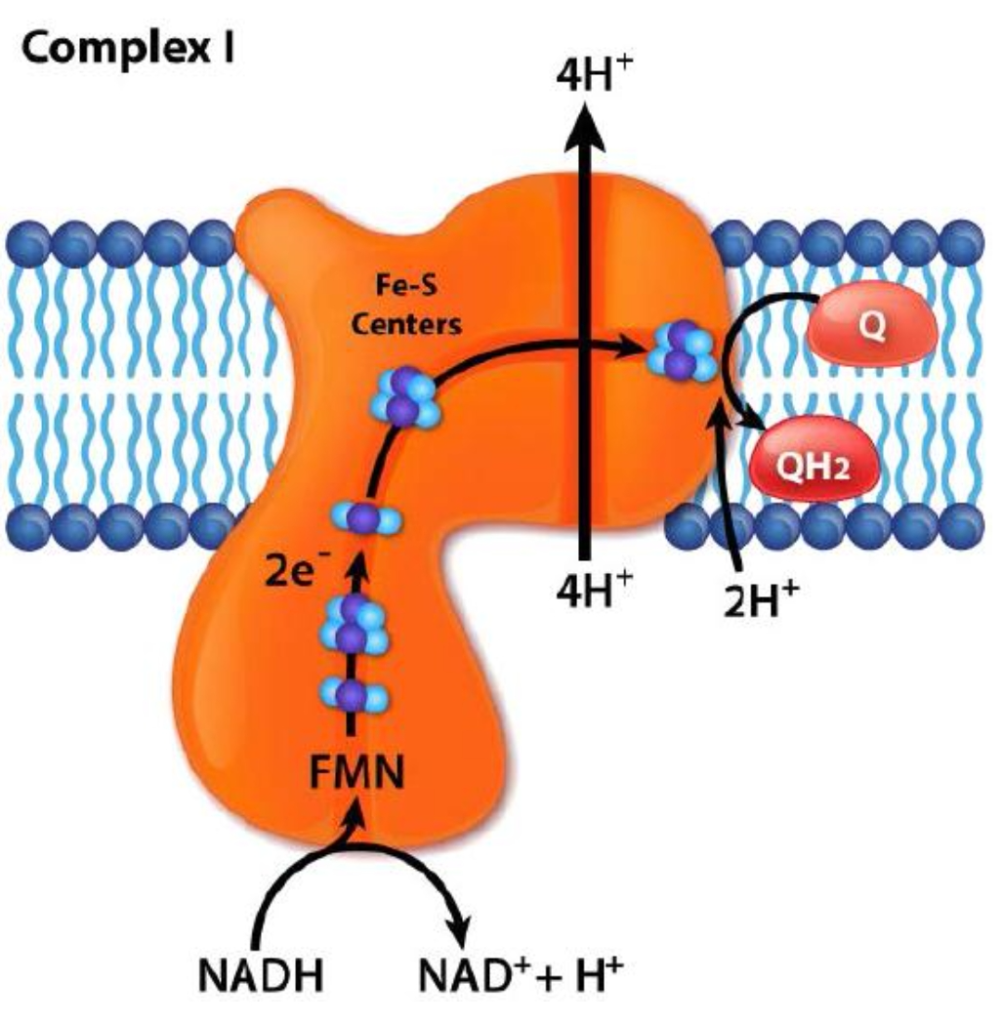
ציטוכרום C קשור באופן רופף לממברנה הפנימית של המיטוכונדריון, שם הוא ממלא תפקיד קריטי בנשימה התאית [מקור]. הוא חלבון ששייך לקבוצה בשם "ציטוכרום " לה תפקידים חשובים במטבוליזם בתאים שלנו ובתאיהם של בעלי חיים באופן כללי. תמצית יכולתו של הציטוכרום לשמש כנשא אלקטרונים וכחומר מחזר או מחמצן. (בחלל הבין-ממברני). ציטוכרום C מכיל קבוצת heme. קבוצות ההם מתחלפות בין מצבי ברזל (Fe2+) ומצבי ברזל (Fe3+) במהלך העברת האלקטרונים. בקומפלקס III, בו ציטוכרום C מככב כנזכל לעיל,. ציטוכרום C מעביר אלקטרונים בין קומפלקסים III (קואנזים Q – Cyt c reductase) ו-IV (Cyt c oxidase) [מקור]. ציטוכרום c רדוקטאז, מורכב מציטכרום b, יחידות משנה Rieske (המכילות שני אשכולות Fe-S), וחלבוני ציטוכרום c. ציטוכרום הוא חלבון המעורב בהעברת אלקטרונים המכיל קבוצת heme. קבוצות ההם – חלבון הם מורכב ממבנה טבעתי שבמרכזו אטום ברזל [מקור], מתחלפות בין מצבי ברזל (Fe2+) ומצבי ברזל (Fe3+) במהלך העברת האלקטרונים [מקור]. מכיוון שציטוכרום c יכול לקבל רק אלקטרון בודד בכל פעם, תהליך זה מתרחש בשני שלבים (מחזור ה-Q), בניגוד למסלולים חד-שלביים מורכבים I ו-II. קומפלקס III גם משחרר 4 פרוטונים לחלל הבין-ממברני תהליך שמתרחש בסוף מחזור Q מלא, מה שתורם לשיפוע. ציטוכרום c לאחר מכן מעביר את האלקטרונים בזה אחר זה לקומפלקס IV [מקור1, מקור2, מקור3].
הערות: 1. מחזור Q: מכיל שני שלבים. בשלב 1 של מחזור ה-Q מתרחשת הקשירה של ubiquinol (CoQH2) ו-ubiquinone (CoQ) לשני אתרים נפרדים על קומפלקס III. כאשר CoQH2 מעביר כל אלקטרון לנתיב שונה. אלקטרון אחד עובר ל-Fe-S ולאחר מכן לציטוכרום c, בעוד שהאלקטרון השני מועבר לציטוכרום b ולאחר מכן ל-CoQ הקשור באתר השני. בזמן שמהלך זה מתרחש, 2 יוני H+ משתחררים לחלל הבין-ממברני, ותורמים לשיפוע הפרוטונים. CoQH2 מחומצן בזמן הזה והופך ליישות חדשה לאוביקווינון – ubiquinone הידוע כקו אנזים Q10 [מקור1, מקור2] במצב זה הוא מתנתק מהקומפלקס. ה-CoQ הקשור לאתר השני נכנס למצב CoQH- רדיקלי מעבר ומקבלת אחד האלקטרונים. השלב השני של המחזור כולל חזרה על חלקו הראשון: CoQH2 חדש נקשר לאתר הראשון ומעביר שני אלקטרונים כמו קודם (ועוד 2 יוני H+ משוחררים). שוב, אלקטרון אחד עובר לציטוכרום c ואחד לציטוכרום b, אלא שהפעם הוא פועל להפחתת CoQH– ל-CoQH2 לפני שהוא מתנתק מקומפלקס III ניתן למחזר אותו. בדרך זו, אפשר לראות שהושלם מחזור שלם אחד [מקור].
2. שוטר תנועה – גםב קומפלקס I ובקומפלקס -II נשאים מעבירים אלקטרונים לקואנזים Q של הממברנה הפנימית (CoQ – בכל אחד מהמקרים, האלו הוא שמקבל אלקטרונים (בזוגות) ומעביר אותם (מחזר) לקומפלקס III (CoQH2-cytochrome c reductase) בנפרד. כך שקו-אנזים Q פועל למעשה כשוטר תנועה, המווסת את זרימת האלקטרונים דרך ה-ETS [מקור].
3. קואנזים Q, הידוע גם בשם יוביקינון נמצא בשלושה מצבי חיזור של CoQ: מחומצן מלא (אוביקינון – ubiquinone), סמיקווינון (אוביסמיקווינון – ubisemiquinone) הוא רדיקל חופשי ומופחת לחלוטין (אוביקינול – ubiquinol). האחרון מתייחס לרוב לאוביקווינול-10, מוכר כקואנזים Q10 – הוא בעל זנב של 10 יחידות והוא שנמצא לרוב בבני אדם. יכולתה של מולקולה זו לפעול כנושא דו-אלקטרונים (הנע בין צורת הקינון והקינול) ונשא אלקטרון אחד (הנע בין הסמיקינון לאחת מהצורות האחרות הללו) היא מרכזית בתפקידה בשרשרת העברת האלקטרונים [מקור].
4. תחנת עגינה – קומפלקס III הוא למעשה תחנת עגינה או מחלף עבור נושא האלקטרונים הנכנס לתמונה (קו-אנזים Q) והנשא היוצא (ציטוכרום c). תנועת האלקטרונים מקו-אנזים Q למתחם III ולאחר מכן לציטוכרום C מתרחשת כתוצאה ממה שמכונה מחזור Q (שמוזכר בהערה 1, למעלה).
5. שאיבת פרוטונים – כאשר אלקטרונים עוברים דרך קומפלקסים I, III ו-IV, מתבצע שחרור של אנרגיה – השחרור הזה בכמות קטנה מאוד של אנרגיה בכל שלב, זו משמשת לשאיבת פרוטונים מהמטריצה המיטוכונדריאלית (שנמצאת בתוך המיטוכונדריה) וכן כדי להפקיד אותם בחלל הבין-ממברני (נמצא בין הממברנות הפנימיות והחיצוניות של המיטוכונדריון). ההשפעה של חלוקה זו מחדש – היא הגדלת הפוטנציאל החשמלי והכימי על פני הממברנה.
קומפלקס IV, הידוע גם בשם ציטוכרום c אוקסידאז (cytochrome c oxidase), מחמצן את ציטוכרום c ומעביר את האלקטרונים לחמצן, נושא האלקטרונים הסופי בנשימה התאית האירובית. חלבוני הציטוכרום a ו-a3, בנוסף לקבוצות heme ונחושת בקומפלקס IV מעבירים את האלקטרונים שמחזרים את הדיאוקסגן (bound dioxygen) הקשור, וממירים אותו למולקולות מים. האנרגיה החופשית מהעברת האלקטרונים גורמת ל-4 פרוטונים לנוע ולעבור אל החלל הבין-ממברני מהלך שתורם לשיפוע הפרוטונים [מקור1, מקור2].
אפשר לחשוב על מה שקורה כתהליך במתחם IV בו נשאים "לוקחים" אלקטרונים ממתחמים בעלי פוטנציאל הפחתה נמוך יותר, בדומה לדרך שבה בריון לוקח כסף לארוחת צהריים מילד קטן יותר. בתכנית זו, ה"בריון" הגדול ביותר הוא חמצן שפועל במתחם IV. אלקטרונים שנרכשים על ידי נשא גורמים להפחתה, בעוד שהנשא המוותר על האלקטרונים מתחמצן [מקור].
סינתאז ATP (mt) מכונה גם קומפלקס V, ATP synthase משתמש בשיפוע הפרוטונים שנוצר ב-ETC על פני הממברנה המיטוכונדריאלית הפנימית, כדי ליצור ATP [מקור1, מקור2]. הוא שמסנתז ATP מ-ADP במטריצת המיטוכונדריה תוך שימוש באנרגיה שמספקת הגרדיאנט האלקטרוכימי של הפרוטון במהלך שהוזכר לעיל [מקור1, מקור2, מקור3]. עד כה נמצאו מוטציות רבות שמשפיעות על מהלך זה [מקור1, מקור2, מקור3] כאשר רוב המוטציות האלו מובילות לפנוטיפים חמורים של מחלות מיטוכונדריאליות, החל מ-NARP (נוירופתיה, אטקסיה ורטיניטיס פיגמנטוזה) או MILS (תסמונת Leigh בירושה אימהית) עבור מוטציות תת-יחידה א' ועד למיופתיה המיטוכונדריאלית המיטוכונדריאלית (קרדיו) מיופתיה ודיסמור. מוטציה בגן ATP12 או TMEM70 [מקור1, מקור2].
הערה נמצאו שני חלבונים הקשורים לסינתאז ATP – שני חלבוני ממברנה הקשורים ל-ATP synthase זוהו לפני מספר שנים [מקור]. שני החלבונים זוהו קודם לכן בהקשר אחר. הראשון הוא פרוטאוליפיד מיטוכונדריאלי של 6.8 kDa (חלבון – 6.8-kDa mitochondrial proteolipid MLQ), השני הוא חלבון הקשור למחלת הסוכרת ופועל ברקמה רגישה לאינסולין (DAPIT) (חלבון AGP). לאחרונה הוכח כי ל-DAPIT תפקיד בשמירה על כמות סינתאז ATP במיטוכונדריה ולכן עשוי להשפיע על חילוף החומרים של האנרגיה התאית [מקור]. עדיין יש להבהיר את התפקיד התפקודי של הפרוטאוליפיד של 6.8 kDa כחלבון הקשור ל-ATP synthase [מקור].
אניון סופראוקסיד (O2−•)
כאשר O2 מקבל אלקטרון, נוצר סופראוקסיד (O2−•) [מקור].
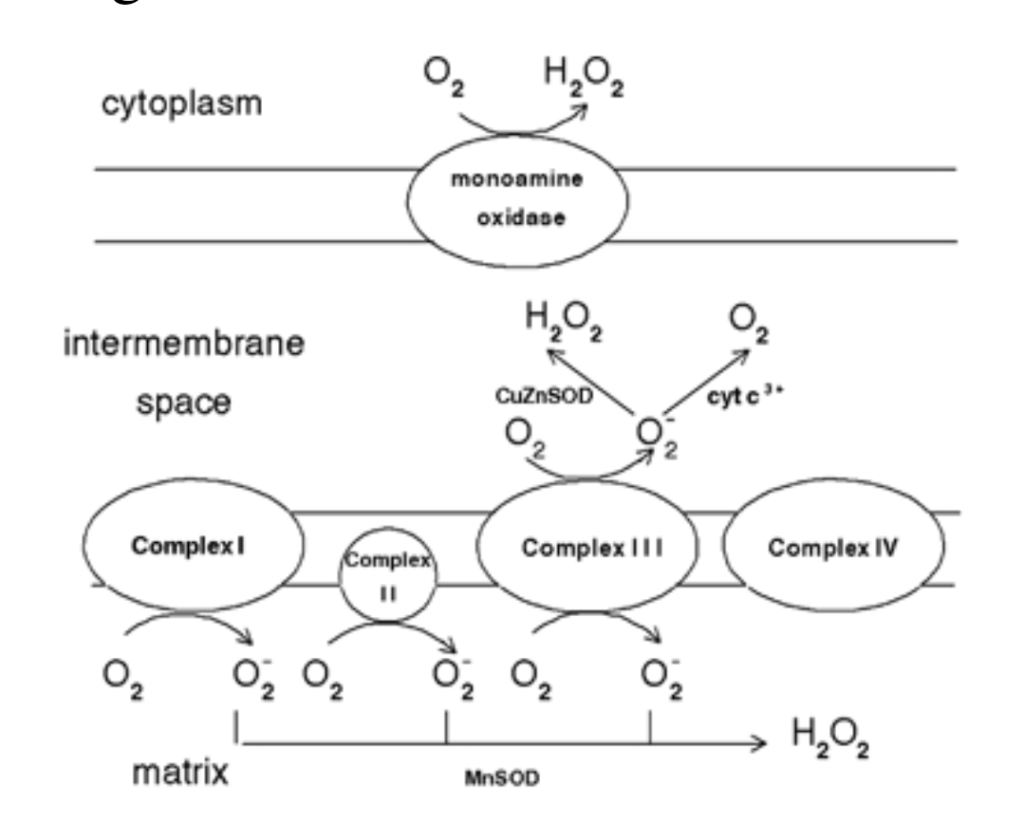
ריכוזים מוגברים של O2−• עלולים להפחית את מתכות המעבר (אשר בתורן מגיבות עם H2O2 היוצרות רדיקלים הידרוקסיל (OH•)) או עשויות להגיב עם תחמוצת חנקן ליצירת פרוקסיניטריט. שני תוצרים אלה גם OH• וגם peroxynitrit הם חומרים מחמצנים חזקים אשר מגיבים ללא הבחנה עם חומצות גרעין שומנים וחלבונים [מקור].
אניון סופראוקסיד (O2−•) נוצר בתהליך של ניצול החמצן להפקת אנרגיה -מכונה נשימה תאית, נוצר מימן על-חמצני כתוצר לוואי. הפחתת החמצן באלקטרון אחד בכל פעם היא שמייצרת את האניון סופראוקסיד (O2−•) מכונה על-חמצן [מקור]. הוא אניון ורדיקל חופשי. תוצר ביניים של נשימה תאית שנחשב יציב יחסית: תוצר של הפחתת אלקטרון אחד זו של חמצן. התוצר הזה סופראוקסיד מבשר של רוב ה-ROS ומתווך בתגובות שרשרת חמצוניות. עקב הנטייה החזקה שלו להגיב הוא עלול לגרום נזק למרכיבי התא ואף למוטציות ב-DNA, כלומר לחומר התורשתי הוא מאגר הנחיות לפעולת המיטוכונדריה במקרה שלפנינו. שינוי של O2−• [אם באופן ספונטני או באמצעות תגובה מזורזת על ידי סופראוקסיד דיסמוטאזות (SOD). שהוא אנזים ממיר שיכול לשנות את הסופראוקסיד הרעיל למימן על-חמצני (H2O2) הידוע בכינוי "מי חמצן" H2O2 במיטוכונדריה שרעיל פחות. תהליך זה בא על מנת להגן על המיטוכונדריון כי התוצר החדש (מימן על חמצני – H2O2 או "מי-חמצן") מזיק כנזכר לעיל, פחות מסופראוקסיד ובנוסף לזאת H2O2 גם עובר פירוק נוסף על ידי האנזים קטלאז)] יחד עם זאת גם מי חמצן (H2O2) הוא רעיל לתאים. הרעילות של ה- H2O2 נובעת מחמצון של חלבונים, שומני ממברנה ו-DNA על ידי יוני החמצן שבו [מקור]. לכן גם הוא, בתורו עשוי להיות מופחת במלואו למים או מופחת חלקית לרדיקל הידרוקסיל (OH•) כדי להגן על המיטוכונדריון, רדיקל הידרוקסיל (OH•) הוא אחד מהמחמצנים החזקים ביותר בטֶבַע. היווצרות OH• מזורזת על ידי מתכות מעבר מופחתות, אשר בתורן עשויות להיות מופחתות מחדש על ידי O2−•, מה שמנכיח ומפיץ תהליך זה [מקור]. בנוסף, האניון סופראוקסיד (O2−•) שהוזכר לעיל, עשוי להגיב עם רדיקלים נוספים כולל תחמוצת חנקן (NO•) בתגובה הנשלטת על ידי קצב הדיפוזיה.
אספירין (חומצה סליצילית) Aspirin (Salicylic Acid)
האספירין הוא האב טיפוס של משפחת נוגדי דלקת שאינם סטרואידים. הוא גם חומר ניתוק (An uncoupling agent) מפרק את שרשרת הובלת האלקטרונים מזרחון על ידי ATP-synthase, ומונע היווצרות ATP [מקור]. מצב כזה מאפשר לפרוטונים לזרום בצורה חופשית. נוצרת דליפת פרוטון דליפה זו מחלישה את הגרדיאנט האלקטרוכימי, תוך העברת פרוטונים ללא שימוש ב-ATP-synthase כך שלא נוצר ATP. מחסור ב ATP הוא תא מורעב ש"מתחנן" לאנרגיה של -ATP, ה-ETC מתחיל לפעול לתיקון המצב ונכנס ליתר עבודה בניסיון נואש להשלים את החסר ולהעביר עוד ועוד אלקטרונים ל-ATP-synthase אבל כל המאמץ הזה מתרחש ללא הצלחה. ה-ETC מייצר באופן קבוע חום כאשר האלקטרונים עוברים מנשא אחד למשנהו, ופעילות יתר זו רק מחמירה את המצב משום שטמפרטורת הגוף מתחילה לעלות כתוצאה מכך. בנוסף, תאים מתחילים להסתגל לניצול תסיסה שהוזכרה לעיל כמי שיוצרת אנרגיה בתנאים אנאירוביים; מצב כזה עלול לגרום לחמצת לקטית מסוג B והרי לנו עוד אנשים חולים שנפגעו [מקור]. מסתבר שאספירין (חומצה סליצילית) היא חומר מנתק [מקור]. מה שיש לעשות במקרה זה וגם נעשה בקליניקה שלי הוא טיפול בפחם פעיל יש ליטול כשעה מהארוחה, במקרים של איזון בGFR אפשר לתת נתרן ביקרבונט [מקור]. בהערת אגב נמצא שרוב ה-NSAIDs – תרופות נוגדות דלקת לא סטרואידיות (NSAIDs) כמו מקלופנמט נתרן (MS), המשמשים להפחתת כאב מגבירים את הסיכון לאי ספיקת לב למשל, עד פי חמישה מעל לנורמה [מקור1, מקור2] וזאת מסיבה דומה לנזקי האספירין. נמצא כי קלופנמט נתרן (MS) ו-NAP מעכבים גם הם הפרוטאזום אך בהיקפים שונים. יש לזכור כי ההפרוטאזום מגן ומפרק חלבונים שאינם דרושים או פגומים בתא. כך למשל פירוק חלבון מסוג זה חשוב עבור פלסטיות סינפטית וחידוש עצמי של נוירונים [מקור]. מספר גדל והולך של מחקרים מצביעים על פגיעה בהפרעה לפירוק חלבון (על ידי ציר יוביקוויטין-פרוטאוזום -UPS) לא רק לניוון שרירים אלא גם לחולשת סיבי השריר הבשל, נושא שחולי כליה רבים סובלים ממנו. יותר ויותר נחשפת חשיבותם של תפקידם של הפרוטאזומים בתהליך השיקום בעוד חוסר תפקוד עלול לעורר ניוון עצבי, שרירי, תאי גזע. חלבונים שלא הצליחו להתפרק, נמצאו בהפרעות נוירודגנרטיביות רבות, כמו במחלת אלצהיימר ומחלת הנטינגטון, גם במחלות של ניוון שרירים, בכולן נמצאו אגרגטים במוח של חלבונים חיוביים לאוביקווטין שלא הצליחו להתפרק [מקור1, מקור2]. לכן כשנמצא כי התרופות האלו מעכבות פרוטאזום כרוני ובהמשך הדבר מובילות להפרעה בתפקוד הלב והמוח כתוצאה מכך לקרדיומיופתיה [מקור] או אלצהיימר ופרקינסון במקרה אחר, עלתה השאלה מדוע ממשיכים לתת תרופות אלה לחולי לב, ולחולי כליה או פגועי מערכת העצבים. עיכוב פרוטאזום על ידי תרופות ואחר נמצא כגורם למחלה [מקור1, מקור2, מקור3, מקור4, מקור5]. זאת בשעה ששיפור פירוק החלבונים האלו אם במוח או בלב ובכליות הוא אסטרטגיה טיפולית [מקור]. הפרוטאזומים הם קומפלקסים מרובי חלבונים אנזימטיים שהם מרכזיים במערכת האוביקוויטין-פרוטאוזום (ubiquitin-proteasome) [מקור1, מקור2, מקור3]. מדובר במערכת יוביקוויטין-פרוטאוזום (UPS) חיונית ביותר אבל אם היא פגומה היא נמצאה כמככבת במחלות אנושיות רבות. פירוק חלבון אאוקריוטי על ידי הפרוטאזום והליזוזום הוא תהליך דינמי ומורכב גם הכרח לטיפול מוביל החלמה שבו לאוביקווטין נמצא תפקיד רגולטורי מרכזי [מקור]. מערכת ה יוביקוויטין-פרוטאוזום (UPS) Ubiquitin-Proteasome (UPS) היא המערכת הפרוטאוליטית הסלולרית המוכרת ביותר, ומי שאחראית על פירוק רוב החלבונים התאיים המקופלים באופן שגוי או שהם הפגומים [מקור1, מקור2, מקור3]. עד כאן על נושא זה הדורש מאמר בפני עצמו.
רעלים מסוימים יכולים לעכב זרחון-חמצוני תאי כגון רוטנון (קוטל חרקים), קרבוקסין, אנטימיצין A, ציאניד, פחמן חד חמצני (CO), אזיד נתרן ואוליגומיצין. רוטנון מעכב קומפלקס I [מקור], קרבוקסין (קוטל פטריות) וכן דוקסורוביצין תרופה נגד סרטן Doxorubicin) [מקור] מעכבים בקומפלקס II (אתר הקישור לקואנזים Q, שם כל אחד בתורו מפריע ל-ubiquinone באתר הקישור.) [מקור1, מקור2, מקור3] אנטימיצין A מעכב קומפלקס III [מקור], אנטימיצין A הוא קוטל דגים הנקשר לציטוכרום c רדוקטאז באתר הקישור ל-Qi. פעילותו מונעת מ-ubiquinone להיקשר ולקבל אלקטרון, ובכך הוא חסום את המיחזור של ubiquinol (CoQH2) ומחבל מחזור Q. גם ציאניד שנמצא בתוסף ויטמין B12 מסוג ציאנוקובלמין. ציאניד נמצא גם באפרסק, דובדבן, ושקדים חומרים, בזרעים של משמש ותפוח, גם בחומרים שמשמשים להברקת מתכות, ובחומרי הדברה, אבל ואפשר לקבל אותו גם בנטילת תרופות כמו ניתרופרוסיד שמשמשת לטיפול ביתר לחץ דם. בעת פעילות תקינה של המיטוכונדריה חמצן מולקולרי אמור להיקשר לאנזים ציטוכרום C אוקסידז (הידוע גם בשם aa3), אשר נמצא על דופן המיטוכונדריה, לקבל אלקטרונים ולהפוך יחד עם יוני מימן למים. האניון הציאנידי (ציאנו –CN) נצמד לברזל שבתוך חלבון זה. הקישור של ציאניד לאנזים זה מונע הובלת אלקטרונים מציטוכרום c לחמצן. כתוצאה מכך, שרשרת העברת האלקטרונים משתבשת, התא מפסיק לייצר ATP באופן אירובי לאנרגיה [מקור] ופחמן חד חמצני Carbon Monoxide (CO. המקור העיקרי לפחמן חד-חמצני בערים ומריכוזי רכב נוסע שפולט משרפה לא מושלמת ממנועי כלי רכב.) אשר מעכבים קומפלקס IV [מקור]. גם אוליגומיצין שמשמש רעל עכברים מסוכן למיטוכונדריה ומעכב סינתאז ATP. [מקור1, מקור2, מקור3, מקור4].
rotenone, carboxin, antimycin A, cyanide, carbon monoxide (CO), sodium azide, and oligomycin. Rotenone inhibits complex I, carboxin inhibits complex II, antimycin A inhibits complex III, and cyanide and CO inhibit complex IV. Oligomycin inhibits ATP synthase.
רוטנון Rotenone (וכמה ברביטורטים) – מעכב קומפלקס I (אתר קישור לקואנזים Q) רוטנון מופיע בזרעים ובגבעולים של מספר צמחים, כגון גפן ה-jicama, ובשורשים של מספר חברים אחרים של הקִטְנִיּוֹת- Fabaceae [מקור]. שמו רוטנון נתן לו ע"י החוקר היפני קזואו נאגאי ( 1902). הרוטנון שייך למשפחת הרוטנואידים. הוא חומר הדברה בשימוש נרחב, שנמכר בשם דריס (Derris eliptica), אך לעתים קרובות יותר משמש לדייג (בארה"ב, בריטניה, שוודיה, הונגריה וספרד) [מקור] הוא נתן לדגים במילים וכאשר הרוטנון מתחיל להפריע לנשימה התאית, בשל פגיעתו במיטוכונדריה הדגים הפגועים עולים אל פני השטח בניסיון לבלוע אוויר, שם הם נמצאים בקלות רבה יותר. הדג נתפס והרוטנון עובר לצלחת הקונה. רוטנון, בצורת אבקה משמש גם לטיפול בגרדת ובכינים בבני אדם. משמש בחקלאות כריסוס נגד חיפושיות תפוחי אדמה, חיפושיות מלפפון, חיפושיות פרעושים, תולעי כרוב, חיפושיות פטל וחיפושיות אספרגוס. מחקר משנת 2017, מזהיר נשים בהריון כי חשיפה של רוטנון עלולה לעכב התפתחות תקינה של המוח שלו. בשנת 2000 דווח כי חשיפה לרוטנון עלולה לקדם פרקינסון [מקור] בשל פגיעתו בנוירונים דופמינרגיים ונוירונים אלו ב-substantia nigra הם שמתים במחלת פרקינסון.[מקור]. חבישת מסיכת גז עם מסנן מ מלצת לחולי פרקינסון ואי ספיקת כליות כשעולה חשש מנוכחות באבק. חדירתו דרך הנשימה מסוכנת במיוחד. רוטנון פוגע במיטוכונדריה. הוא חוסם את קומפלקס I מהעברת אלקטרונים מצבירי Fe-S לאוביקווינון. הוא נספג בצורה גרועה דרך העור, אך לעיתים רחוקות קטלני שכן הרעלה עלולה לגרום להקאות ולהסרה של החומר. עם זאת, בליעה מכוונת עלולה להיות קטלנית. רוטנון יכול לגרום להקאות, חוסר קואורדינציה, רעידות שרירים, עוויתות קלוניות ואי ספיקת נשימה. השפעות קרדיווסקולריות כוללות טכיקרדיה, יתר לחץ דם ופגיעה בכיווץ שריר הלב [מקור1, מקור2].
Antimycin A הוא קוטל דגים הנקשר לציטוכרום c רדוקטאז באתר הקישור ל-Qi. פעילות זו מונעת מ-ubiquinone להיקשר ולקבל אלקטרון, ובכך לחסום את המיחזור של ubiquinol (CoQH2) על ידי מחזור Q. אוליגומיצין הוא אנטיביוטיקה מקרולידית המסונתזת על ידי מיני Streptomyces. היא חוסמת את תעלת הפרוטון של המיטוכונדריון (יחידת FO), הנחוצה לצורך זרחון חמצוני של ADP ל-ATP (ייצור אנרגיה). ומונעת ע"י כך ייצור ATP. השימוש העיקרי באוליגומיצין הוא למטרות מחקר [מקור1, מקור2]

תרופות נוגדות חמצון כשלו בטיפול במיטוכונדריה או ביתר ROS מיטוכונדריאלי
חקירות אינטנסיביות נערכו במקביל לחיפוש אחר תרופות נוגדות חמצון במאבק במצבים פתולוגיים שמייצרים רדיקלים חופשיים ו-ROS בכלל זה ROS מיטוכונדריאלי ורשימת הפרטים שנזכרו לעיל [מקור]. המקורות הפוטנציאליים של הרדיקלים החופשיים שנוצרים במיטוכונדריה, mtROS משכו ומושכים תשומת לב הולכת וגוברת מכיוון שהתגלה לאחרונה כי mtROS תורם ישירות לייצור ציטוקינים דלקתיים ולתגובות חיסוניות מולדות [מקור] שמעודדת מחלות לב וכלי דם (CVD) [מקור] בנוסף לפגיעה בכליות שנזכרת במאמר זה בהרחבה. ללא ספק חסימה של ייצור mtROS עשויה לשמש כטיפול מבטיח לעיכוב ייצור ציטוקינים פרו-דלקתיים ובתורם טרשת עורקים, אלצהיימר ואי ספיקת כליות [מקור1, מקור2]. למרות שהמנגנון של יצירת mtROS אשר מתרחש בעיקר ב-ETC הממוקם על הממברנה המיטוכונדריאלית הפנימית במהלך תהליך הזרחן החמצוני (OXPHOS) מוכר הייאוש אוחז במחקר ובוודאי שבקרב הרופאים – עד כה נמצא רק שהגוף עצמו יכול לטפל במצב אם מאפשרים זאת לו [מקור]. אין תרופות. יש לציין שכל האנזימים נוגדי החמצון המיטוכונדריים שמסייעים לאזן את הרדיקלים חופשיים שמתפתחים במיטוכונדריה מקודדים על ידי הגנום הגרעיני אך לא הגנום המיטוכונדריאלי,כלומר אנזימים אלו מיובאים מהגוף, לא מהגנום המיטוכונדרי (mtDNA) אלא רק לאחר תרגום החלבון שלהם הם עוברים להגן על המיטוכונדריה מפני הרדיקלים החופשיים הROS המיטוכונדריאלי.
שלושת המנקים Scavenging of mtROS: סופראוקסיד דיסמוטאז (SOD, superoxide dismutase) , קטלאז Catalase וגלוטתיון פרוקסידאז (GPx).
הגנות על תאי ורקמות הגוף נגד ROS כוללות את האנזימים סופראוקסיד דיסמוטאז (Mn-SOD, Cu/Zn-SOD, וחוץ-תאי (EC)-SOD), קטלאז, גלוטתיון פרוקסידאז, פרוקסירדוקסינים (peroxiredoxins – PRDX1, PRDX2, PRDX3, PRDX4, PRDX5 ו-PRDX6) ונוגדי חמצון הלא אנזימטיים, גלוטתיון (GSH), תיורדוקסין [thioredoxin ניטריק אוקסיד (NO)], אסקורבט (ויטמין C) , α-tocopherol (ויטמין E) וחומצת שתן (uric acid) [מקור1, מקור2].
הערות:
- פרוקסירדוקסינים אחד החלבונים הנפוצים ביותר באריתרוציטים (כדוריות דם אדומות, הנקראת גם בדיקת דם Red Blood Cells – RBC) לאחר המוגלובין הוא פרוקסירדוקסין 2. תפקידם הוא הפחתת מי חמצן, במיוחד מי חמצן, אלקיל הידרופרוקסידים ופרוקסיניטריט [מקור].
- Thioredoxin יכול להגן על תאים מפני גורם נמק של גידול (TNF) או נוגדן אנטי-פאס, מי חמצן, נויטרופילים פעילים ופגיעות רפרפוזיה איסכמית.
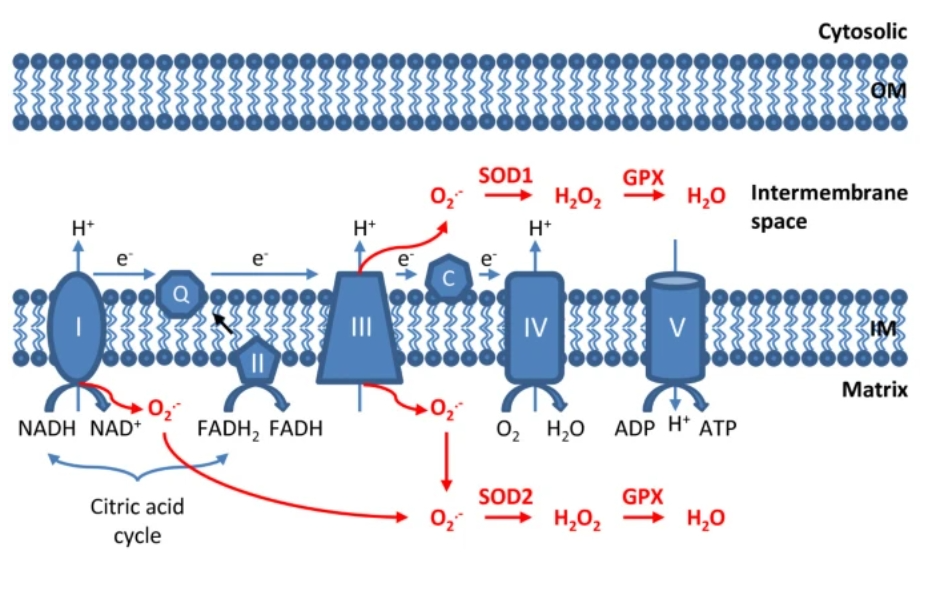
(1). סופראוקסיד דיסמוטאז (SOD, superoxide dismutase) הוא האנזים שהופך את יון הסופראוקסיד למי חמצן (פחות מסוכנים) [מקור]. לאחר מכן, H2O2 מופחת במהירות למים על ידי שני אנזימים נוספים שמצטרפים לתהליך, קטלאז וגלוטתיון פרוקסידאז (GPx) (מסומן באדום באיור למעלה). יש לציין שכל האנזימים נוגדי החמצון המיטוכונדריים מקודדים על ידי הגנום הגרעיני אך לא הגנום המיטוכונדריאלי, ואנזימים אלו מיובאים לאחר מכן למיטוכונדריה לאחר תרגום החלבון שלהם. ניתן לסווג את סופראוקסיד דיסמוטאז SODs לארבע קבוצות שונות שפועלות במיטוכונדריה: Copper-Zinc-SOD. (Cu, Zn-SOD) [איור למטה], ברזל SOD (Fe-SOD), מנגן SOD (Mn-SOD) וניקל SOD [מקור1, מקור2]. הצורות השונות של SODs מפוזרות באופן לא שווה בכל התאים כולל בתת-תאיים שונים. סופראוקסיד דיסמוטאז (SOD) פועל על הכליה ונמנה על הראשונים להגן עליה מלחץ חמצוני הנגרם על ידי ROS שמגיע מהמיטוכונדריה [מקור]. כמו כן הוא בעל ההשפעות טיפוליות מרשימות במחלות דלקתיות, סיסטיק פיברוזיס, איסכמיה, הזדקנות, אלצהיימר [מקור], דלקת מפרקים שגרונית, מחלות ניווניות עצביות, סרטן [מקור] וסוכרת [מקור]. בשנים האחרונות SOD חדר אל תעשיית הקוסמטיקה ונמצא במוצרי טיפוח כמרכיב אנטי אייג'ינג ונוגד חמצון בשל יכולתו להפחית נזקי רדיקלים חופשיים שמשפיעים על העור [מקור].
תהליך נטרול מי החמצן מתרחש בשני שלבים: בשלב ראשון מולקולת מי חמצן הופכת למים ואטום חמצן אחד נקשר לקטלאז. בשלב השני מולקולת מי חמצן נוספת הופכת למים ומולקולת החמצן השנייה חוברת לראשונה ליצור מולקולת חמצן [מקור].
(2). קטלאז (Catalase) הופך מי חמצן למים וחמצן. קטלאז Catalase הוא טטרמר (תצמיד של מולקולות – המורכבת מארבע יחידות פשוטות יותר – מונומרים.) לאנזים זה קבוצת הם (Heme) ובמרכזה אטום ברזל (כמו בהמוגלובין). הוא יכול להמפחית את H2O2 למים. מולקולת קטלאז אחת מסוגלת לפרק מדי שנייה עד ל-200,000 מולקולות מי חמצן. החשיבות של קטלאז Catalase בדיכוי דלקת ונזקים קרדיווסקולריים, טרשת עורקים ואי ספיקת כליות שבה ומוכחת. יש לזכור שמדובר באנטי אוקסידנט שהגוף מייצר ושולח אל המיטוכונדריה כפי שהוזכר למעלה [מקור1, מקור2, מקור3].
(3). גלוטתיון מופחת (GSH) כקו-פקטור – גלוטתיון פרוקסידאז (Peroxide) הופך את מי החמצן למים.
GSH הוא טריפפטיד המכיל שלושה שיירי חומצות אמינו כולל גלוטמט, ציסטאין וגליצין. במהלך תהליך הפחתת H2O2, GSH מתחמצן לגלוטתיון מחומצן (GSSG). לאחר מכן, GSSG ממוחזר בחזרה ל-GSH על ידי האנזים גלוטתיון רדוקטאז (GR) תוך שימוש ב-NADPH כמצע [מקור]. לפיכך, התחזוקה של GSH ליכולת ניקוי מיטבית תלויה בזמינות הביולוגית של מאגרי NADPH. מחסור ב- glutathione peroxidase (GPx) גורם להאצה של טרשת עורקים ולמחלות הנלוות, מה שמדגיש את החשיבות של גלוטתיון פרוקסידאז בדיכוי דלקת כלי דם, טרשת עורקים, אלצהיימר, אי ספיקת כליות והתקף לב [מקור].
בשנת -1973, קבוצת מחקר של של Hoekstra דיווחה שסלניום חיוני לפעילות של גלוטתיון פרוקסידאז בכבד עכברים (Rotruck et al. 1973) וכמה שנים לאחר מכן, נקבע שהסלניום שבגלוטתיון פרוקסידאז הוא בצורת סלנוציסטאין (Forstrom et al. 1978) [מקור]. בנוסף התקדמות הפרעות הכליות נמצאה כמלווה בירידה בפעילות של גלוטתיון פרוקסידאז בדם P-GPx, אך לא בירידה בפעילות של גלוטתיון אריתרוציטים E-GPx [מקור]. גלוטתיון פרוקסידאז (GPx) נמצא כמגן על התאים מפני נזק חמצוני על ידי זרז הפחתת מי חמצן אורגניים ומי חמצן, בתאים צינוריים פרוקסימליים של הכליה שהם המקור העיקרי לפעילות GPx בפלזמה. דווח כי נזק חמצוני משתתף בהתקדמות ובסיבוכים של מחלות כליות ובשנים האחרונות חלה התעוררות בחקר אפשרות להשתמש בו בתהליכי בלימת המחלה והחלמתה בהשפעתו [מקור1, מקור2].
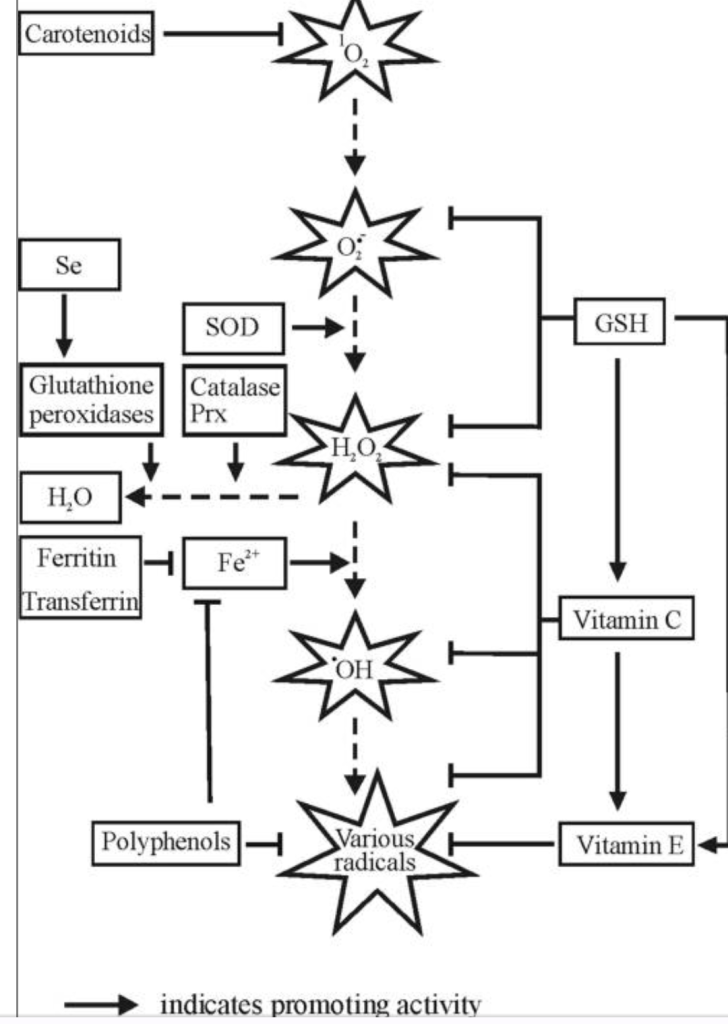
[גלוטתיון מופחת (GSH) הוא פפטיד בעל שלושה שאריות (γ-l-glutamyl-l-cysteinyl glycine) עם קישור פפטיד ייחודי. במצבו המופחת, גלוטתיון מופחת (GSH) יכול לתרום אלקטרון שעליו שתי מולקולות של GSH והן יוצרות את ה-GSSG המחומצן. את הגלוטתיון המחומצן – GSSG. ניתן להפחית את הגלוטתיון המחומצן בחזרה ל-GSH על ידי גלוטתיון רדוקטאז (GR). הנוכחות בכל מקום של GSH בריכוז גבוה (1-10 mM) ומערכת מיחזור אנזימטית יעילה ומעניקה לגלוטתיון מרחב פעולה כנוגד חמצון תאי עיקרי. GSH נמצא כמנקה עיקרי של ROS גם באופן ישיר וגם בצורה עקיפה [מקור1, מקור2, מקור3]. הGSH מגיב בצורה לא אנזימטית עם O2−• וכן על עוד כמה סוגי מחמצנים ROS, אבל בגישה העקיפה הגלוטתיון המופחת (GSH) מתפקד טוב במיוחד ומה שמוגדר כיום לתפקיד החשוב יותר שלו כמסלק ה- ROS [מקור1, מקור2]. מקור האיור בצילום מסך מהמאמר: "Nutritional Countermeasures Targeting Reactive Oxygen Species in Cancer: From Mechanisms to Biomarkers and Clinical Evidence" – מכאן.
למאמרי – אפיגנטיקה – על האופן בו אפשר להשתיק גן שמעורר מחלה, בעזרת סיבי תזונה.
- אפיגנטיקה ומזון כתרופה ביולוגית להחלמה ממחלות גנטיות
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- פיקנוגנול – המתכון הסודי – כאן.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית.
- תכנית לשיקום הכליות – פרק א'
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
להפחית מטבוליטים רעילים
בנוסף לנזכר לעיל בהקשר לויטמין B2 (ריבופלאווין). זו הסיבה לכך שמחסור בוויטמינים: B3 (ניאצין) וכן שלושת המנקים Scavenging of mtROS: סופראוקסיד דיסמוטאז (SOD, superoxide dismutase), קטלאז Catalase וגלוטתיון פרוקסידאז (GPx) מטפלים בחולי כליה שמבקשים החלמה בעזרת מזון עשיר באנטיאוקסידנטים עליו אפשר לקרוא בעשרת מאמרי על המזון הבריא ביותר לחולי כליה סדרת מאמרים שמתחיל כאן.וגם משתמשים, בכל מקרה במינון ובסוג מתאים לו במספר חומרי הזנת על שכדאי לתת עליהם לסיום מאמר זה דגש מיוחד.

קו – אנזים Q10
CoQ10 הוא מרכיב אינטגרלי בשרשרת העברת האלקטרונים המיטוכונדריאלית, המעביר אלקטרונים ממתחמים I ו-II ומספר תורמי אלקטרונים אחרים [מקור]. חשוב לזהות מחסור ראשוני ב-CoQ10, מכיוון שמצב זה מגיב לעתים קרובות לתוספת CoQ10 טיפולית ומשבש את הטיפול עצמו. CoQ10 הוא אחד החומרים שנמצאים בשימש לטיפול בהפרעות מיטוכונדריאליות במצבי אי-ספיקת כליות וטרשת נפוצה גם לאחר אירוע לבבי. שיפור קליני לאחר תוספת CoQ10 תועד באופן סלקטיבי ברבים מהמטופלים, אם כי עם תוצאות מעורבות ותלויות תפריט תזונה. במצבים בהם לא הופחתו מחמצנים מהתפריט התוצאות היו מעורבות. בסך הכל 30 חולי מחלת מיטוכונדריה נכללו בניסוי מוצלב מבוקר פלצבו כפול סמיות. הגיל הממוצע היה 48 6+/-3 שנים עבור קבוצת MELAS ו-56 6+/-3 שנים עבור יתר המשתתפים [מקור]. מדובר בטיפול בן 60 ימים של תוספת CoQ10 במינון בינוני עד גבוה (1200 מ"ג ליום) [מקור]. – מעטים יודעים שתוסף המזון Q10 – מוריד לחץ דם, ההמלצה של כותב מאמר זה ליטול רק על תוסף יוביקווינול Q10 נמצא שהוא בעל אותה ההשפעה על לחץ הדם שישנה לתרופות ובתקופתנו בה מתפרסמים שחלק מהתרופות מובילות לפגיעה בכליות ודלקת נפריטיס – עובדה זו לבדה לכאורה יכולה לשנות את ההחלטה ליטול אותו או אותן ולאפשר להציל חיים – אם הרופא שלך יסכים לכך.
יוביקווינול – מצויים בשוק. יוביקווינול היא הצורה הלא מחומצנת של התוסף והיא שמוגדרת כמצילת חיים. הסובלים מאי ספיקת לב חמורה. כשלוקחים Q10 הגוף מפרק אותו ליוביקווינול ובונה מחדש Q10. אגב מניסיון אישי – בחודש הראשון יש דווקא עלייה בלחץ הדם. לכן לא מומלץ להפסיק טיפול מיד, ולהקפיד על תוספי מזון מפחיתי לחץ דם כמו פקנוגנול, ברומלין ו Q10.
בנושא מחלות הלב וכלי הדם התמקדה הצלחתו של פרופ’ פרנקלין רוזנפלדט, מנתח לב אוסטרלי בעל שם עולמי, החוקר זה שנים את יעילותו של ה־ Q10, בו. פרופ’ רוזנפלדט הראה ממצאים שהראו שיפור הדרגתי ומשמעותי בתפקוד הלב ובתסמינים, בהם עייפות, כאבים בחזה ודופק בלתי סדיר. נמצא גם שנטילת תוסף Q10 יכולה לסייע בוויסות לחץ הדם ובהפחתתו בקרב אנשים הסובלים מיתר לחץ דם, ובפרט בחולים סוכרתיים הסובלים מלחץ חמצוני, שלו תפקיד קריטי בהתפתחות המחלה וסיבוכיה.
במחקר שהוא עך ביחידה לחקר ניתוחי לב, בשנת 2005, מצא שמתן של 300 מ”ג קו־אנזים Q10 ליום, שבועיים לפני ניתוח מעקפים או החלפת מסתם, הביא לעלייה ניכרת ברמות ה־Q10 במיטוכונדריות, לשיפור במדדים של התכווצות תאי שריר הלב ובהחלמת החולים לאחר הניתוח. במחקר נוסף”, מוסיף פרופ’ רוזנפלדט, ”נתנו לחולים שילוב של תוספים, בהם Q10, אומגה 3, חומצה אלפא ליפואית, סלניום ומגנזיום, והתוצאות היו דומות, עם שיפור בהחלמת החולים. כיום הוא נותן Q10 במינון גבוהים בהרבה ובמשך שישה חודשים לכל החולים שעוברים ניתוח לב.
כשלוקחים Q10 הגוף מפרק אותו ליוביקווינול ובונה מחדש Q10 טבעי. המטרה שלנו שיפור רמות ה־Q10 במיטוכונדריות של הנפרונים והפקעית שבכליות. שיפור זה הוא יסוד ואחד הסודות להחלמת מחלת הכליות
ריבופלבין
ריבופלבין הוא ויטמין B מסיס במים (B2) . הריבופלבין משמש כמבשר פלבופרוטאינים. הוא אבן בניין ומפתח במתחמים I ו-II וקו-פקטור במספר תגובות אנזימטיות מרכזיות אחרות המערבות בתהליכי חמצון חומצות שומן ומחזור של מעגל קרבס [מקור]. המינון הסטנדרטי נע בין 50-400 מ"ג ליום במנות מחולקות; ל 100 מ"ג ליום.
מחסור בוויטמינים: B3 (ניאצין) או B2 (ריבופלאווין) מעולל פגיעה חריפה במיטוכונדריה ובהמשך באבר הכליות.
ויטמין E
ויטמין E הוא כינוי למשפחה של רכיבים מסיסים בשומנים הקשורים מבחינה מבנית, מהם החברים המופיעים באופן טבעי, הטוקופרולים והטוקוטריאנולים, רלוונטיים מבחינה פיזיולוגית ביחס ל-ROS. יש להם יכולת לדכא ייצור רדיקלים חופשיים מסוג ROS בממברנות התא ובסביבות שומנים אחרות, ובכך להגן מפני חמצון של חומצות שומן רב בלתי רוויות (PUFA) (אפשר לראות זאת באיור 13A). הצורה הידועה ביותר של ויטמין E היא α-tocopherol, זו הצורה הפעילה לנטרול רדיקלי פרוקסיל. התגובה של רדיקלי פרוקסיל עם α-tocopherol מהירה פי 10,000 מאשר עם PUFA [מקור]. במהלך אינטראקציה עם רדיקלי פרוקסיל, α-tocopherol תורם אטום מימן פנולי ויוצר רדיקל α-tocopheroxyl יציב יחסית [מקור]. בתנאים רגילים, הרדיקל α-tocopheroxyl אינו מגיב עם מרכיבי הממברנה. במקום זאת, הוא מגיב עם רדיקל שני כדי ליצור מוצר לא רדיקלי, או שניתן להמיר אותו מחדש ל-α-tocopherol על ידי ויטמין C או חומרים מסיסים אחרים במים [מקור].
ויטמין סיויטמין C/l-אסקורבית הוא חומר תזונתי בעל מגוון פונקציות. רוב היונקים יכולים לסנתז אותו מגלוקוז, בעוד שבני אדם וכמה מיני יונקים אחרים איבדו את הגן המקודד ל-l-gulonolactone oxidase, שהוא הכרחי לסינתזה דה נובו של ויטמין C [(דה נובו מציין שהמהלך נוצר בתוך האורגניזם מחדש, בהבדל ממוטציה דה נובו: ביטוי בגנטיקה שפירושו צורה של מוטציה גנטית המתרחשת לראשונה אצל בן משפחה.) של DNA באתרי CpG [מקור1, מקור2].] לכן, נתונים in vivo המתקבלים מתוספי ויטמין C במכרסמים אינם ניתנים לשימוש בבני אדם [מקור]. ויטמין C הוא מרכיב חיוני בתזונה האנושית. על ידי פעולה כנוקלאופיל (תורם אלקטרונים), חומצה אסקורבית יכולה לנטרל מספר סוגים של ROS) [מקור]. במהלך תהליך זה, הוויטמין יכול לתרום אלקטרון, ולהפוך לרדיקל אסקורביל (semihydroascorbate) [מקור], שלאחריו עשויה להיות תרומה שנייה של אלקטרון שתגרום להיווצרות של dehydroascorbate [מקור]. חוסר התגובתיות היחסית של רדיקל האסקורביל הופכת את ויטמין C לנוגד חמצון יעיל. מלבד נטרול ROS ישירות, לחומצה אסקורבית תפקיד קריטי בהחייאת חומרים מזינים נוגדי חמצון אחרים, למשל, ויטמין E, ולפיכך יחד עם GSH, ויטמין C פועל כמרכז חיזור עיקרי[מקור1, מקור2]. בהתאם לפונקציות שלו נגד ROS, נמצא שוויטמין C גם מווסת את פעולות ROS בנתיבי איתות, כגון NF-kB, c-Fos ו-c-Jun [מקור]. מחסור חמור בחומצה אסקורבית מראה בקרב בני אדם רמות גבוהות של 8-oxodG, תוצר בולט של חמצון DNA [מקור]. כמו כן נמצא כי לתוספת חומצה אסקורבית יש תפקיד מגן מפני חמצון של ליפופרוטאין בפלסמה שמגיחה אל האדם (מושרה) בגלל עישון ועישון חריף [מקור]. הפחתת ROS והתפקיד המעכב של חומצה אסקורבית – ויטמין C – בהיווצרות גידולים היו נושא שנוי במחלוקת במשך יותר משני עשורים [מקור]. למרות שבקליניקה כמו שלי התוצאות של קצב החלמה מלמדות שמשהו לא מובן ממחקרים אלה בנוסף מספר מחקרים מוקדמים העלו כי חומצה אסקורבית יכולה לספק השפעות הגנה מפני גידולים [מקור1, מקור2, מקור3
גלוטתיון פראוקסידאז
גלוטתיון פרוקסידאז (GPx) (EC 1.11.1.9) הוא השם הכולל של משפחת אנזימים עם פעילות פרוקסידאז (peroxidase activity) שמגינה על האורגניזם מפני נזק חמצוני [מקור] התפקיד הביוכימי של גלוטתיון פרוקסידאז הוא להפחית את "מי חמצן" חופשי למים.[מקור]
באדם, גלוטתיון מיוצרת בגוף מחומצות האמינו ציסטאין, גליצין וחומצה גלוטמית. הבעיה פעמים רבות מחסור בציסטאין (כרוב, תרד, סלק, שום, בצל, ברוקולי, פלפל ואספרגוס) שיבולת השועל היא אחד המקורות מעולים לגליצין גם דלעת וקטניות במיוחד סויה ועדשים [מקור] מה שהופך את הציאסטין לגורם המגביל את קצב (rate- limiting factor) בביוסינתזה של גלוטתיון, שכן חומצת אמינו זו יחסית מעטה בפריטי מזון. גלוטתיון נמצא בתא בצורותיו המחוזרת (GSH) והמחומצנת (GSSG). הוא אחד משלושת האנזימים הפועלים כנוגדי חמצון בגוף. הוא בעל תפקיד חשוב ביותר בתפקוד מערכת החיסון. הוא משפיע על ייצור מוגבר של תאי T, על המרצת מערכת החיסון ועל חיזוק עמידות הגוף מפני גורמים מעוררי מחלות. אנזים זה הוא חלבון המורכב מחומצות האמינו ציסטאין, חומצה גלוטמית וחומצת האמינו גליזין. עוד גל הגלוטתיון במאמרי – כאן, וכאן
קרוטנואידים – α-קרוטן, β–קרוטן, ליקופן, לוטאין ו-β-cryptoxanthin
קרוטנואידים הם קבוצה גדולה של פיגמנטים אורגניים טטרטרפנואידים והם יכולים להגיב בקלות עם ROS כגון רדיקלי פרוקסיל או רדיקלי אלקוקסיל התורמים אלקטרונים, בכל זאת נראה שתפקידם העיקרי הוא כיבוי 1O2 [מקור]. מולקולת קרוטנואידים אחת אמורה לכבות כ-1000 מולקולות 1O2 [מקור]. מבין למעלה מ-700 קרוטנואידים שונים שנבדקו עד כה, כ-40 מהם נמצאים בתזונת האדם, אך לא כולם יעילים לתהליכי החלמה והם לא נשמרים באופן אחיד בגופנו. רק כמחצית מה קרוטנואידים שבתפריט הרגיל או פחות מ-20 קרוטנואידים ומטבוליטים יעילים למטרתנו [מקור]. בין הכוכבים הבולטים: α-קרוטן, β–קרוטן, ליקופן, לוטאין ו-β-cryptoxanthin.
בטא-קרוטן (β–Carotene) הוא קרוטנואיד צבען אדום-כתום עז, המצוי בשפע בצמחים שונים, גזר, דלעת, לפת, בטטה, תרד, כרוב מנגו, פּפּאיה, וברוקולי. תפקידו הנודע היותו מרכיב ואבן בניין לייצור ויטמין A בגופנו. הוא גם הקרוטנואיד הנחקר ביותר. משערים שיש לו תכונות נוגדות גידולים, אך התוצאות של מחקרים אפידמיולוגיים בנושא זה אינן חד משמעיות, שכן חלקם תומכים בתפקיד המגן שלו [מקור1, מקור2, מקור3] כיום אנחנו סבורים כי אין להשתמש בו בחשד לגידול משום שתוסף זה עלול להיות מזיק, מכיוון שבמחקר ATBC מקור1 , מקור2] נמצא קשר בין נטילתו וסרטן מוגבר, בעיקר סרטן הריאות, ערמונית וסרטן הקיבה. לעומת זאת, דווח כי α–קרוטן נמצאו מסייע ומגנים מפני סרטן עור. ליקופן, לוטאין ו-β-cryptoxanthin דווחו גם כבעלי פוטנציאל לדיכוי גידול [מקור1, מקור2]. עם זאת, היעדר ניסויים אקראיים מבוקרי פלצבו בבני אדם בקנה מידה גדול מונע מהחלטה סופית לגבי התכונה גידולים של קרוטנואידים אלה לא כן לגבי היותם נוגדי החמצון
חומצת שתן Uric acid
היכולת של חומצת שתן (אוראט) לנקות רדיקלי חמצן ולהגן על קרום האריתרוציטים מפני חמצון שומנים תוארה כבר על ידי קלוג ופרידוביץ' (Kellogg and Fridovich) [מקור]יותר מאוחר הסתבר כי במחזור הדם (בפלזמה) Urate יכולה למנוע חמצון שומנים אבל רק כל עוד חומצה אסקורבית קיימת בו כלומר לשם שימוש בחומצת השתן שהגוף מייצר דרושה נטילה של תוסף מזון בשם ויטמין C [מקור]. חומצת שתן, מוכרת כנוגד חמצון עיקרי בפלסמה שלנו, הרבה שנים, לתפקודה דרושה נוכחות של ויטמין סי, הגם שהיא משמשת מדד ידוע ומנבא להתפתחות של השמנת יתר, יתר לחץ דם, גאוט, מחלות לב וכלי דם, מצבים הקשורים ללחץ חמצוני בכלל זה ירידה בתפקוד המיטוכונדריה, פגיעה בכליות ויצירת אבנים בכליה או ציסטות. חומצת שתן הוא מדד שיכול לשנות כשהוא מופיע במדידה מעל לטווח הנורמה אסטרטגיה של טיפול להחלמת הכליות. נוכחותה של חומצת השתן בהחלט יוצרת פרדוקס ומקשה מאוד על תהליכי הבנת "חוכמת הגוף". ללא ספק עלייה בחומצת השתן מייצגת ניסיון הגנה של המארח, כלומר של גופנו, ובכל זאת העדויות על כך שחומצת שתן עשויה לתפקד כנוגד חמצון (בעיקר בפלסמה) או פרו-אוקסידנט (בעיקר בתוך התא – ומגן על המיטוכונדריה) מעוררת סקרנות והתלהבות לגבי אפשרות חדשה לדרכי החלמה ושימוש בה. החוקרים סבורים כיום כי תפקודה של Uric acid כפרו-חמצון מתרחשות במחלות כלי דם, שבץ מוחי, אי ספיקת לב, יתר לחץ דם עורקי ופרפור פרוזדורים ועשויות להיות להם תפקיד תורם בפתוגנזה של מצבים אלה [מקור1, מקור2].
סֵלֶנִיוּם – סלניום הוא יסוד קורט הממלא תפקידים ביולוגיים חיוניים [מקור]. עוד על הסלניום במאמרי – כאן גם קוורצטין הוא חבר בולט נוסף בפוליפנולים, שמשמשים באיזון מחמצני הגוף שלנו. נוּטְרִיֵּינְט מסקרן נוסף הוא האפיג'נין (Apigenin) מוצר טבעי השייך למחלקת הפלבונים ומשמש כנוגד חמצון וחומר תזונתי נוגד גידולים – Apigenin נמצא בפירות וירקות רבים, אך בפטרוזיליה, סלרי, סלרי ותה קמומיל הוא נמצא בכמות טיפולית [מקור]. כמו כן דווח על תפקידי הגנה של פוליפנולים תזונתיים אחרים: כורכומין, קטצ'ינים, איזופלבונים, ואנתוציאנידינים ונראה כי תפקידם כחומר מזין אנטי גידולי ואנטי מחמצנים ורדיקלים חופשיים ישמש מטפלים עוד שנים רבות כמו גם בתחום המחקר.
לסיכום
ניתן להשיג את הפחתת הלחץ החמצוני במיטוכונדרה בשלוש רמות: על ידי הפחתת החשיפה למזהמים סביבתיים בעלי תכונות מחמצנות, על ידי הגדלת רמות של נוגדי חמצון אנדוגניים ואקסוגניים, למשל על-ידי הרחבת ייצורו של הגלוטתיון על-ידי הגוף או מתן ויטמין C במינון גבוהה כמו קו אנזים Q10 וויטמין E או על ידי הפחתת יצירת לחץ חמצוני על ידי ייצוב ייצור ויעילות האנרגיה של המיטוכונדריה. לחץ חמצוני אנדוגני יכול להיות מושפע בשתי דרכים: על ידי מניעת היווצרות ROS או על ידי כיבוי של ROS עם נוגדי חמצון. עם זאת, התוצאות של מחקרים אפידמיולוגיים שבהם אנשים טופלו בנוגדי חמצון סינתטיים מאכזבות ביותר. עדויות אחרונות מצביעות על כך שתוספי תזונה נוגדי חמצון (אם כי מומלצים מאוד על ידי תעשיית התרופות ונלקחים על ידי אנשים רבים) אינם מספקים הגנה מבוקשת בדרך כלל ולא מגנים מפני עקה חמצונית, נזק חמצוני גם לא מסייעים להחלמה או להרחבת תוחלת החיים [מקור], אלא אם כן הם נתנים במדוייק לחולה ויש לשנות כל הזמן מינון וסוג כך למשל יש לחדול ממתן ויטמין E, ולעבור למתן ויטמין B1 כשמתחילים לזהות כשל במחלת כליות כרונית באחד האברים הרחוקים. במקרים אחרים יש להוסיף אצה אדומה או קוורצטין וקמח קליפות אננס, רימון או L ארגינין ופחם אקטיבי. בשלב זה נראה כי המפתח להצלחה בהפחתת הנזק שנגרם כתוצאה ממתח חמצוני למיטוכונדריה ולאברי הגוף החיוניים בעידוד ייצור של נוגדי חמצון פנימיים שהגוף מייצר בעצמו. ככל שיצליח הגוף בעזרת המטפל המסור להוסיף עוד אנזימי סופראוקסיד דיסמוטאז (SOD) וקטלאז כפי שהצליחו החוקרים לבצע בניסויים גנטיים הארכת תוחלת החיים אפשרית [מקור].
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
For the avoidance of doubt, consult a physician (who knows in detail the general health of each patient or yours) before using any medicine, food, extract or any exercise. The information on Yaron Margolin's website or the "Healing Presses" website (on Facebook or MARGOLINMETHOD.COM), in the above article and in Yaron Margolin's articles are material for thought – philosophy neither recommendation nor public guidance to use or cease to use drugs – no information on this site or anyone You should always consult with a qualified physician or pharmacist regarding pain, bad feeling, or goals and how to use foods, ointments, extracts and even exercises, or other remedies that are mentioned as such
מאמרים אחרונים
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- בריאות הנפש ואריכות ימים – מאמר על הטלומרים והשפעת הרגשות עליהם
- מלטונין הוכח שהורמון השינה נוגד חמצון רב עוצמה ויעיל כתרופה בקרב חולי כליה
- התקף לב / אירוע לבבי בעקבות מחלת כליות – מסלול איתות שמגן על הלב בשם "VEGFA" משתבש בגלל מחלת כליות כרונית.
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם
- לחץ דם גבוהה מסיבות נפשיות ויתר סטרס בחיי האדם –
- איך לא להגיע לדיאליזה
- זיהום סביבתי מקדם את מחלת הכליות
- הבדידות – חזית חדשה ומקור רב משמעות למחלות כרוניות – מגפת הבדידות
- שיגאקי הינוהרה הרופה שהמליץ ליהנות מהחיים, להיות צנוע מול צלחת האוכל ולצאת לגמלאות מאוחר ככל האפשר
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- הליקובקטר פילורי – Helicobacter pylori חיידק חתרני שנמצא כמעט אך ורק בבני אדם – טיפול
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- שיראטאקי אטריות קונג`אק – מתכונים
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש
- מחקר חדש דילול השכבה הדמית [כורואיד (Choroidal)] ורשתית העין במחלת כליות כרונית קשור באופן ישיר לירידה ב-eGFR וניתנים לשינוי עם הטיפול התזונתי.
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- אמנות ההחלמה האבודה
- תעוקת חזה מיקרו-וסקולרית
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- 8 חסרים תזונתיים שכיחים
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- תוסף מזון על האסטקסנטין astaxanthin
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין A?
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- דיוקסינים במזון
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- רוצה להחלים מאי ספיקת כליות – יש להגיע לטיפול מחלים כליות מהר ככל האפשר
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- צרבת כרונית – רוצה להחלים ללא תרופות?
- מהי תסמונת מטבולית (MetS)?
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- ממצאים חדשניים למקור הגאוט
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- צרבת כרונית – רוצה להחלים ללא תרופות?
- יתר שומנים בדם היפרליפידמיה – חשש לצורך בצנתור
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ’יינג’
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- התרופות והרע – לחץ דם
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מזון למוח – המזון הבריא למוח תומך בגמישות מערכת העצבים שלו וביכולת הלמידה, שומר על הזכרון, ומונע מחלות כגון אלצהיימר.
- מרחבי חיים מאריכי חיים – האזורי הכחולים
- קשר הגלוטן – אלרגיה לגלוטן והאם הימנעות מגלוטן מוצדקת?
- מהן עיניים אדומות?
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- הדמימה – מה היא דמימה
- אורפאוס – דמימה בניהול קרירה שמשתקפת ככיווץ שרירים בבית החזה ובשורש כף היד
- כואבות לי הידיים נורא – היכולת לנצח, להתגאות או לשמור על מקומך בפסגה משתקפת באמות הידיים שלך
- כאבי אוזניים – מסתוריות האוזניים הכואבות
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- טיפול טבעי בכליות – מה אתם יודעים על קורדיספס מיליטריס
- מהי תסמונת מטבולית (MetS)?
- גלוטתיון כל האמת
- כיווץ שרירים כרוני וטיפול
- מקצועי יצרו דרך לזהות את סרטן הלבלב (PC) וגם את ההתפתחות של סרטן הערמונית באמצעות בדיקת שתן, בדיקה שיכולה לעזור בגילוי מוקדם.
- סוכר פירות – האם פרוקטוז יכול לתרום להתפתחות אלצהיימר?
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- איך להוריד את רמת האינסולין בגוף באופן טבעי ופשוט
- חזרה לבסיס – עקרונות צירופי המזון
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- גודש נוזלים בריאות – בקרב חולי כליה
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- על ההשפעה האיומה של חלבון מן החי על הכליות
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- ריפוי פצעים וצמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית לצורך תרומה או טיפול
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מרק גרין קארי – מתכון
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- התה הטחון – מאצ'ה Matcha מתכונים
- – אורז מותסס בבית מתכון
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- אגוז מרפא ביבהיטקי
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- על ההשפעה האיומה של חלבון מן החי על הכליות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- התרופות והרע – ומי הורס לך את ה-Q10
- מחסור בויטמין בי-1 מייצר סיוטי לילה וחלומות זוועה B1
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הפאסטיון המאהב של אלכסנדר הגדול Hphaestion
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- חרדה
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- למה אני לא מצליח להתמיד – והסוכר
- ניתוק רגשי – על הקורוציונה
- נמאס לי מהחיים מה עושים
- התודעה השלילית
- מגיע לי – העדר הכרה במאמץ של השועט קדימה, יכולה להרוס אותך
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- דיוקסינים במזון
- אכל נקי
- הקורטיזול וכאבים בבית החזה וביד שמאל
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- התרופות והרע – ויטמין D3
- התרופות הטובות והרע – אבץ
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- תזונה תאית
- אף סתום או גודש באף – תוסיפו מלח
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- איך להיראות צעיר מגילך – כל הסודות
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- תוסף מזון על האסטקסנטין astaxanthin
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- קריאת הגוף – מה אומרות פניך
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- מחסור בברזל
- מהו אימון שלפוחית השתן?
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- חלבון בשלב אקוטי
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- גלוטתיון Glutathione ו-N-אצטיל-ציסטאין (NAC)
- תסמונת היד הסוכרתית – רמות גבוהות של A1c קשורות להתפתחות של נפיחות באצבעות היד שגורמת כאב ומכונה תסמונת התעלה הקרפלית (גם תסמונת מנהרת שורש כף היד).
- אריתרופויטין (EPO) Erythropoietin
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- סודה של דיאטה מצליחה תמיד
- סבל מהרגלים רעים – רוצה להתפתח? !
- תוספי סידן – זהירות – סיכון לשבץ מוחי
- למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה.
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- (תירואיד)
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- קרום התא – הממברנה והדלקת הכרונית
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מפרקינסון
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- שחיקת סחוס, למה לסבול? – ללא ניתוח ללא תרופות – טיפול להחלמה
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מיתר לחץ דם?
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- טריגר – הסיוט שאינו נגמר
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- תעוקת חזה מיקרו-וסקולרית
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- ירידה בתפקוד הכליות
- פיטר דה הוך – גאון ומוביל דרך
- מזרקת האריות – מורוסיני Morosini Lions Fountain – Eleftheriou Venizelou Square
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות



כתיבת תגובה