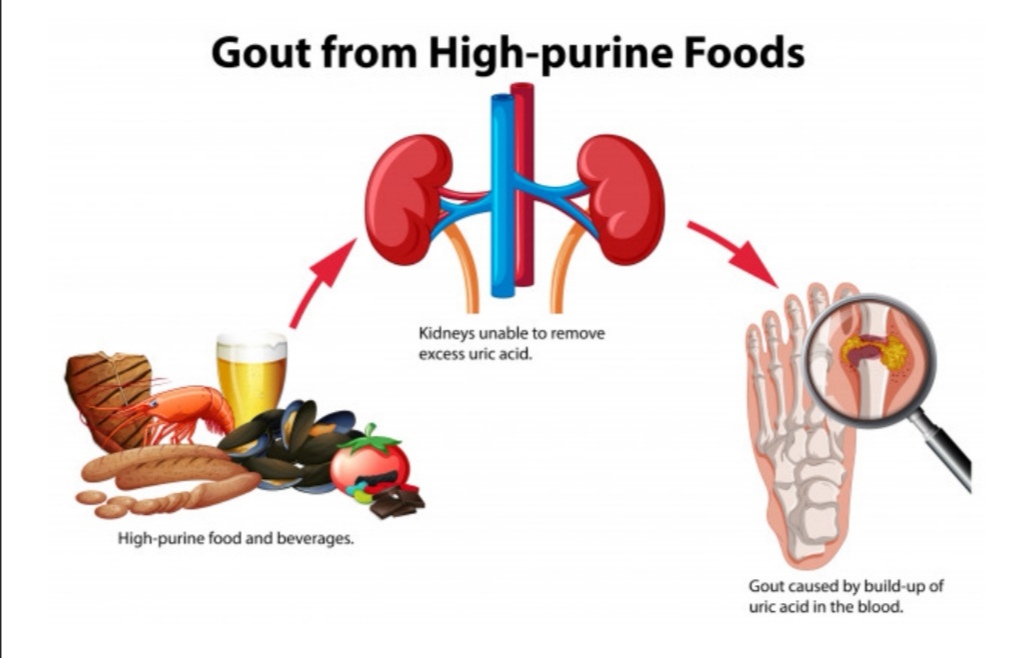
במקרה שהפחתת פורינים לא עוזרת מחפשים את הבעיה במקום אחר – לא בתזונה אלא בגנטיקה – זה המצב שמאמר זה חושף לפניך – אותה מחלה יתר אוראט (גבישי סודיום) מצטברים בדם – בסרום מאז ומעולם מוכרת כגאוט וסיבותיה משל הייתה מחלה אחרת הורמוני המין.
Hyperuricemia או הומאוסטזיס אורט היא רמה מוגברת של חומצת שתן, (Uric-acid) בדם מכונה גם אוראט בסרום גאוט, מחלת המלכים (יתר בשר ואלכוהול). מצב בו מופיעה כמות גדולה של גבישי חומצה אורית בגוף. חומצה אורית היא רעל. והיא משפיעה על מערכות רבות בגופינו. בעיקר מוכרת בשל השפעותיה על דלקת ספציפית לגבישי סודיום – גבישי החומצה האורית נוצרים כאשר חומר בדם, שנקרא חומצה אורית (UA) שהופכת בגוף ממצב של מסיס במים למוצק, וגבישי. הגבישים הללו מעוררים פתולוגיות שונות ומהווים רקע למחלה שיכולה לפגוע בכליה, במפרקים מדובר במחלה דלקתית. מכאן גם הפניה לתרופות אנטי דלקתיות בהן במקרים מאד קשים משתמשים גם ב anti-TNF-α – כאן
הדלקת הספציפית לגאוט נגרמת בגלל ציטוקין בשם: IL-1β. הוא מתווך מרכזי של תגובה דלקתית. חיוני לתגובת הגוף המבקש להחלים עצמו ולעמידותו בפני רעלנים – פתוגנים, הוא גם עלול להחמיר את הנזק במהלך מחלה כרונית ופציעה חריפה של רקמות כמו בגאוט. תוכלו לקרוא עליו כאן. ר ml/mg 150 Ilaris – אילאריס, 150 מ"ג, תמיסה להזרקה נחשבה כתרופה יעילה לבלום את הציטוקין הזה אבל ביום ה 26/02/2019 הודיע משרד הבריאות ששיווקה הופסק. נרשם בהודעה: מסיבות מסחריות – התרופה הוגדרה מאוד יקרה. מי שמבקש תרופות יכול לעבור לארכליסט – Arcalyst (Rilonacept) תרופה עם מרשם הנקראת חוסם אינטרלוקין-1 (IL-1). משמשת לטיפול במבוגרים וילדים מגיל 12 ומעלה עם תסמונות מחזוריות הקשורות ל-Cryopyrin (CAPS), כולל תסמונת דלקת אוטומטית של קור משפחתי (FCAS) ותסמונת Muckle Wells (MWS). בהצלחה לאוהבי התרופות. יש ומחלת הגאוט מתפתחת ממעמקים גדולים יותר ומקורה לא בתזונה. זה המקרה שלנו כלומר בו מאמר זה מתמקד. כאשר מדדי תפקודי הכליות של הנער שהגיע עם גאוט מסוג זה מאירים את הדרך המורכבת אל ההחלמה. גאוט נדיר מאוד, שדורש טיפול ייחודי. גאוט מאתגר ואפילו מעניין הוא שעומד במרכז המאמר ואני חושב שכדאי להכיר אותו. יתכן שבעבר מחלת הגאוט פגעה בכליה אך היא נרפאה, כרגע אנחנו מתבוננים בגאוט ומחפשים גם את מקור הבעיה (גן, בו ידובר להלן) וגם את הפתרון לבעיה – בסוף המאמר.

בדרך כלל גאוט פוגע בכפות הרגליים, בבוהן – גם שם אנחנו לא נמצאים. אנחנו בתחילת המחלה – או בחשיפתה. בבסיס עצמו.
במצב זה מסתכלים על הגנים – טיפול במקרה זה יתר חומצת שתן ב-UA מחפשים חלבוני מעבר ואלו כוללים חלבוני מעבר כלייתיים ואלו כוללים חלבוני טרנספורטר מרובים וכן חלבוני מעבר במעי הדק העליון. במעי הדק העליון מתבוננים בחלבונים ממשפחת האניונים אורגניים (OAT) – אני שולל ע"פ הממצאים בדף הבדיקות אותם כבעיה. במעי מופיע חלבון נוסף ABCG2 שקשור בספיגה החוזרת של חומצת השתן. הוא פועל גם בכליות. בצינור של הנפרון. גנטיקה נקשרת כאמור עם רמות גבוהות של חומצת שתן בדם – הגן משפיע לטוב ורע על יתר חומצת שתן בדם – (SLC2A9) בדם והוא שמעלה את הסיכון לחלות בגאוט (ABCG2) בילדים ומבוגרים כאחד, הוא תלוי מין. כלומר הסכנה להופעתם גדולה בקרב הגברים, או במלים אחרות אסטרוגן מרגיע אותו.
למאמרי: חומצה אורית מצב המכונה גם טופי – צום פורינים – כאן
כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
SLC2A9 הוא טרנספורטר מוביל חלבון הובלה, נשא של Uric Acid ובעל הזיקה הגבוהה, אחד משני טרנספורטרים שאחראים בעיקר לספיגה מחדש של UA חומצת שתן בנפרונים.
ABCG2, הטרנספורטר העיקרי השני, מעביר UA אל מחוץ לתא את חומצת השתן – שניהם תלויי גן שנחשף כנרגע בנוכחות אסטרוגן.
מפרידים בתוך קבוצת המזון הזאת את הקטניות ה"טובות", במיוחד מוצרי פולי סויה שנכנסים מבינת פורין לרשימת האסורים כי הם מספקים עומס פורין בינוני וגבוה. בכל זאת נשתמש בהם ליהב. כי כאמור לעיל, הבעיה שמשתקפת כאן גנטית, לא פורין ולא תזונת פורין.
גוף האדם אינו יכול לפרק את החומצה האורית ולכן היא חייבת להיות מופרשת בשתן דרך הכליות או דערך הצואה, חלבוני מסע – טרנספורטרים מעבירים אותה, בלעדיהם רמתה בדם עולה, אבל אם הרפסודה הזאת בזרם שוקעת, נחבלת, טובעת עם חומצת השתן שנמצאת עליה – אסון זיהומי מתרחש ומה שעלול להביא למחלות לב, פרקים וכליה מורכבות וקשות לטיפול. ומסיבה זו עלייתה של חומצת השתן (UA) גם נקשרת במחלת הכליות. העליה במדד של החומצה האורית אומר גם שישנה ירידה בהפרשתה בשתן (בעיקר) וזה דבר מסוכן – יש לבעיה זו כמה סיבות אפשריות לבד ממחלה כרונית קשה כאי ספיקת כליות, סרטן או צריכת אלכוהול מוגברת: [הפרעה באספקת הדם לכליה, מחלת כליה אחרת, השמנה, צום, ותרופות כמו תרופות משתנות להפחתת יתר לחץ דם גבוה – שמעלות אותה בדם נטילת תרופות, בעיקר מורידי לחץ דם ממשפחת המשתנים כמו התיאזידים למשל הידרוכלורותיאזיד (שם מסחרי דיזותיאזיד) גם אינדפאמיד, מטולזון indapamide, metolazone] ובעיה גנטית – כאן הבעיה גנטית.
הטיפול המומלץ אם כן הורמונלי מתן אסטרוגן. אבל, לדעתי חובה מוסרית מוטלת עלינו לחפש דרכי טיפול יותר אחראיות ומגוננות על חיי הבחורים שלקו בגאוט ואין ספק שתורשה עומדת מאחרי הקלעים של מדדי החומצת שתן שמאיימת בהצטברותה בדמם ובמערכת העיכול שלהם על בריאותם ולא תזונה עשירה בפורינים הבעיה ולא שינוי תפריט התזונה הוא תרופה למחלתם, ובשל הטיפול לכאורה באסטרוגן ישנה סכנה לשלום התפתחות נפשם וגופם של מתבגרים. אלו הנושאים המרכזיים שמאמר זה דן ומציג אותם לקורא –

יתר חומצת שתן. היפראוריצמיה היא הפרעה מטבולית שנקשרת בפורין וידועה כמבשרת של גאוט [מקור].
בדרך כלל יתר חומצת שתן Uric Acid מדברים על צום פורינים כפתרון לבעיה – Hyperuricemia זו מחלה ידועה מזה 2600 שנים וכל הרופאים הגדולים בהיסטוריה התמודדו אתה. בצום פורינים אסור לגמרי לאכול סוכר פירות (Fructose) ולכן כל הפירות פרט לפירות יער, צבר ואבוקדו או אפונה אסורים, גם תירס אסור – מעטים יודעים אבל הוא מכיל הרבה פרוקטוז, תמצאו אותו במדדי הפורין כמותר, אך לא כל הטבלאות מתאימות בבואנו לבלום מחלה כה קשה. לחם מדגנים מלאים – אזור, כל פירות הים אסורים גם אומגה 3, כי ככה זה בצום פורינים אסור בשר בכלל כל סוגי הבשר (יש להדגיש כי לא כל המזונות מן החי מעלים את הסיכון להתפתחות צנית-גאוט כלומר יתר חומצת שתן בדם.), עופות, בשר, חזיר, ומשקאות קלים לגמרי אסורים במיוחד אסור כבד חזיר תכולת הפורים במאה גרם כבד חזיר מאוד גבוהה – 285 מ"ג שמייצרים 331 חומצת שתן שמופקת ממנו מגיעה ל-331 יחידות מאוד דומה לפטרוזיליה (289 פורין ו 341 יחידות UA) אבל מדג מקרל חי היא מגיעה ל 400 יחידות של חומצת שתן, אבל אם אוכלים אותו עם העור. בקשר לכבד עוף שנמצא גם הוא באסורים כל 100 גרם של כבד עוף מכילים 312 מ"ג פורין וזה הרבה מאוד ובשיטאקי (פיטריות) – 380 מ"ג פורין גם אנשובי מיובש אסור, סרדינים בשמן ושפרוט מעושן ומים מנרלים, ספירולינה נורי, ושמרי בירה באסורים [מקור], פול הוא מנה מעולה להפחתת פורין וגאוט במאה גרם יש רק 35 מ"ג פורין. חומוס מכיל פחות מ-50 מיליגרם של פורינים למנה של 100 גרם, למעשה החומוס מכיל 54 מ"ג פורין כשהוא מבושל במים, והוא טוב להפחתת חומצת שתן בדם, החומוס בהחלט נכנס לרשימת המותרים. החומוס גם אנטי חרדתי וזה טוב לתהליכי החלמה. להשרות ללילה את הגרגרים, לבשל במים, לנקות היטב ושוב לבשל במים אבל הפעם עם אבקת מרק שיש בה סודיום גלוטמת – כדי שיהיה טעים (לא להמליח) בנושא זה מאמרי מלח שולחן ויתר לחץ דם, אבל מחלימי כליה חייבים לזכור שהם צריכים להוסיף לתזונה שלהם 1/2 כפית מלח כל יום. נאטו (פולי סויה מותססים) מותר – כאן אפשר לקרוא על הנאטו, כוסמת – מותר, שעורה חייבים, גם שיבולת שועל – כוסמת ירוקה נמוכה בכמות הפורין – הכוסמת הירוקה מכילה פורין 25 מ"ג פורין בלבד (ל/100 גרם), אפשר להכין ממנה דייסת בקר או בליני – מתכונים כאן. כרוב, אבוקדו (19 מ"ג), תפוחי אדמה, ואפילו כרובית כול האחרונים מותרים. תפוח עץ מכיל 14 מ"ג פורין בלבד – חסה מכילה רק 13 מ"ג פורין – אפשר להכין ממנה מיץ ירוק עם תפוח עץ אחד, להוסיף כרוב ירוק שמכיל רק 22 מ"ג פורין, מקרב העלים הירוקים אסורים תרד, פטרוזיליה, גם גרגירי הקינואה נמצאים באסורים וכן שמרי בירה (שמכילים 2996 מ"ג פורין בכל 100 גרם). פרג וגרעיני חמניה מכילים מעל 150 מ"ג פורינים (ל- 100 גרם) – מומלץ להימנע מהם, ככלל מותרת אכילה רק של ירקות שמכילים פחות מ 50 מ"ג פורין ל 100 גרם. תפוח עץ למשל מכיל רק 6 מ"ג פורין ל100 גרם ולכן הוא במומלצים) לחולי כליה שסובלים מגאוט אני מאשר בדרך כלל מנה של 4 כפות כוסמת ירוקה מושרת, לאכול לאחר שתיבלנו אותה במיץ לימון סחוט טרי, שיבולת שועל מותססת (4 כפות במנת ארוחת הבקר – למתכון התססת שיבולת שועל כאן) וכן מנה של ברוקולי 3 פעמים בשבוע (ברוקולי מכיל 70 מ"ג פורינים ל 100 גרם) וכפית ווקמה יבשה 3 פעמים בשבוע. עד כה כל מדדי הגאוט ירדו פרט למקרה אחד הוא נושא מאמרי זה. באצות ווקאמה נמצאים 262 מ"ג פורין בכל 100 גרם – כאמור לעיל, אני מאשר לחולי כליה הסובלים מבצקות וגם לחולי ריאות ליטול כפית ווקאמה 3 פעמים בשבוע. להרבות כורכום וסלרי. (חולי כליה לכם אסור סלרי). כיכלל נגד גאוט טובים כל תוספי המזון האנטי אוקסידנטים וכל נוגדי הדלקת כולל שום וכורכומין – לא הכל מתאים לחולי כליות למשל מורינגה אסורה על חולי כליה וכן פתל שחור (5 מ"ג) ודובדבנים (6 מ"ג פורין לכל 100 גרם) [מקור].
כיום ידוע שיש מזונות שמכילים פורינים, אבל הם מותרים על נושא זה פרסמתי כאן –
גאוט קשור למזון והוא תרופתו – כיוון שהמצב הגאוטי הוא בברור עודף והצטברות של חומצת שתן, שיכולה להיות קשורה קשר הדוק לתזונה שלנו – בעיקר בפורין. על רגל אחת אפשר לומר כי חומצת שתן UA, היא התוצר הסופי של חילוף החומרים (פרוק במערכת העיכול שלנו) של חומר הזנה בשם פורין שנמצא בעיקר במוצרים שומניים מהחי אבל גם באצות, מקורה בהיפוקסנטין (hypoxanthine) לאחר פעולה של אנזים (זרז – קטליזה) כפול – קסנטין אוקסידאז (XOD) שהופך אותו לחומצת שתן [מקור].
קסנטין דווח לראשונה כמרכיב של אבני כליות על ידי הכימאי השוויצרי Marcet בכר ב-1817. הואטבע את המונח: "קסנטינוריה" כתרחיש אפשרי לרמות גבוהות של חומר זה בשתן שעשוי לגרום להופעת אבנים בכליות. [מקור]. מאוחר יותר ובמקרה דומה לזה שהגיע לטיפולי של אתלט שסבל מהתכווצויות שרירים קשות, אשר בביופסיה של השריר שלו נמצאו גבישי קסנטין. התופעה הזו נדירה ביותר וחריגה במרחב כלל המחלה שמדובר בה כאן – יתר חומצת שתן על בסיס מיני. באופן בלתי תלוי, ובאותם ימים בסוף שנות ה-30, דווח בניו-זילנד על הופעת אבני קסנטין בכליות של כבשים, וייחסו ממצא זה לעובדה שהקרקע המקומית ענייה ביסוד מוליבדניום (MO), וכפי שהתגלה בהמשך יסוד זה חיוני כקו-פקטור לפעילות האנזים קסנטין אוקסידאזה (XO), מה שגרם בכבשים אלה להצטברות קסנטין על חשבון החומר allantoin, המופיע בכל היונקים פרט לבני-אדם, והוא תוצר פירוק של uric acid על ידי האנזים uricase שאינו קיים באדם. שנת 1993 סונתז ביפאן בה נמצאו מספר רב של מחלת יוריק אסיד על בסיס מיני החומר febuxotat, והסתבר שהוא מעכב יעיל של האנזים XO. Febuxotat פותח כתכשיר להפחתת רמת uric acid , עם יעילות די טובה, ועם פחות תופעות לוואי מתרופה שהומצאה קודם לה. כבכל תרופה של הממסד גם כאן יש בעיות כי למרות שהתכשיר החדש מביא להפחתה של גבישי קסנטין, הוא גורם אם כי פחות להופעת אבני כליות, ולכן הוא גם יכול להינתן לאלה עם פעילות מופחתת של הכליות באותו מינון כמו שהוא ניתן לאנשים ללא מחלת כליות, שכן הפרשתו בשתן תלויה אך מעט בדרגת תפקוד הכליות. עוד פרט חשוב לציין כאן כי חסר של uric acid בשתן הוא אמנם ממצא מרכזי באבחון של קסנטינוריה, ומאמר זה מתמקד בעודף בה [מקור].
קסנטין הוא תוצר במסלול הקטבולי (רצף של תהליכים מטבוליים אשר מפרקים מולקולות גדולות) כאן מסלול לפירוק פורינים: הוא נוצר מ-guanine (בטבלת מזונות עם יתר פורינים בדרך כלל הגואנין – הוא בסיס חנקני, נגזרת של פורין, גם מסומן, למשל – כאן. כך באבוקדו למשל (בכל 100 גרם) 7.5 מ"ג של גואנין, 18.4 פורינים שנותנים ס"כ 21.8 מ"ג חומצת שתן. כהשוואה פטרוזיליה שנמצאת בקבוצה הרביעית מבחינת יתר פורינים נמצא 135.1 מ"ג פורין לכל 100 גרם ו 288.9 מ"ג פורין סה"כ תוצרת חומצה אורית = 341.3 מ"ג [מקור]). על ידי האנזים guanine deaminase, אך גם הוא נוצר מ- היפוקסנטין על ידי האנזים xanthine oxidoreductase, שהוזכרו למעלה, וכן נוצר בגוף קסנטין מ-xanthosine על ידי האנזים purine nucleoside phosphorylase, או PNP. קסנטין עצמו מוסב בהמשך ליצירת uric acid על ידי פעולת האנזים xanthine oxidase [מקור]. אחזור לדון בקסנטין אוקסידאז בפרט למטה., לכשיהיה בידנו עוד קצת חומר להבנת מורכבותם של הדברים שהפתרון להם בסופו של דבר פשוט, טבעי ומאוד מדויק.
באופן ברור חיסול המחלה היפר-אוריצמיה נוסה על ידי מניעה של פורין ועל כך אפשר למצוא עשרות אלפי מחקרים ויותר מאמרים. אלא שישנם מקרים והם נדירים אך נמצאים גם בישראל ואפילו הגיעו לטיפול בקליניקה שלי שההחלמה אפשרית רק על-ידי תיקון מערכת הסינון וההפרשה וזה נושאו המרכזי של מאמר זה. בהחלט לא תזונה דלת פורין עליה הרחבתי במאמר – כאן. אעמוד בקצרה על צום פורין מיד, אבל עלי להדגיש ש
ישנם מקרים תלויי מין וגיל (נערים גבריים, נשים מבוגרות וכד) בהם צום פורין אינו מניב תוצאות מאמר זה מוקדש ומתמקד במקרים נדירים אלו –
לעתים קרובות במקרים הנדירים הפתרון אך ורק על ידי הגברת הפרשת הפורין עצמו על ידי הכליה [מקור]. צמצום פורין בתזונה יעזור אך לא יפתור את הבעיה כשאין מערכת סילוק פורין מתפקדת.
ברגיל גאוט היא מחלת תפריט תזונה לא מתאימה לאדם הלוקה בה. לכן שינוי התפריט הוא גם התרופה היעילה ביותר למנוע יתר לחץ דם או אי ספיקת כליות ומחלת כבד שהגאוט מקורן. השליטה במה שמכניס אדם לגוף יכולה להיות הדרך היעילה והטבעית להפחתת התלקחות של מחלת הגאוט. מחלה שיכולה להיות מאוד קשה. לא במקרים שלפנינו
ככל שאנו משיגים תובנה על תפקוד המערכת הגופנית לגבי האופן שבו אורט תורם למחלות, הולך ונחשף בפנינו הבדל אחד מאוד ברור בוויסות הפיזיולוגי של הומאוסטזיס אורט (גבישי סודיום) וההבדל הזה מיני מדובר על
הבדל משמעותי של הומאוסטזיס אורט (גבישי סודיום) בין גברים לנשים.
נשים נפגעות פחות באופן מאוד משמעותי מגברים במחלה שמשתקפת במדד חומצת שתן גבוה UA. בנוסף לכך ניכר כאן כשל גנטי שנחשף יותר באוכלוסית יפן וקוריאה, אלא שגם הוא מופיע יותר בקרב אוכלוסיה גברית ופחות בקרב הנשים.
חומצת שתן ([מקור] trioxypurine-C5H4N4O3) היא תוצאה של פירוק פורין (purine). ב-pH פיזיולוגי תקין של 7.4, חומצת שתן מופיעה בדם צורה מיוננת של אורט – גבישי סודיום, כלומר היונים טעונים שלילית והאנרגיה שלה גברית והיא די פראית. לאחר שהקשר החשמלי בין האלקטרון לבין הפרוטונים שבגרעין האטום פורקו. נושא זה דורש השקעה של אנרגיה גבוהה. אנרגיה זו מכונה "אנרגיית יינון". חילוף החומרים של פורין מתרחש בעיקר בכבד, אך ניתן לייצר אותו גם בכל רקמה אחרת המכילה קסנטין אוקסידאז (מולקולת הגנה מארח חשובה במעי [XO) שהוזכרה לעיל, xanthine oxidase intestines]. קסנטין אוקסידאז נקשר עם זיהומים ויצירה של ריכוזים גבוהים באופן מפתיע של חומצת שתן במודלים של זיהום והגברת רעלניות או ארסיות. XO מתבטא בתאי אפיתל של מערכת העיכול (GI) [מקור]. ערכים נמוכים בבדיקת דם של MCHC מכונים היפוכרומיה ונצפים בדרך כלל במצבים של אנמיה הנובעת ממחסור בברזל ובמחלת התלסמיה (מחלה תורשתית גנטיות של תאי הדם האדומים, אשר נובעות מפגם בשרשרות החלבון המרכיבות את ההמוגלובין.) ועלולים להצביע על פעילות יתר של קסנטין אוקסידאז כשאנו מזהים ערכים גבוהים של חומצת שתן. התבוננות בעמוד בדיקות הדם יכול לסייע בדיאגנוזה אם מדד זה שם נמוך הוא יעזור להבנת המצב וסיבת יתר UA בדם. אלא שאין בו די. בבואנו להחלים, לא למכור כדורים, יש לבדוק את מצבו של הסידן ואם הוא נמצא בטווח הנורמה לא כאן הבעיה למשל המקרה שהגיע לפתחי. הבעיה לא באנזים שבמעים או בחלבון המעבר במעי הדק העליון אלא במקום אחר – נמשיך.
כשני שליש מחומצת השתן מופרשת בכליות, ושליש מופרש לתוך המעי. בכליות היא מסוננת ומופרשת ו-90% ממנה נספג מחדש. ליונקים אחרים יש רמות חומצת שתן נמוכות יותר עקב פעילות האוריקאז, שהוזכר מעט למעלה. אנזים זה הופך את האוראט לצורה המסיסה יותר במים של אלנטואין. כך הוא מסולק בשתן [מקור], סילוקו חשוב ביותר לבריאות בעלי החיים. רמות גבוהות של אורט בסרום גורמות לגאוט נושא זה אינו ברור לגמרי אבל ללא ספק הוא קשור עם מחלות קרדיומטבוליות באמצעות מנגנונים שכאמור לעיל, הם לא מובנים ועם מהירות סילוק חומצת השתן.
הבנת המנגנונים של מחלות תורשתיות נפוצות הוכחה מזמן כנושא מרתק ומאתגר [מקור]. כשאנחנו מתבוננים במדדים גבוהים של חומצת שתן מיד עולה נושא זה של מחלה תורשתית – מאמר זה מתמקד במחלת הגאוט, דלקת המפרקים הדלקתית השכיחה ביותר מהזווית הגנטית או התורשתית [מקור].
גאוט נגרמת על ידי שקיעת גבישי סודיום – אורט (UA) בנוזל הסינוביאלי של המפרקים, תהליך שמוביל למפל של תגובות דלקתיות ולכאבים עזים
[מקור]. משקעים של גבישי סודיום UA מסיסיים מתרחשים כאשר רמות ה- UA גבישים של הסודיום בדם ובנוזלי גוף אחרים עולות, מצב זה מכונה היפר-אוריצמיה.
גאוט, או פודגרה, היא אחת ממחלות האדם המתועדות ביותר. המחלה הוכרה כבר בשנת 2460 לפני הספירה על ידי המצרים הקדמונים [מקור1, מקור2, מקור3, מקור4] אבל מעטים גם כיום יודעים להצביע על מנגנוניה. פרסמתי בנושא זה מאמר- כאן (על יתר חומצת שתן). וכאן – על הדרך להחלים מכשל בפרקים באופן פשוט וטבעי ללא תרופות – כאן. מה שאני מבקש להדגיש הפעם הוא שככל שרשימת העוסקים, חוקרים מטפלים ביתר חומצת השתן שגדלה וממשיכה לגדול, כך גם עולה הצורך בהבנה מעמיקה יותר שלה וככל שנדרשת הבנה, מבט על הדרך היעילה, הנדרשת לווסת את הומאוסטזיס של UA, גם מעט יותר ידע על הסיבות התמוהות לשיבושים בתהליכים אלה, נשארים כולם בחוסר אונים כמו תחת נקמה [מקור1, מקור2].
ברבות השנים הלכה ונוצרה תמונה מכניסטית של הגורמים הפועלים ומשפיעים על ההומאוסטזיס של UA, ובכל זאת חסרה לנו עדין הבנה כיצד מוסדרים חלבונים אלה או מרגיעים את תאבונם להרע. דרושים כלים חדשים כדי לבחון בעיה זו כדי לספק הקלה לסובלים מהמחלה שהרופאים קוראים לה: היפר-אוריצמיים [מקור]. בנוסף, ואני מתקרב לעיקרי הדברים נחשפה עבודה חדשה שחיזקה את חשיבותה של התצפית העתיקה שקושרת אותה בגבריות [מקור], המין הגברי הוא כך נראה מהמחקרים החדשים גורם סיכון משמעותי להיפראוריצמיה וגאוט [מקור1, מקור2], העובדות מעידות על כך שגברים נוטים להיפגע עד כדי פי ארבעה יותר מנשים [מקור].
הכליה הנשית מגינה על האדם
סביר להניח שהארכיטקטורה של הכליה הנשית שונה מזו של הכליה הגברית [מקור], בהינתן שלנשים יש לחץ דם נמוך יותר מגברים [מקור], לנשים יש סיכוי נמוך יותר לפתח פגיעה חריפה בכליות מאשר לגברים [מקור1, מקור2], לכליה של נשים סבילות טובה בהרבה לאיסכמיה כלייתית [מקור1, מקור2], ונשים מוגנות מפני מחלות כליות וקרדיווסקולריות לפני גיל המעבר בהשוואה לגברים [מקור1, מקור2]. מחקר שנערך לאחרונה קבע שלנשים עם מחלת כליות כרונית (CKD) הייתה ירידה איטית יותר בקצב הסינון הגלומרולרי (GFR), סיכון נמוך יותר להתקדמות למחלת כליות סופנית (end-stage renal disease (ERSD), וסיכון נמוך יותר למוות בהשוואה לגיל תואם. לאן שלא מסתכלים כליית האסטרוגן שורדת טוב יותר.
האם אלו ההורמוניים הנשיים, לדיוק יתר הורמון המין הנשי האסטרוגן הוא שמשפר ומגן על כלית האישה?
ולהרחיק אותה מפני החמרה בפתולוגיה [מקור]. האם לפיכך, להיות נקבה היא הזדמנות שעשויה להעניק לכליה השפעה מגוננת, ויותר מכך למנוע מנשים לפתח את הפנוטיפים החמורים יותר שנצפו בגברים בהקשר ליתר חומצת שתן, Uric acid או גאוט? יותר מכך
בתצפיות שנעשו בתחום המחקר נראה כי תפקוד הכליות הכולל הולך ומשתפר בקרב נשים בהשוואה לגברים, אבל רק עד לרגע שתפקוד ההורמונים הנשיים (אסטרוגן) מתחיל לרדת, כלומר כשהאסטרוגן מתדרדר כמו בתקופת המעבר של הנשים ובדומה לדלדול ההורמון הגברי (טסטוסטרון) בתקופת הגבורות הזכרית, הפתולוגיות הגבריות שנובעות ככל הנראה מהעדר אסטרוגן בגופם יכולות להופיע ורע מכך הן אז עלולות להיות קיצוניות יותר מאשר אצל גברים, בין היתר בשל העובדה שירידה זו לכאורה פוגעת ומקדמת את מחלת הגאוט גם אצלן. כאשר תפקוד הכליות יורד, רמות ה-SUA (חומצת השתן בסרום) נוטות לעלות, ודווח על ידי חוקרים בתחום בריאות צנרת הדם כי ככל שרמות UA עולות, כך עולה הסיכון לפתח מצבי תחלואה אחרים, כולל CKD, יתר לחץ דם וסוכרת [ מקור1, מקור2, מקור3, מקור4, מקור5], במיוחד אצל נשים, שסינטזה של הורמון האסטרוגן ירדה אצלן [מקור1, מקור2].
ככלל חומצת השתן HUA (hyperuricemia (HUA);) מגבירה את הסיכון לפתח מחלת כליות CKD עבור גברים ונשים כאחד, אולם סיכון זה גבוה בהרבה בקרב נHUA מאשר בזכרים HUA [מקור]. באופן דומה, השכיחות של CKD עולה פי שניים עד פי שישה בקרב נשים מבוגרות מגיל 55 HUA מאשר גברים HUA [מקור1, מקור2], מה שמוכיח שברגע שאיבדו את היתרון של יתר חומצת שתן בדם SUA (serum UA) נמוך, הסיכון אצלן גבוה יותר לבריאות הכליות. יתר חומצת שתן בהחלט מגבירה את הסיכון הכולל ליתר לחץ דם עבור שני המינים, אך שוב נשים עם HUA נוטות לפתח יתר לחץ דם מאשר גברים [ מקור1, מקור2 ,מקור3]. לבסוף, נשים סובלות יותר מסוכרת מסוג 2 בהשוואה לגברים [מקור], אולם הן HUA נוטות אף יותר לפתח סוכרת מגברים עם מדדי HUA גבוהים [ מקור], נמצא גם כי עלייה ב-SUA יכולה להזיק יותר לנשים מאשר לגברים. עם זאת, מכיוון ש-HUA היא רק אחת ממספר פתולוגיות שמשפיעות על אנשים מאוחר יותר בחיים, קשה להדגים את התפקיד של UA בביוגנזה של הפתולוגיה הבסיסית, מה שמוכיח את הצורך הקריטי במחקרים נוספים.
ראיות אלו שבות ומרמזות שגם המין הביולוגי וגם רמת ה-SUA משפיעות על בריאות הכליה, בכך שהאינטראקציה של שני משתנים אלו: מין וחןמצת השתן עשויה להשפיע על תפקוד הכליות. המין הנשי חייב איכשהו להשפיע על איזון רמות UA, מה שמוביל לירידה ב-SUA בהשוואה לגברים. פירוק המנגנון שמאחורי אפקט זה יכול להוביל להבנה טיפולית חדשה, ולשיפור הטיפול התרופתי ב-HUA אשר קשה להשתכנע שעד כה הצליח בבלימת מחלת הכליות. עם זאת, ברור שהדרך בה צעדנו עד כה בטיפול ב-UA בכליה הוא תהליך מסובך להפליא, שפרטיו טרם הובהרו במלואם ותוצאותיו לא מעודדות.
קסנטין אוקסידאז
טיפול ב-UA כלייתי כולל חלבוני טרנספורטר מרובים. UA היא הצורה הפרוטונית של חומצת שתן ונכנסת למחזור הדם כמטבוליט סופני של חילוף החומרים של פורין בבני אדם הדבר נוסה גםבקופי האדם הגדולים האחרים. הם מופקים מההתפרקותשל נוקלאוטידים מסוג פורין וחומצות אמינו, בתיווך קסנטין אוקסידאז. פרימטים מסדר גבוה איבדו את פעילות האנזים uricase, אשר גורם לחילוף חומרים נוסף של UA לאלנטואין והוא הרבה יותר מסיס מקור].
אובדן תפקוד גן האוריקאז בשושלת הקופים תומך ברעיון של יתרון סלקטיבי אפשרי של SUA מוגבר [מקור1, מקור2]. גם כאן מהדהד נושא מין החולה (נער, נערה, בחור, בחורה, גבר, אישה, זקן, זקנה). תורמת לתהליך מסובך זה העובדה שהריכוזים הפיזיולוגיים של UA גבוהים יותר אצל גברים (3.5 עד 7.2 מ"ג/ד"ל) מאשר בנשים לפני גיל המעבר (2.6 עד 6.0 מ"ג/ד"ל) [מקור אצל הנשים]. מעניין לציין כי הריכוזים בנשים לאחר גיל המעבר עולים לרמות שנצפו בגברים [מקור]. מכיוון ש-UA מסיס חלש, ריכוזים גבוהים (>6 מ"ג/ד"ל) יכולים להוביל למשקעים ולהיווצרות גבישים וכתוצאה מכך לאבנים בכליות של UA. גבישים אלה יכולים גם לשקוע בפרקים ולזרז במפרקים ובנוזל סינוביאלי הצטברות ולגרום לגאוט ובהמשך לכאבים [מקור]. קיים איזון עדין בין הפרשה לספיגה חוזרת של חומצת שתן בכליה. מתפקידו לשמור על הומאוסטזיס. שהרי חומצת השתן מסוננת בחופשיות בגלומרולוס הכלייתי, לאחר מכן ה-UA שב ונספג מחדש, הספיגה הראשונה, ומופרש שוב, הפעם באופן פעיל, ונספג שוב בצינורית הפרוקסימלית (הספיגה השנייה) [מקור1, מקור2, מקור3, מקור4, מקור5]
מספר חלבונים זוהו כמעבירי חומצת שתן UA התגליות הללו מבוססות בעיקר על מחקרים במבחנה המדגימים זיקה ל-UA. בהתבסס על ביטוי צינורית הכליה in vivo, ספיגה מחדש ראשונית של 95% מהיתר UA והמסונן הראשוני עשויה להתרחש באמצעות חלבונים ממשפחת האניונים אורגניים (OAT), כולל OAT1 (מקודד על ידי SLC22A6), OAT3 (מקודד SLC22A8), OAT4 (מקודד על ידי SLC22A11), ו-OAT10 (מקודד על ידי SLC22A13), כמו גם SLC2A9 (נקרא גם GLUT9) [ מקור1, מקור2, מקור3, מקור4, מקור]5]. כ-50% מהעומס הראשוני המסונן של חומצת השתן מופרש באופן פעיל בחזרה לתוך הלומן הצינורי, בעיקר במקום שבו ABCG2, NPT1 (מקודד על ידי SLC17A1) ו-NPT4 (מקודד SLC17A3) מככבים ובאים לידי ביטוי [מקור]. ספיגה מחדש של עוד 40% מה-UA המסונן מתרחשת במורד ההפרשה בקטע S3 של הצינורית הפרוקסימלית, שם דווח על ביטוי של URAT1 (מקודד על ידי SLC22A12) ו-SLC2A9 [מקור1, מקור2], וכתוצאה מכך הפרשה חלקית [הפרשה חלקית ללא שינוי של חומצת שתן (FEUA)] של 4%–8% מהעומס המסונן הראשוני. מנגנון מעט שנוי במחלוקת [מקור] ומסובך זה של סינון, ספיגה חוזרת, הפרשה וסבב שני של ספיגה חוזרת מדגים שהכליה מוציאה כמות מוגזמת של אנרגיה בדלקת הטרנספורטרים הללו במאמץ לווסת בקפידה את הפרשת UA מהכליה מסיבות שעדיין לא מובנות במלואן. נתונים פונקציונליים של טרנספורטרים אלה ואחרים [מקור1, מקור2, מקור3] מראים שחלבונים אלו יכולים להעביר UA. עם זאת, עדיין לא ברור האם הובלת חומצת השתן UA מתרחשת באבוביות הכליה על ידי הטרנספורטרים המסוימים הללו. נקווה שימצא מי שיחקור הפרעות גנטיות בטרנספורטרים אלה ויותר מכך שממצאיו יגיעו אל רפואת הממסד, כדי לקבוע אם השינויים הללו משפיעים על רמות SUA (חומצה אורית בסרום-בדם). לפיכך,
חקר הגנטיקה האנושית והווריאציות הגנטיות בצורה של מחקרי אסוציאציות של הגנום (GWAS) יכול להיות כלי רב עוצמה להבנת הגנים החשובים ביותר לטיפול ב-UA.
GWAS משתמש בפולימורפיזמים נפוצים של נוקלאוטידים בודדים (SNPs) הקיימים באוכלוסיה נתונה כסימנים למרחב גנומי שמתאם למצב נתון [מקור], כולל רמות SUA. לאחר זיהוי האזורים הגנומיים הללו, ניתן לבצע ניתוחים נוספים כדי לזהות את אותם גנים שסביר להניח שיהיו בבסיס ה-SNP ( נולימורפיזמים נפוצים של נוקלאוטידים בודדים) הקשור, ובמקרים מסוימים לזהות וריאנטים סיבתיים חדשים התורמים להתפתחות HUA מדדים גבוהים של חומצת שתן. לסיכום אנו עומדים נבוכים מול מחלה מעוררת כאב ונזק לכליות שרב בה הנסתר על הגלוי. בחלקה בוודאות פגם בגן הקשור להובלת חומצת שתן ואין לנו ידע מספיק עליו ועל הדרך לטפל בו.
האיזון בין ספיגה חוזרת להפרשה קובע את רמת האוראט (חומצת השתן) בגוף. גם ההפרשה וגם הספיגה החוזרת של חומצת השתן (UA) מסתמכות על טרנספורטרים – חלבוני מעבר. עם התפתחות הביולוגיה המולקולרית והגנטיקה, התגלו מעבירי אורט חדשים שונים, והושגה הבנה עמוקה יותר של דינמיקת אורט.
[מקור] מבין מעבירי חומצת השתן הרבים, קלטת קושרת ATP תת-משפחת G member 2 (ABCG2) בה ידובר בהמשך מעוררת עניין מיוחד. זהו טרנספורטר בעל קיבולת גבוהה הממוקם בעיקר בקצה גבול המברשת של צינוריות הכליה הפרוקסימליות וחיוני ביותר להפרשת האוראט [מקור]. הוכח כי פולימורפיזם חד-נוקלאוטידי (SNP) ב-ABCG2 (rs2231142; Q141K) קשור לריכוזי אוראט וגאוט אצל אנשים [מקור]. Matsuo et al. [מקור1, מקור2, מקור3] השוו חולי גאוט ואנשים בריאים ביפן ומצאו שני אללים של ABCG2, Q141K (50% שאריות תפקודיות) ו-Q126X (ללא תפקוד),כאשר
76.2% מהאנשים שסבלו מגאוט נמצאו על-ידם כמי שסובלים מתפקוד לקוי של ABCG2,
והפרעה בתפקוד ABCG2 הגדילה באופן משמעותי את הסיכון להופעת הגאוט מוקדם (RR = 22.2).בין 10 SNPs הקשורים מאוד לריכוזי אורט בסרום, Zaidi et al. מצא שהאלל ABCG2 rs2231142 T משתקף כמי שמאוד קשור למחלת גאוט מוקדמת [מקור].
גנטיקה של היפראוריצמיה
גנטיקה נקשרת עם רמות גבוהות של חומצת שתן בדם SUA. המרכיב תורשתי חזק, מוערך בין 40%-70% [מקור1, מקור2, מקור3].
הגן הראשון הקשור להובלת UA בבני אדם היה SLC22A12 [מקור]. גישת שיבוט השוואתית עתירת עבודה ומבוססת מועמדים זיהתה את המיקום של SLC22A12 כאפשר להכיל את גן המפתח. תוצר החלבון שהתקבל, URAT1, הוכח כמעביר UA ספציפי לכליה, וגרסאות נמצאו במשפחה יפנית עם היפואוריצמיה משמעותית [מקור]. גרסאות SLC22A12 הגורמות להיפו-אוריצמיה דווחו בתדירות גבוהה באוכלוסיות יפניות [מקור], קוריאניות [מקור] ורומא אירופאיות [מקור], מה שמחזק את החשיבות של תפקוד URAT1 ברמות SUA. הבדלים בין המינים, לעומת זאת, לא דווחו בתחום SLC22A12 הגורם להופעת היתר של חומצת השתן בהקשר של היפואוריצמיה. עבודה שלאחר מכן הוכיחה כי חברים אחרים במשפחת הגנים SLC22A (ה-OATs) הם בעלי הזיקה ל-UA [מקור1, מקור2, מקור3], אך בסופו של דבר התברר שהיה קשה לבסס את הרלוונטיות הפיזיולוגית שלהם [מקור]. התקדמות הושגה רק בזיהוי גנים מרכזיים אחרים הקשורים ל-UA עם הופעת ה-GWAS, מה שמאפשר לחוקרים להשתמש בגישה חסרת פניות כדי לגלות גנים ומוצרי גנים המעורבים בפנוטיפים ספציפיים כמו רמות SUA יתר חומצה אורית בסרום או סיכון לחלות בגאוט [מקור1, מקור2, מקור3,מקור4]. בגלל קלות המדידה והזמינות של דגימות נסיוב מקבוצות גדולות של פרטים, GWAS שמשפיעים על מדדי ה-SUA מילאו תפקיד בלהט המחקרי למצוא רשתות גנים או אפילו גנים טרנספורטרים ספציפיים הממלאים תפקיד משמעותי בהומאוסטזיס של UA בבני אדם [ מקור1, מקור2, מקור3]. ה-GWAS שפורסם ב-UA בעשור האחרון [מקור1, מקור2, מקור3, מקור4, מקור5, מקור6, מקור7, מקור8, מקור9]. הגדילו בהדרגה את הרזולוציה הגנומית על ידי הגדלת מספר הפרטים בשימוש, ולכן גנים עם תרומות קטנות יותר ויותר לפנוטיפ SUA הצליחו להיפתר. מאמץ אחרון, הגדול ביותר עד כה, שבוצע על ידי Tin et al. [מקור], שחקרו וריאנטים ב-457,690 אנשים מרקע אתני שונה ומצאו 147 SNPs חדשים ושכפלו 36 SNPs שדווחו בעבר אשר קשורים ל-SUA, שכולם שוכפלו עוד יותר בקבוצה עצמאית של 334,880 פרטים. כחלק מהניתוח שלהם, Tin et al. ניסו גם לזהות גרסאות נפוצות שגורמות לשינויים ברמות UA. הושם דגש על גרסאות מיסנס עם ציון Phred הדלדול המשולב המשמעותי ביותר תלוי ביאור, חושף שש גרסאות סיבתיות פוטנציאליות. וריאנטים סיבתיים פוטנציאליים אלה כללו SNPs בגן הטרנספורטר המבוסס UA ABCG2 [מקור],כמו גם בגנים של גורם שעתוק HNF1A ו HNF4A [מקור]. החוקרים הדגימו את האופי הסיבתי של הגרסה של HNF4A על ידי כך שהיא שינתה את היכולת של מוצר החלבון שלה HNF4α לווסת ישירות את הטרנס-אקטיבציה של ABCG2 [מקור]. גרסאות של ABCG2 ו SLC2A9 הוכחו כמפעילות הבדלים בין המינים בגודל האפקט של המחלה (יתר חומצת שתן בדם), אך לא SLC22A12. נושא זה עשוי לדבר על אחת המגבלות של GWAS, כך שמחקרים אלה יכולים להשתמש רק בגרסאות נפוצות הקיימות בתדרים גבוהים מספיק כדי להיות מזוהים, מה שמותיר גרסאות נדירות אך פוטנציאליות קשורות וסיבתיות להישאר בלתי מזוהות במחקרים אלה. כדי להתמודד עם זה, עבודה אחרונה שהשתמשה ברצף אקסום שלם (WES) כדי לחפש גרסאות נדירות התורמות לשונות של מדדי ה-SUA מצאה גרסאות נדירות רבות כולל שתיים בגן SLC22A12 (rs150255373 המקודד R325W ו-rs147647315 קידוד בגודל R4334H) מקור]. ייתכן שהיעדר גרסאות נפוצות ב] –SLC22A12 תרם לתת-דיווח שלהם על השפעות המין. בנוסף,
ביטוי SLC22A12 נמצא גבוה יותר אצל גברים מעל גיל 50 בהשוואה לנשים בגיל דומה, אך הביטוי SLC22A12 היה הגבוה ביותר בנשים מתחת לגיל 50, כפי שדווח במחקר קטן יותר ממוקד טרנספורטר
[מקור].
ביטוי מוגבר של SLC22A12 יכול להצביע על עלייה בספיגה חוזרת של UA, ובכל זאת לנשים מתחת לגיל 50 יש כמה מהרמות הנמוכות ביותר של חומצה אורית בסרום – SUA מכל האוכלוסיות שנדגמו, מה נושא ששב ומרמז שייתכן שהספיגה מחדש של UA על ידי URAT1 אינה התורם העיקרי ל-SUA אצל נשים. סבירות רבה יותר שהתרומה העיקרית הזו נובעת משינויים מתנשאים בטרנספורטרים אחרים של UA.
SLC2A9 הספיגה מחדש
הגן ליתר חומצת שתן בדם – (SLC2A9) והגן לסיכון לחלות בגאוט (ABCG2) בילדים ומבוגרים כאחד, תלוי מין. כלומר הסכנה להופעתם גדולה בקרב הגברים
SLC2A9 הוא טרנספורטר מוביל, משאית, טנדר… של Uric Acid ובעל הזיקה הגבוהה, אחד משני טרנספורטרים שאחראים בעיקר לספיגה מחדש של UA [מקור1, מקור2, מקור3].
לא במקרה, שני גרסאות הגנים עם ההבדלים הגדולים ביותר באפקט הספציפי שנקשר למין החולה הם גם השניים עם הווריאנטים הנפוצים שניכרים כתורמים הכי הרבה לעליה במדדי חומצת השתן SUA (SLC2A9) ולסיכון לחלות בגאוט (ABCG2) הן למבוגרים [מקור] והן להופעת ילדים [מקור]. SLC2A9 הוא טרנספורטר UA בעל זיקה גבוהה ואחד משני טרנספורטרים שאחראים בעיקר לספיגה מחדש של חומצת השתן UA [מקור1, מקור2, מקור3].
מחקר שנערך לאחרונה ב-WES חשף עשרות גרסאות של ב-SLC2A9, כולל 90 גרסאות נדירות שלו הקשורות ל-SUA, ומספר נוסף של גרסאות נפוצות הממפות אזורים תפקודיים חשובים של החלבון [מקור]. מעניין לציין ש-SNPs (Single Nucleotide Polymorphism וריאציה של רצף הדנ"א המתרחשת כאשר נוקלאוטיד יחיד A, T, C, G בגנום נבדל בין פרטים במינים ביולוגים או בין כרומוזומים הומולוגים באדם.) של SLC2A9 קשורים הן לירידה ב-SUA [מקור1, מקור2, מקור3, מקור4] והן ב-SUA מוגברת בדם [מקור], תלוי ב-SNP. מבין הוריאציות שנמצאו ל –SLC2A9 (SNPs) שזוהו ושקשורות בירידה בחומצת השתן בסרום —SUA, הירידה הזו הייתה גדולה בהרבה בנשים מאשר בגברים (rs7442295 הניב -0.503 מ"ג/ד"ל בנשים, בעוד שרק -0.202 מ"ג/ד"ל אצל גברים), עם מרכיב תורשתי גבוה יותר אצל נשים מאשר אצל גברים באוכלוסיות אירופיות [מקור]. תוצאות אלו אוששו עוד במחקר מקרה-ביקורת, שבו וריאציה של אובדן תפקוד חלקי של SLC2A9 תרם להורדת רמות UA בין 0.30–0.35 מ"ג/ד"ל או 5%–6% מכלל האוכלוסיות שנדגמו, עם היבט חזק אל המין הנשי [מקור]. תוצאות אלו תומכות בממצאים וברעיון שספיגה מחדש בתיווך SLC2A9 היא מנגנון חשוב של ויסות SUA אצל נשים.
ABCG2 בכליות, בכבד ובמעי הדק, מושפע מהאסטרוגן
ABCG2, הטרנספורטר העיקרי השני, מעביר חומצה אורית UA אל מחוץ לתא [מקור], ומתבטא בכליות, בכבד ובמעי הדק [מקור], כמו גם במחסומי הדם-מוח והדם-שליה, ובתאי אפיתל החלב [מקור]. משמש בתהליכי הפרשת האוראט דרך מסלול הפוספיניצין 3-קינאז PI3K/Akt, ומי שהפך [Akt או פרוטאין קינאז B (PKB)] לאטרקטיבי מאוד בתחום חקר הסרטן כיום. יאמר כי ה –ABCG2 התגלה במקור בקו תאי הסרטן [מקור1, מקור2]. עד מהרה נחשף כי בכוכו של ABCG2 להפעיל אפקט אנטי-היפר-אוריצמי ntihyperuricemic effect [מקור]. הוא מתבטא באבובית הפרוקסימלית הכלייתית הן בבני אדם והן בחיות מעבדה כעכברים [מקור] שם הוא ממלא תפקיד חשוב בהפרשת חומצת שתן UA [מקור] מספר גרסאות ב-ABCG2 נקשרו למחלה בה רמות SUA. rs2231142 היא גרסה בולטת ומקודדת מוטציה שמכונ –missense Q141K. מוטציית Q141K מזוהה כאחד מגורמי הגאוט ב-ABCG2. אופיו של הפגם ב-Q141K נותר אמנם בלתי מוגדר אך ניכר כמוביל לאי יציבות של תחום קושר הנוקלאוטידים וניתנת לתיקון באמצעות מולקולות קטנות [מקור]. אלל סיכון זה נפוץ בקרב מספר אוכלוסיות החל מ-3% באוכלוסיות ממוצא אפריקאי, 11% באלו ממוצא אירופי ועד 31% באוכלוסיות מזרח אסיה [מקור]. וריאנט ה-Q141K מקנה אובדן חלקי של תפקוד, המאופיין באובדן פעילות טרנספורטר (ABC) ויציבות מופחתת של תחום קושר הנוקלאוטידים ה-N-טרמינלי, המובילים לירידה בשפע החלבון על פני התא באמצעות פירוק מוגבר אנדופלזמי-רטיקולום [מקור]. עם זאת, בבני אדם, החזקת וריאנט Q141K לא תורגם לשינויים המשמעותיים החזויים בהפרשה חלקית של חומצת שתן-FEU [מקור1, מקור2, מקור3, מקור4].
ABCG2 משחק תפקיד בהפרשת אורט בכליות ובמעיים של האדם [מקור], מחקר שנערך לאחרונה ניסה להבין טוב יותר את התפקיד של ABCG2 בכליה ואת ההשפעה של וריאנט Q141K על תפקוד הכליות באוכלוסייה צעירה רגילה יחסית [מקור]. המשתתפים אותגרו עם אינוזין דרך הפה כדי להעלות בצורה חריפה את רמות SUA. אינוזין מביא לעליה ברמות חומצה אורית בדם. משתמשים בה כתרופה לחולי פרקינסון. העלאת ריכוז חומצה אורית מאפשרת להאט את התקדמות מחלת הפרקינסון [מקור]. למשתתפים עם וריאנט Q141K שנטלו אינוזין היו רמות SUA גבוהות יותר באופן מובהק, אך השוואה של ההפרשה החלקית של חומצת שתן-FEU בין הגנוטיפים לא גילתה שום הבדלים. ממצאים אלו מצביעים על כך ששינויים ב-FEU לא תרמו באופן משמעותי לעלייה ב-SUA [מקור] בבעלי המותציה Q141K. במקום זאת, נשאי ה-Q141K איבדו חלק ניכר מהתרומה החוץ-כלייתית להבדלי מדדי SUA, מה שמרמז על תפקיד חזק של ABCG2 בהפרשת UA במעיים, אך למרבה הצער לא הבהיר את תפקידו, אם בכלל, של ABCG2 בכליה. מעניין לציין שאותו מחקר בדק נשאי אללים שאינם בסיכון מרובדים לפי מין ומצא שלנשים יש SUA נמוך יותר בתגובה לאינוזין, עם הפרשה חלקית ללא שינוי של חומצת שתן (FEUA), גבוה יותר והפרשת UA גבוהה יותר בשתן (שם). נתונים אלה מרמזים שהכליה הנשית הגיבה אחרת לעומס UA הגבוה יותר, אך גם פיצה טוב יותר על עומס UA גבוה יותר זה על ידי הגברת ההפרשה.
Estrogen אסטרוגן
לפני יותר מ-40 שנה, נמצא (Sumino et al) כי אסטרוגן יכול לקדם את הפרשת השתן ולהפחית את הופעת היפר-אוריצמיה יתר חומצת שתן בדם. החוקרים גילו כי עלייה ברמות האוראט הייתה קשורה קשר הדוק להפחתת רמות האסטרוגן. ולהפך עליה באסטרוגן מורידה את חומצת השתן בגוף האדם [מקור1, מקור2, מקור3]
האסטרוגן הוא הורמון ושליח ששט בזרם הדם. הוא שם כולל לקבוצה בת שלושה הורמונים: אסטרון, אסטרדיול ואסטריול [מקור]. אחד החומרים הטבעיים הנוצרים ומופרשים באיברי הגוף מבלוטות ומעניקים לאישה לחוש חושנית, הוא משפיע על ברק העור, לחות העיניים, מלאות החזה ומעניק בהירות מחשבתית. הוא שומר על לחות הנרתיק, מרומם ומייצב את מצב הרוח. גם משפיע על המוח ועל העצמות. יחד עם זאת אסטרוגן מצוי בגופו של כל אחד מאתנו – גברים ונשים כאחד, בשני המינים הוא מסייע ל לשריפת שומן, לבריאות הלב וכלי הדם (ולכן העלייה בשכיחות מחלות אלו בנשים לאחר תקופת המעבר בקרב נשים ממש כמו נושא חומצת השתן) [מקור]. בקרב הנשים, האסטרוגן נוצר לאורך שנות הפוריות בשחלות. עם חדלון הווסת והפסקת הפעילות השחלתית, האסטרוגן נוצר ברקמת השומן ובבלוטת יותרת הכליה.
כימיקלים במבנה דומה לאסטרוגן או אסטרוגן סינתטי, נכללים בתרופות המיועדות לבני אדם כולל למען הפחתה של חומצה אורית. על הסכנות שבשימוש בסוגים מסוימים של הורמונים חלופיים, או סינתטיים שניתנים לנשים בתקופה זו בחייהן, גלולות חלופיות של פיטו אסטרוגן מרוכז לכאורה הן מהוות מעין תחליף טבעי להורמונים חלופיים רפואיים זועקות כותרות בעתונות הנשית. אך מחקר שנערך לאורך מספר שנים גילה ששימוש בהן העלה את הסיכון לחלות בסרטן [מקור]. נראה שעדיף לקבל את האסטרוגן הצמחי בריכוז הטבעי שלו על ידי שילוב מוצרי סויה בתפריט בקביעות, ורצוי להימנע מנטילת גלולות מרוכזות, גם אם הן נמכרות ע"י לובשי חלוק לבן. הסויה עשירה בפיטו אסטרוגנים [מקור], כלומר אסטרוגנים (בדומה להורמון נשי) ממקור צמחי [מקור1, מקור2, מקור3]. פיטואסטרוגנים הם תרכובות שמקורן בצמחים המצויים במגוון רחב של מזונות, בעיקר סויה [מקור1, מקור2]. שורה של יתרונות בריאותיים, כולל פעולות מניעה או טיפוליות בקרצינוגנזה, טרשת עורקים ואוסטיאופורוזיס, מחלות לב, סרטן שד, תסמיני גיל המעבר, ובלימת העליה של חומצת השתן UA [מקור1, מקור2, מקור3, מקור4, מקור5]. מיוחסים לעתים קרובות לפיטואסטרוגנים.
פיטו-אסטרוגנים הן מולקולות בעלות מבנה מרחבי הדומה לאסטרוגן, הורמון המין הנשי.
ברקמות מסויימות הם מתנהגים כאסטרוגן (מכיוון שהם דומים לו והגוף חושב שהם בעצם אסטרוגן) וברקמות אחרות הם מתנהגים כמתנגדים לאסטרוגן (מכיוון שהם דומים לו, הם גם מתחרים באסטרוגן האמיתי. התחרות היא על הרצפטורים (הקולטנים) שבתאים ולעיתים הם נקשרים לרצפטור וחוסמים אותו במקום להפעיל אותו) [מקור]. סויה היא אחד המקורות העשירים ביותר בפיטו-אסטרוגנים (בשפת המדע הם נקראים איזופלאבונים isoflavones) [מקור]. בעקבות שורה של מחקרים, התברר שצריכה של סויה מיטיבה עם בריאות האדם כולל במניעה לחלות בסרטן השד. מחקר שנעשה במחלקה למדעי התזונה של אוניברסיטת אילינוי בארה"ב ופורסם בחודש מרץ 2015 , בדקה את ההשפעה של מוצר סויה לעומת תוסף של פיטו-אסטרוגנים [מקור].
האסטרוגן הצמחי נכנס לזרם הדם וממלא את מקומו של האסטרוגן החסר, אם כי ברמת פעילות נמוכה יותר. ככלל ההורמונים משתחררים למחזור הדם ומשם מגיעים אל רקמות הגוף השונות שם הם מתפקדים כשליחים, כלומר – הם פועלים כמעבירי הודעות, למשל לגנים שמעבירים חומצת שתן במעי או בכליות להמשיך את עבודתם התקינה. הודעות אלו, הן בעצם הוראות ההפעלה של מרחבים, קטעים אברים, מולקולות, חלבונים, בגוף האדם.
.חוקרים בדקו גם את ההשפעה של מוצרי הסויה השונים על ביטוי של גנים. אנו יודעים שיש גנים שנלחמים במחלה ויש גנים שמעודדים את שגשוג של החולי. הנושא הזה נחקר תחילה עם אסטרוגן ומחלת השד. בהמשך התעוררו חששות שישנם מקרים שהסויה מזיקה, אלה מבוססים בעיקר על מחקרים בבעלי חיים, בעוד שהמחקר האנושי (שחקר את ההשפעות הבריאותיות של מזונות סויה בקפדנות במשך יותר מ-25 שנים [מקור]) שינה את התמונה והוא בהחלט תומך בבטיחות וביתרונות של מזונות סויה כתרופה. נמצא כך גם שסויה שעשירה בפיטו-אסטרוגנים (איזופלאבונים) מקלה על גלי חום, תפקודה של בלוטת התריס, ועשויה להשפיע לטובה על תפקוד הכליות [מקור1, מקור2, מקור3]
חומצת השתן והורמוני המין הנשי הועמדו גם הם למבחן בפני החוקרים – הם ביקשו לחקור את התפקיד האפשרי של הורמוני המין: אסטרון, אסטרדיול ואסטריול (האסטרוגנים) בוויסות מעבירי חומצת השתן Uric Acid ובאופן כללי את נושא רמות היתר של Uric Acid בדם.
מחקר מוקדם בדק את ההשפעות של מתן פומי, אוראלי של הורמוני מין סינתטיים על נשים וגברים כאחד [מקור]. המחקר הדגים קשר הפוך בין SUA לבין אסטרוגן אקסוגני שניטל (שבא מבחוץ, כלומר כתרופה), כמו גם עלייה ב-UA חומצת שתן בשתן [מקור], כלומר ככל שנכנס יותר אסטרוגן ירדה חומצת השתן בשתן. תופעות דומות נצפו כאשר נשים לאחר גיל המעבר קיבלו פרוגסטרון. הפרוגסטרון מופרש מהשחלה, גם ובמידה קטנה יותר מבלוטת יותרת הכליה, מן השליה, ובגברים מן האשכים. מחקרים נוספים הדגימו שינויים ב-SUA במהלך הביוץ בנשים לפני גיל המעבר [מקור], כאשר רמות שיא של SUA מתרחשות בשלב הפוליקולרי [מקור] כאשר רמות האסטרוגן הן הנמוכות ביותר. יתר על כן, SUA נמצא בקורלציה חיובית עם הורמון מגרה זקיק וקשור הפוך לאסטרדיול ופרוגסטרון [מקור]. מחקר אחר בדק את ההשפעות של טיפול הורמונלי על משתתפים טרנססקסואלים, והראה ירידה ב-SUA בקרב משתתפי גבריים לנשים (MTF – Male-to-Female), ועלייה ב-SUA בקרב משתתפי נשים לזכרים (FTM – Female-to-Male) לאחר שנה אחת של חוצי מין, ומתן הורמונים. יתר על כן, ה-הפרשת חומצת השתן בחלקה (Fractional Excretion of Urate) הבסיסי נמצאה במחקר זה גבוהה יותר בנבדקי FTM וירדה באופן משמעותי לאחר אובדן האסטרוגן, בעוד שנבדקי MTF הראו עלייה ב-FEA עם תוספת אסטרוגן [מקור]. במחקר שנעשה בחיות מעבדה על השפעת הורדת האוראט (חומצת השתן) על ידי הורמון נשי: אסטרדיול – אסטראדיול הוא ההורמון החשוב ביותר בקבוצת ההורמונים האסטרוגניים, ההורמון הזה מצוי גם אצל הגבר, אך בכמויות קטנות, במעקב אחר השינויים בביטוי ABCG2 שמעביר חומצת שתן בכליות ובמעיים. נחקר המסלול המולקולרי שבאמצעותו ההורמון הנשי – אסטרדיול מווסת את ביטוי ABCG2 בתאי מעיים [מקור]. נמצא כי רמת האסטרדיול בקרב חולי היפר-אוריצמיה/גאוט הייתה נמוכה משמעותית מזו של קבוצת ביקורת הבריאים. מתן אסטרדיול בנזואט (EB) הן לעכברים היפר-אוריצמיים זכרים והן לעכברים נקבות לאחר הסרת השחלות שבה ואישרה את השפעות המבורכות של הורדת האוראט על-ידי האסטרדיול, והיפר-אוריצמיה ואסטרדיול העלו את הביטוי של ABCG2 במעי. אסטרדיול אושר בהמשך כמקדם הובלת אורט על ידי הגברת חלבון ההובלה ABCG2 במודלים של הפרשת אורט במעי in vivo ו-in vitro. אסטרדיול מווסת את הביטוי של ABCG2 במעי דרך מסלול PI3K/Akt וכךהוא מביא לירידה של רמות האוראט בסרום [מקור1, מקור2]מחקרים אלו מספקים עדויות חזקות לתפקידם של הורמוני המין הנשיים בוויסות ה-FEU, אשר יכול לתרום רבות ל-SUA. לבסוף, כאשר רמות הורמוני המין הנשיים יורדות לאחר גיל המעבר, ה-SUA עולה, אך ניתן למתן עלייה זו ב-SUA על ידי טיפול הורמונלי חלופי [מקור]. עדות זו מחזקת עוד יותר שייתכן שהורמוני המין הנשיים מסדירים את מכונות הטיפול ב-UA, ברמת התמלול או הפוסט-תעתוק. האסטרוגן שב והוכח כמפחית וויסות של SLC2A9 ברמה שלאחר התעתוק באמצעות הפעלה פרוטאזומלית המושרה על ידי אסטרוגןER-β [מקור]. מחקר אחר עבד על מודל אחר והפעם במעבדה על עכבר העלו את מדד חומצת השתן בדם HUA על ידי החדרה פולשנית אל גופו של וריאנט ABCG2 אנושי (Q140K; אורתולוגי ל-Q141K האנושי שהוזכר למעלה ונמצא מעלה מדדי יוריק אסיד בדם), הזרקת ABCG2 במקרה זה חשפה שהיא לא רק משחזרת במדויק פגמים בהובלת UA בכליות ובמעיים שנצפו בבני אדם בעלי וריאנט Q141K, אלא גם גורמת להבדלים עמוקים בין המינים: זכר ונקבה.
נמצא כך של ABCG2 תפקיד משמעותי בהפרשת UA בכליות ובהשפעות המזיקות של וריאנט Q140K. המודל הוכיח ש-ABCG2 הוא מעביר ההפרשה המרכזי בכליות ובמעי הדק, עם זאת, בעוד ש-Q140K היה מזיק ביותר במעיים, למרבה ההפתעה הייתה לו השפעה קטנה על תפקוד ABCG2 בכליה. סתירה זו בפנוטיפים מסבירה מדוע בני אדם עם וריאנט Q141K נמצאים בסיכון גבוה ל-HUA: לחלבון המוטנטי יש השפעה מועטה על תפקוד הטרנספורטר בכליה, ולכן ההבדלים ב-FEU שנצפו קטנים או נעדרים, אולם וריאנט Q141K מייצר מניעה רצינית של הפרשת UA במעיים, מה שגורם לעלייה בסרום של חומצת השתן -SUA [מקור].
ממצא מדהים שני ממודל העכברים ABCG2-Q140K היה שעכברי הנקבות Q140K לא הראו שום פנוטיפים (מקור). לעכברי ה-Q140K הנקבות היו SUA, FEUA, ואפילו שפע חלבון ABCG2 כליות ללא שינוי [מקור], גילוי זה מרמז על כך שעכברים אלו מייצגים היטב את ההבדלים בין המינים שנצפו בבני אדם בהקשורי יתר חומצת שתן ל-HUA, ולכן הם יכולים להתגלות כמודל שימושי בנתיים או עד כה. ההבדלים בין המינים הללו עשויים לנבוע, לפחות בחלקם, מהעובדה שניתן לווסת ABCG2 על ידי אסטרוגן [מקור1, מקור2, מקור3], כפי שהשערה בבני אדם.
מכיוון שעלייה ב-SUA קשורה למספר עצום של פתולוגיות אחרות, כולל CKD, יתר לחץ דם וסוכרת, קשה לקבוע איזו סיבתית ומהי התחלואה הנלווית.
סיכום
הורמוני המין הנשיים, במיוחד אסטרוגן, עשויים למלא תפקיד בוויסות הביטוי או הפעילות של מעבירי UA, במיוחד ABCG2 ו- SLC2A9. נושא זה בולט נוכח העובדות שהוזכרו למעלה כי בקרב נשים נמצאו הבדלים בביטוי, או בפעילות של הובלת חומצת השתן UA טרנספורטר בכליות. אסטרוגן יכול לתווך וויסות שעתוק ישיר של הגנים הטרנספורטרים, או להפעיל גורמי שעתוק ספציפיים לטרנספורטר, כולל HNF4α. הבדלים הניתנים לצפייה באופן מווסתים של תעתוק טרנספורטר ושינוי שלאחר התרגום בין המינים עשויים לחשוף מידע משמעותי על מסלולים רגולטוריים אלה ולספק מטרות לטיפול באסטרוגן כתרופה. לפיכך, שימוש במין כמשתנה ביולוגי עשוי לספק תובנות מפתח בהבנת הטיפול ב-UA, הבהרת מנגנוני הרגולציה הפיזיולוגיים הבסיסיים והדגשת צורך קריטי במחקרים עתידיים. הבעיה מחריפה כשמדובר בנערים מתבגרים – האם מורשים אנו לתת אסטרוגן לנער כזה?
האין עלינו חובה מוסרית לחפש דרכי טיפול יותר אחראיות ומגוננות על חיי הבחורים שלקו בגאוט ואין ספק שתורשה עומדת מאחרי הקלעים של מדדי החומצת שתן המאיימים על כליותיהם ובשל הטיפול לכאורה באסטרוגן גם על התפתחות נפשם?
מסקנה
טיפול מפחית חומצה אורית בדם לנערים שטרם מלאו להם 18 שנים מחייב תפריט תזוני מאוזן ונטול אסטרוגן.
אני משתמש בתפריט כזה בו הפתיח כולל כותרת על וכותרת משנה – להלן,.
תפריט תזונה מחלים גאוט – להפחתה של חומצה אורית בדם
מלח, 3 תפוחי אדמה חיים, צ'מפה, שמן זרעי חרדל (7 כפיות), 26 גרם סויה מותססת (נאטו, טמפה), כורכום (5 כפיות) ואגוז ביבהיטקי 1000מ"ג [מקור1, מקור2, מקור3, מקור4], שנראים בצילום למעלה, קמח קליפת רימונים PPF תוצרת בית – כאן (4 כפיות), פסילוים 3 כפות, כוסית מי שיבולת שועל מותססת. אין להשתמש בקטניות כמנת חלבון
המשך עמוד התפריט מחולק לפי ארוחות והמפרט בו תלוי מדדי בדיקות המעבדה.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
מאמרים אחרונים
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות – פרק א'
- אכל נקי
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- מזון כתרופה
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- תזונה תאית
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- להתסיס שיבולת שועל – מתכון וכל הסודות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- תרופה ישראלית חדשה לקורונה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – על השעורה (דגן) ופעולות נוגדות דלקת כולל עיכוב גורם נמק גידול אלפא – Tumor necrosis factor alpha (TNF-α).
- על הנקמה ודמימותיה
- גודש נוזלים בריאות – בקרב חולי כליה
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
- קטואנאלוג ketoanalogue
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- גלוטתיון כל האמת
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- לראשונה, מדענים הצליחו לתרגם לטקסט את הפעילות המוחית של אדם עם שיתוק שאינו מסוגל לדבר.
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- מחסור בברזל
- מה הם בקע (קִילֶה) חתך, מדוע הם מתרחשים ומה לעשות?
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- מחסור בברזל

Whats Going down i am new to this, I stumbled upon this I have discovered It absolutely helpful and it has helped me out loads. I am hoping to contribute & help different customers like its aided me. Good job.