
גלוטמין (Gln) היא חומצת האמינו החופשית הנפוצה ביותר בגוף האדם [מקור], ואחד המרכיבים השופעים והחשובים ביותר של החלבונים [מקור]. גלוטמין מיוצר בשרירים ומופץ מהם על ידי הדם לאיברים הזקוקים לו. הוא יכול להגיע גם מתזונה. הגלוטמין עשוי לסייע לתפקוד המעיים, למערכת החיסון ולתהליכים חיוניים אחרים בגוף, במיוחד בעת לחץ. זמן בו יש לספק לגוף גם "דלק" (חנקן ופחמן) כדי לאפשר לתאים רבים ושונים בגוף לתפקד בעיקר לאחר מצבי סטרס בשל פגיעה גופנית או טיפול פולשני. כך למשל, לאחר ניתוח או פציעה טראומטית, יש צורך בחנקן כדי לתקן את הפצעים ולשמור על תפקוד האיברים החיוניים. כשליש מהחנקן הזה מגיע מגלוטמין. ברפואת הממסד הוא חדר כתוסף תזונה/תרופה. כיום גלוטמין היא תרופת מרשם המאושרת על ידי ה- FDA נמצא שכאשר הגלוטמין נלקח דרך הפה כתרופה, קפסולה או כדור, הגלוטמין בטוח עבור רוב המבוגרים כאשר הוא נלקח בפה במינונים של עד 40 גרם ביום. ההמלצה שלי ליטול אותו ממזון כתרופה: שעורה, שיבולת שועל, נאטו או טאמפה, אספרגוס, תרד וסלט כרוב אדום.
"על ידי מיקוד מטבוליזם של גלוטמין, לא רק שהצלחנו לעכב את גידול הסרטן ולשנות את סביבת המיקרו -שלו, אלא גם לשנות את תאי T כך ששיפרנו באופן ניכר את האימונותרפיה לסרטן", תוספי הגלוטמין – מאטים את צמיחת הגידול ומחזקים את התגובה האנטי-סרטנית.
אומר ג'ונתן פאוול, Jonathan Powell דוקטור, מנהל שותף במכון בלומברג ~ קימל לאימונותרפיה של הסרטן במרכז לסרטן ג'ונס הופקינס [מקור1, מקור2].
הגלוטמין מסתובב באופן חופשי בגוף ומאוחסן בשרירים, אבל גם בריאות ובמוח.
הגלוטמין חיוני למטבוליזם ולתפקוד המוח. הוא חוצה בקלות את מחסום הדם-מוח שבו הוא הופך לחומצה L-גלוטמית. והחומצה הגלוטמית חיונית לתפקוד המוח [מקור1, מקור2]. שם הגלוטמין משתתף במגוון מסלולים מטבוליים. תפקידו העיקרי במוח הוא תפקיד מבשר של חומצות האמינו המוליכות הנוירו: חומצות האמינו המעוררות, גלוטמט (Glu) ואספרטט (Asp), וחומצת האמינו המעכבת, חומצת בוטרית γ-אמינו (GABA) [מקור1, מקור2]. יצוין שסינגלים חשמליים עוברים במוח, ומעבירים מידע זה לזה בעזרת תאי המוח (נוירונים) בהם עוברים הסינגלים האלו. בין תאי עצב שאינם מחוברים, יש רווח – סינפסות. בסינפסה נמצא חומר נוזלי, בו חומר כימי יכול לזרום מקצה אחד (תא מוח =נוירון) אל תא הנוירון שמנגד ולהעביר אליו מידע שהוצפן בסינגלים. להזנה הנכונה או המזיקה יכולה להיות השפעה חיובית או שלילית על איכות הנוזל הזה. בהקשר זה לגלוטמאט (שעורה, שיבולת שועל) נושא מאמרי – כאן, תפקיד גדול, נוכחות של גלוטמאט מעלה את המטען החשמלי בתא המוח שמעבר למרחב שמכונה סינפסה, והוא יורה מהר וביעילות הנחיות, מעורר את המוח. מצב זה ערני מאוד, והפוך למצב בו המוח רגוע ונח כמו כאשר נכנסת לסינפסה חומצה אמינית GABA ואכן החומצה האמינית גאבא) חומצה גמא-אמינו-בוטירית; GABA, Gamma-Amino Butyric Acid) היא סם הרגעה טבעי. הוולריאן, הפסיפלורה והויטמין הרגיש שנהרס אפילו מאור – וויטמין B6 (כרוב, אפונה) תומכים בסינטזה שלה [מקור].
למאמרי על התזונה למוח – כאן.
אנשים בריאים (שמשקלם כ -70 ק"ג) נושאים בגופם כ- 70 עד 80 גרם גלוטמין [מקור]. ההערכה הכללית טוענת כיום, שייצור של גלוטמין בגוף הוא בין 40 ל- 80 גרם ליום [מקור1, מקור2]. בדיקות הדם ניכר שבפלזמה, ריכוז הגלוטמין שונה מכך ונע בין ~ 500 ל- 800 מיקרומטר/ליטר (ערכים שנרשמו לאחר 12 שעות של צום), תוצאה כזו מייצגת רק כ -20% מכלל מאגר חומצות האמינו החופשיות בדם [מקור].
חומצה גלוטמית ייחודית בכך שניתן להפוך אותה למקור אנרגיה לתאים עצביים כאשר רמת הסוכר בדם נמוכה. מאפיין זה נחשב אחראי ליכולת הגלוטמין לסכל את התשוקה לסוכר ולאלכוהול
[מקור].
גלוטמין היא חומצת האמינו הנמצאת בריכוז הגדול ביותר הן בפלזמה (26%) והן בשרירי השלד (75%). כיווץ שרירים – נוקשות שרירים – משקפת נוגדנים לאנזים GAD בדמם של אנשים. אם אתם סובלים מנוקשות שרירים עוצמתית, שיקלו תוסף גאבא (Gamma-Aminobutyric Acid – חומצת גמא אמינו-בוטירית (GABA) [מקור1, [מקור2].
חומצה גמא-אמינו-בוטירית (בקיצור גאבא) מסונטזת מחומצה גלוטמית בעזרתו של ויטמין B6 (אספרגוס, כרוב, חסה, דגנים מלאים) ופעילותו של האנזים גאד (Glutamic Acid Decarboxylase/GAD). הגאבא מצוייה כמעט בכל חלקי המוח [מקור].
בשעה שהגלוטמין נחשב לחומצת האמינו הנפוצה ביותר בגוף, ריכוז הגלוטמין וזמינותו בכל הגוף אינו שווה. ברקמת הכבד ובשרירי השלד, למשל, ריכוז הגלוטמין יותר גבוה מריכוזו בפלזמה, המהווה כ -40% עד 60% מכלל מאגר חומצות האמינו בגוף [מקור1, מקור2]. בשניהם, בפלזמה וברקמות, ריכוז הגלוטמין הוא פי 10 עד פי 100 מעבר לכל חומצת אמינו אחרת, זו גם הסיבה להנחה שהגלוטמין הוא חומצת האמינו הנפוצה ביותר בגוף. ריכוזו בגוף תלוי באיזון בין סינתזתו ו/או שחרורו, וספיגתו על ידי האיברים והרקמות. הוא מיוצר בריאות, בכבד, במוח, בשרירי השלד וברקמת השומן. יחד עם זאת לרקמות הצורכות גלוטמין, כגון רירית המעי, לויקוציטים ותאי אבובית בכליות, יש פעילות גלוטמינאז גבוהה במיוחד וקופקטורים המסוגלים להשפיל אות [מקור].
מחסורו שכיח בקרב חולים כרוניים [מקור] – מתן גלוטמין תוך ורידי נדרש על-ידי מטופלים ברפואת הממסד –
בעיה זו הובילה את התעשייה התאוותנית לחקור שני דיפפטידים של גלוטמין; אל-אלניל-גלוטמין (L-alanyl-glutamine) ו- L-glycyl L-glutamine, כי שניהם הרבה יותר מסיסים וגם הרבה יותר יציבים [מקור]. הראשון נוצר מאלנין וגלוטמין, מכונה לעתים קרובות "גלוטמין יציב". נמכר כאבקה לבנה. והשני Gly-Gln הוא דיפפטיד שנוצר משאריות גליצין ו- L–גלוטמין. גם כיום עדיין קיימת מחלוקת בנוגע למינון הגלוטמין ולדיפפטידים שלו, כאשר המינון הוא 0.19-0.29 גרם/ק"ג ליום של L-גלוטמין או צורות הדיפפטיד שלו, בתקופות ניתוחיות לאחר הניתוח או למניעת טרנסלוקציה חיידקית, וכן בחולים המועמדים להשתלות מח עצם, המינון הניתן בדרך כלל עומד על 0.37-0.57 גרם/ק"ג ליום.
השימוש בדי-פפטידים כגון אלאניל-גלוטמין – (Ala-Gln) L-alanyl-glutamine) הוא שהוביל לשימוש רפואי בגלוטמין כתרופה
[מקור], כי הגלוטמין כפי שהוזכר לא מסיס במים. שימוש זה הביא גם להפחתת הוצאתו מהשרירים ולבעיות נוספות שהחלטתי להחסירן בתחילת המאמר –
ההמלצה שלי ליטול אותו ממזון כתרופה טרם החרפת המחלה – למשל מאצות, פולי סויה או כרוב אדום ואפילו למי שאינו סובל מסוכרת ואי ספיקת כליות מדגים כסלמון –
על כך בהמשך המאמר.

כרוב אדום הוא אחד הירקות הכי פחות מוערכים שיש אבל
בניית החסינות והבריאות של אדם דורשת כרוב, ובמיוחד כרוב אדום. הכרוב האדום הוא מקור רב עוצמה של גלוטמין. חשוב לציין כי אכילת כרוב חי היא שמועילה כרוב מבושל לא מומלץ שהרי הבישול מפחית את תכולת הגלוטמין שבו. לכן מומלץ לצרוך כרוב בצורה של סלטים ויותר מכך כמיץ אם נדרשת לך תוספת רצינית של גלוטמין למשל כשיש להפחית יתר לחץ דם או לתקן מצבי אנמיה ופגעים בדופן המעי.
[מקור].
גלוטמין (Gln), הוא גם חלק קריטי במערכת העיכול שלנו. זהו חומר התזונה העיקרי לתאי רירית המעי שבו הוא מסייע לווסת את הרבייה התאית [מקור]. באמצעות מנגנון זה, גלוטמין מסייע במניעה ובנייה מחדש של מעיים דולפים, דבר הנפוץ בקרב אנשים הסובלים מבעיות דלקתיות ואוטואימוניות [מקור1, מקור2, מקור3, מקור4]. מסיבה זו הוכח כי תוסף גלוטמין יעיל מאוד בקרב אנשים הסובלים מקוליטיס כיבית, מחלת צליאק, מחלת קרוהן ותסמונת המעי הרגיז [מקור1, מקור2, מקור3].
הגלוטמין מהמזון (כרוב אדום, עדשים, טונה או פולי סויה) או כתוסף בריא ויעיל למצבי חולי קשים כתרופה. הוא תומך בבריאות מערכת העיכול והמערכת החיסונית והיכולת להפחית את התשוקה לסוכר ואלכוהול.
[מקור]
כל המחקרים על גלוטמין מראים שהוא עוזר לטפח תגובה חיסונית משופרת.
הדעה שגלוטמין משמש כמקור דלק לתאים סרטניים רבים מוכרת, מהדהדת ללא סוף, אבל היא לא נתמכת ע"י מחקר אקדמי אמיתי,
הגם שדעות כאלו מספקות לכאורה אמצעים ספקולטיביים לגורמים העוינים את הבריאות הטבעית שגלוטמין במזון או כתוסף משלים רק יכול להועיל, באומרם שהוא יכול להזין סרטן הם טועים במקרה הטוב ומטעים במקרה הרע [מקור1, מקור2].
מחקר אחר שפורסם בכתב העת של אימונולוגיה קלינית מצא כי גלוטמין בעל יכולת רגולטורית באפנון החיסון והתאים, כלומר, הוא מנרמל את ההשפעות של התגובה החיסונית Th1 ו- TH2 המעוררת ציטוקינים דלקתיים – רוצה לומר אנטי דלקתי [מקור1, מקור2, מקור3].
למאמרי "תאוותיה של הזיקנה – איך להתבגר יפה, טוב ובריא" – כאן
ירידה או מחסור של גלוטמין (Gln)
אצל רוב האנשים אין מחסור של גלוטמין (Gln). גלוטמט הופך לגלוטמין בגוף ומיוצר על ידי הגוף בכמויות נאותות, ולכן ברוב המקרים אין הוא נדרש כתוסף או כאספקת יתר בתזונה. אולם כאשר קיימת מחלה קשה, סוכרת, אי-ספיקת כליות, יתר לחץ דם, פציעה או מצבים אחרים המובילים לדלדול הגלוטמין המאוחסן, יש צורך בתוספת של גלוטמין (Gln) בתזונה. הוא השלב בו מדברים על מנת סלט כרוב אדום ליום. גם מכאן נובעת הדרישה להתסיס כרוב ולצרפו לסלט שאתם אוכלים. אינדיקציות להכנסת כרוב אדום וירקות נוספים שמכילים גלוטמין (Gln) גבוהה לתזונה כוללות היפר -חומציות, דלקת קיבה, מצב של חסר חיסוני, אימון אתלטי כבד, רמות מתח גבוהות, סטרס גם עקב המחלה או רדיפה אחר שגשוג והצלחה בקרירה כיבים, תרופות, טיפולים פולשניים של רפואת הממסד וניתוחים.
מחסור בגלוטמין (Gln), מפחית את ריבוי הלימפוציטים, משפיע על ביטוי סמני הפעלת השטח על לימפוציטים ומונוציטים, משפיע על ייצור ציטוקינים ומעורר אפופטוזיס. יתר על כן, נראה כי למתן גלוטמין יש השפעה חיובית על חילוף החומרים של הגלוקוז במצב של עמידות לאינסולין. גלוטמין משפיע על מגוון מסלולים מולקולריים שונים. גלוטמין מגרה את היווצרות חלבון הלם חום 70 במונוציטים על ידי שיפור יציבות ה- mRNA, משפיע על פוטנציאל החמצון של התא על ידי שיפור היווצרות הגלוטתיון, גורם להשפעות אנבוליות תאיות על ידי הגדלת נפח התא, מפעיל קינאזות של חלבון מופעל מיטוגן, ואינטראקציה עם סינתטים RNA העברת אמינו-אצטיל מסוימים במטבוליזם ספציפי לחוש גלוטמין (מטבוליזם – סדרה של תגובות כימיות בהן כל צעד דורש נוכחות של חלבונים קטליטיים הנקראים אנזימים). גלוטמין מיושם בתנאים קליניים כתוסף אוראלי, פרנטרלי או אנטרלי כחומצת האמינו היחידה או בצורה של דיפפטידים המכילים גלוטמין למניעת רירית המעי הגס/סטומטיטיס ולמניעת מחסור בגלוטמין בחולים קשים. בגלל קצב המחזור הגבוה של גלוטמין, ניתן לתת אפילו כמויות גבוהות של גלוטמין עד מתן יומי של 30 גרם ללא כל תופעות לוואי חשובות [מקור]
גלוטמין מסייע בשמירה על בריאותה של מערכת העיכול. הגלוטמין (Gln) מהווה גורם קריטי בתפקוד הלב ובשמירה על תקינות מערכת הדם. גלוטמין תומך גם בתפקוד נוירולוגי תקין, וקשור לשיפור במצב הרוח, והפחתת המחמצן הגדול ROS. בנוסף לכך הגלוטמין עוזר לבנות ולשמור על מסת השריר, ולכן הוא גם משמש כמקור לאנרגיה נוספת כאשר רמת הסוכר בדם נמוכה נושא שהופך אותו לנכס לספורטאים ולמפתחי גוף.
חומצה גלוטמית (גלוטמט) היא חומצת אמינו המשמשת את הגוף לבניית חלבונים [מקור]. גלוטמט הוא הנוירוטרנסמיטר המעורר (הנפוץ) הנפוץ ביותר במערכת העצבים המרכזית.
שעורה, שיבולת שועל ואפילו חיטה נמנים על המזונות הגבוהים ביותר בגלוטמין (Gln) גם גבינת פרמזן מכילה ערכים גבוהים שלו והיא מבין הגבינות שמומלצת כאן, לצד הגבינה השוויצרית.
הקזאין שמרוכז מאוד בגבינות אלה 20% ממנו הוא חומצה גלוטמית. קוויאר עשיר בו ומכאן גם היותו כה טעים גם העגבניה, והאספרגוס. ברוקולי, נבטי ברוקולי והכרוב האדום, הם מהירקות הטובים ביותר למאכל והם מכילים גלוטמין (Gln) ברמה גבוה וכן רטבי סויה, שעועית מותססת וכלל הקטניות ברשימת הקטניות שמדד החומצה הגלוטמית או הגלוטמין בהן גבוה תמצאו את הסויה, עדשים, שעועית מנומרת (פינטו Pinto), שעועית לימה שחורה, גם זרעי חמניות ודלעת בעלי רמה גבוהה של גלוטמין. מבין האגוזים בוטנים הם אלה שרמת הגלוטמין בהם גבוהה,
מונוסודיום גלוטמט ומלחי גלוטמט אחרים מתנתקים ומשחררים גלוטמט חופשי בגוף שמשמש לבריאותנו.
[מקור1, מקור2, מקור3]. מעטים יודעים אבל מרק עצמות הוא מקור מצוין נוסף גם בשר צבי מצייד, טונה וחלבון מי גבינה.
כל הדיווחים על גלוטמין מראים שהוא עוזר לטפח תגובה חיסונית משופרת.
מהחומצה הגלוטמית נולד הגלוטמין (Gln)
גלוטמין וחומצה גלוטמית הן חומצות אמינו לא חיוניות הניתנות להמרה אחת לשנייה בגופנו. זו גם הסיבה לכך ששני החומרים הללו אינם מסווגים, בתוויות המרכיבים על אריזות מזון, בהמשגות נפרדות.
מזונות המכילים גלוטמין/חומצה גלוטמית מסייעים בוויסות חילוף החומרים וייצור האנרגיה שלנו, ויש גם יתרון נוסף של עזרה בהגנה על השרירים שלנו.

פולי סויה – מכילים 6,490 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם.
קטניות כגון שעועית, עדשים או אפונה – מכילות 1,150 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם.
תה ירוק מכיל 8,496 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם תה ירוק.
טונה מכילה 3,520 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם.
שרימפס מכילים 3,250 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם.
שיבולת שועל מכילה 686 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם.
גבינה שוויצרית – מכילה 8,075 מ"ג גלוטמין/חומצה גלוטמית ל -100 גרם.
וכרוב אדום (שאין בו קלוריות כמעט) מכיל 0.2 גרם חומצה גלוטמית על כל 100 גרם. כלומר 2000 מ"ג.
אצות מקומבו – Makombu seaweed באצת קומבו מיובשת מסוג מקומבו קיים שפע של החומר האוממי גלוטמט – בכל 100 גרם יש 30 מ"ג של חומצה גלוטמית [מקור].

אצת קומבו היא אצה גדולה ועבה, המשווקת בדרך כלל חתוכה לעלה גדול ועבה. האצה מכילה כמויות גדולות של חומצה גלוטמית.
מונוסודיום גלוטמט?
מונוסודיום גלוטמט, או MSG, Monosodium glutamate (MSG) הוא מלח הנתרן של גלוטמט. כאשר MSG מתווסף למזונות, הוא מספק פונקציית טעם דומה לגלוטמט המתרחש באופן טבעי במזון. MSG מורכב מלבד מים, נתרן וגלוטמט [מקור].
מונוסודיום גלוטמט (MSG) מגביר את ריכוז הגלוטמט בפלזמה, וחליטת MSG מעוררת הפרשת אינסולין
[מקור].

בשנת 2012, בכנס השני בקופנהגן שנושאו היה המונוסודיום גלוטמט– MAD הצהיר השף המפורסם דיוויד צ'אנג (David Chang) השף של מסעדות מומופוקו (Momofuku) עם שלושת כוכבי המישלן: "דאו שאני משתמש במונוסודיום גלוטמט – MSG במסעדות שלי" והוסיף שהמונוסודיום גלוטמט משפר את הטעמים (MSG) והוא בריא לשימוש. עם הכרזתו זו תוסף המזון שהיה עד אז לאבקה גבישית לבנה שמזכירה מאוד סוכר לבן או מלח שולחן הוכשרה. צורת מלח הנתרן של חומצה גלוטמית טעימה, והיא מסיסה בקלות במים, אינרטית – כלומר, בלתי גורמת לערעור יציבותם של מרכיבי מזון אחרים – הוא לא סופג לחות ולא מייצר בצקות. מושלם למטבח.
בניסוי שנערך, תשעה אנשים מבוגרים בלעו מונוסודיום גלוטמט (MSG) לאחר הארוחה (150 מ"ג/ק"ג) ולאחר מכן המתינו או נחו במשך 105 דקות. דם ורידי נלקם מהם (נדגם) כל 15 דקות; ביופסיות השרירים של vastus lateralis נלקחו לאחר 45, 75 ו -105 דקות כלומר גם לאחר שעברו במעי. ריכוז גלוטמט ופלסמה ורידי ואספרטט נבדקו וניכר שעלו (P </= 0.05) כ- 700-800 ו-300-400%, בהתאמה, לאחר 30-45 דקות. למרות שכמה חומצות אמינו פלזמה אחרות עלו בצניעות, הגידול בגלוטמט שהיה נושא מרכזי במחקר, עלה והיווה כ -80% מהגידול בסך כל חומצות האמינו בפלזמה (בדם). בנוסף, אינסולין פלזמה גדל פי שלושה לאחר 15 דקות; כלומר עוד לפני העלייה המשמעותית של הגלוטמט פלזמה, מה שמעיד על גירוי מוקדם של מערכת העיכול [מקור].
מונוסודיום גלוטמט (MSG) – צורת מלח הנתרן הזו הומצאה על ידי ביוכימאי יפני ופרופסור לכימיה באוניברסיטה הקיסרית של טוקיו שאוחז בה כפטנט בשם Kikunae Ikeda (כיום אוניברסיטת טוקיו) בשנת 1909 [מקור1, מקור2] (בויקיפדיה מופיע כמעשה שהיה ב -1908 [מקור].) מספרים שכאשר איקדה אכל ארוחת ערב עם משפחתו עצר לפתע משהבין שקומבו (אצה Konbu) שהוכנסה למרק הדאשי שלו היה הסוד והסיבה לכך שהמרק היה טעים יותר מהרגיל; האצה (קומבו) היא הסוד לאותו טעם, ומאותו יום הוא החל לחקור וללמד את מרכיביה הכימיים של אצה זו וחשף את היכולת שלה לשפר טעמם של מאכלים כאשר היא מתווספות למאכלים מלוחים כמו מרקים ומתכונים אחרים המבוססים על בשר, דגים וירקות. התוסף הזה הופק לראשונה על ידי מיצוי, שבו הייתה החומצה הגלוטמית נוצרה בהתססה של תירס, חיטה, פולי סויה, קסאווה או קנה סוכר; למרות זאת, בסביבות 1960, הייצור של MSG הורחב בעזרת טכניקה הנקראת תסיסה תעשייתית, שבה זני חיידקים מפרישים את החומצה הגלוטמית [מקור]. בהמשך הוא בודד את מלח הנתרן של חומצה גלוטמית, רשם פטנט על שיטת הייצור שלו, וייסד את מה שמוכר כיום כיצרנית התאגידית הגדולה בעולם של מונוסודיום גלוטמט (MSG): The Ajinomoto Company, Inc [מקור].
כיצד מייצרים מונוסודיום גלוטמט MSG?
בתחילת המאה ה -20, מונוסודיום גלוטמט – MSG הופק כנזכר למעלה, ממזונות טבעיים ועשירים בחלבונים כגון אצות קומבו. כיום, MSG עשוי המונוסודיום גלוטמט מעמילן, מסוכר תירס או ממולסה מקנה סוכר או מסלק סוכר. מונוסודיום גלוטמט MSG מיוצר בתהליך של תסיסה טבעית שמשמש במשך מאות שנים לייצור מזונות מותססים מוכרים כגון בירה, חומץ ויוגורט.
הרופא היפני הראשון שהוכשר במערב, בגרמניה ואחד הנוירוכירורגים היפנים הראשונים מייאקה הייד (Miyake Hide), עוזרו היפני של הרופא המהולל Julius Karl Scriba סקרבייה גם היה ראשון לטעון כי טעם הטוב שנחשף לאחר עיכול, לא רק מאפשר לשפר את טעמה של התזונה של העם היפני אלא גם טורם לבריאותו [מקור].
הגלוטמין (Gln) הוא חומצת אמינו חיונית לצמיחה תקינה ברוב התאים ורקמות, ובמספר מחקרים הוכח כי Gln חשוב לקביעת ושמירה על תקינותם של תהליכים מטבוליים של התא
מחסור בגלוטמין מפחית את ריבוי הלימפוציטים, משפיע על ביטוי סמני הפעלת השטח על לימפוציטים ומונוציטים, משפיע על ייצור ציטוקינים ומעורר אפופטוזיס. יתר על כן, נראה כי למתן גלוטמין יש השפעה חיובית על חילוף החומרים של הגלוקוז במצב של עמידות לאינסולין. גלוטמין משפיע על מגוון מסלולים מולקולריים שונים. גלוטמין מעורר את היווצרות חלבון הלם חום 70 במונוציטים על ידי שיפור יציבות ה- mRNA, משפיע על פוטנציאל החמצון של התא על ידי שיפור היווצרות הגלוטתיון, גורם להשפעות אנבוליות תאיות על ידי הגדלת נפח התא, מפעיל קינאזות של חלבון המופעל על ידי מיטוגן, ומתקיים אינטראקציה עם סינתטים מסוג RNA העברת אמינו-אצטיל, במטבוליזם ספציפי לחוש גלוטמין [מקור]
גורמים לירידה בגלוטמין
מדד הגלוטמין בכבד יכול לרדת שהרי הכבד עצמו צורך גלוטמין, וכן לגבי רקמות, כגון רקמות השרירים, גם הן עשויות להימצא במצב של ירידה בסינתזת הגלוטמין בתנאים מסוימים, כגון בעת ירידה בפחמימות [מקורר1, מקור2] ו/או בחומצות אמינו, למשל בצום מחלבונים מושג שטבעתי לצרכי החלמה מאי ספיקת כליות [מקור], מצבים קטבוליים גבוהים (בעת סטרס: נפשי או גופני – ראו להלן), ו/או מחלות ומתח חימצוני כולם מהווים סיבות לירידה בייצורו של הגלוטמין בגוף [מקור]. האנזימים המווסתים את חילוף החומרים של גלוטמין (Gln), למשל הגלוקוקורטיקואידים [מקור], הורמוני בלוטת התריס [מקור], הורמוני גדילה.[מקור] וגם האינסולין [מקור] לכולם השפעה רבה על מדד הגלוטמין בגוף
גלוטמין סינתטאז (GS, EC 6.3.1.2) וגלוטמינאז תלוי פוספט (GLS, EC 3.5.1.2) – הזרזים החשובים לבריאותנו
גלוטמין סינתטאז (GS, EC 6.3.1.2) וגלוטמינאז תלוי פוספט (GLS, EC 3.5.1.2) הם שני האנזימים ומהיסודות החשובים לתחזוקתה הבריאה של הפעילות בגופנו. שניהם משתתפים בחילוף החומרים של הגלוטמין. אלו אנזימים תוך תאיים: גלוטמין סינתטאז (GS, EC 6.3.1.2) וגלוטמינאז תלוי פוספט (GLS, EC 3.5.1.2).
גלוטמין סינתטאז (Glutamine synthetase) GS מוכר לרבים ממעגל האוראה (The urea cycle) – כאן, כאן וכאן וקבלת הגלוטמין. הוא שיוצר גלוטמין מגלוטמאט (במוח) תוך שימוש באמוניה. כלומר האנזים אחראי להפעלת התגובה המסנתזת גלוטמין מיון אמוניום (NH4+), ומגלוטמט. הפעולה הזאת מתבצעת באמצעות צריכת אנרגיה שמקורה ב- ATP, ואילו ה – GLS אחראי על הידרוליזה של גלוטמין, שהופכת אותו לגלוטמט ושוב ל – NH4+ (איור 1) [מקור1, מקור2]. שני האנזימים פועלים כאמור לעיל, בתוך התאים, כשהגלוטמין סינתטאז ה– GS נמצא בעיקר בציטוזול, הנוזל הציטופלזמתי שנמצא בתוך תאים, ואילו הגלוטמינאז תלוי פוספט ה – GLS (בצורתו הפעילה) נמצא בעיקר בתוך המיטוכונדריה. מיקומים אלה תואמים את תפקודי האנזימים: גלוטמין סינתטאז GS מייצר גלוטמין לסינתזה של חלבונים ציטופלסמיים ונוקלאוטידים, בעוד ש- GLS מזרז את המרת הגלוטמין לגלוטמט [כצעד חשוב למחזור החומצה הטריקקרבוקסילית (TCA, המכונה גם מחזור קרבס) ב 2-אוקסוגלוטראט כמקור אנרגיה או כמקור ביניים לאמצעים מטבוליים [מקור]. סינתזת הגלוטמין על ידי הגלוטמין סינתטאז– GS תלויה בזמינות הגלוטמט. גלוטמט, בתורו, מסונתז מ- 2-oxoglutarate NH4, באמצעות פעולת הגלוטמט dehydrogenase, או אפילו מהקטבוליזם של חומצות אמינו אחרות, כגון חומצות אמינו מסועפות (BCAA), בעיקר לאוצין [מקור1, מקור2]. מחקרים שנערכו בבעלי-חיים (בחולדות) דיווחו כי ניתן להעביר BCAA, כגון לאוצין, כמעט באופן בלעדי עם α-ketoglutarate ליצירת גלוטמט, אשר בתורו יכול לשלב NH3 (אמוניה) חופשי ותחת פעילותו של גלוטמין [מקור1, מקור2] GS (איור 2).
יצוין כי במחקרים נמצא כי גלוטמין סינתטאז (GS) האנזים שנזכר לעיל ופועל בנוזל התא ומזרז בו או פועל לעיבוי של אמוניה עם גלוטמט לגלוטמין. בנוסף הגלוטמין משמש, יחד עם אלנין, כמוביל אמוניה בין -אורגני מרכזי. האמוניה נישאת על גבו ( השלב המקדים השני במעגל האוראה) אל הכבד. בכבד מתרחש דבר מעניין. 35% מאמוניה זו מנוקת מרעלים על ידי הגלוטמין סינתטאז (Glutamine synthetase) GS בכבד ו- 35% על ידי אנזימים במחזור האוראה. כידוע סילוק אמוניה מתרחש בעיקר על ידי יצירת אוראה בכבד. רמת האמוניה בדם חייבת להישאר נמוכה מאוד מכיוון שגם ריכוזים מעט גבוהים (היפר -אמונמיה) רעלנית למערכת העצבים המרכזית (CNS). קיים מנגנון מטבולי שבו החנקן מועבר מרקמות היקפיות לכבד על הנשא (גלוטמין, יחד עם אלנין). במטרה לזרוק אותו החוצה – לסלק אותו לגמרי כאוראה, ובמקביל המערכת הגופנית נזעקת לשמירה על רמות נמוכות של אמוניה במחזור הדם [מקור]. מצבי יתר אמוניה מביאים את רפואת הממסד לחדלון. עוד ועוד אמצעים והיא עולה, והורסת את מערכת העצבים וגם את הכליות – וזה מפחיד כי מתים מזה. חוסר אונים נוכח אין מענה מביא רבים לפנות ולבקש תור בקליניקה שלי – לכן יש לזכור ולהזכיר כי
GS הכבד שתורם לניקוי רעלים כולל של אמוניה אנטרלית ומערכתית הוא תלוי גלוטמין. סינתזת הגלוטמין בפריפריה (כולל זו שמתרחשת בהפטוציטים הפריצנטרליים) וקטבוליזם של הגלוטמין בהפטוציטים (פריפורטליים) מייצגים את
המערכת שמפחיתה רעלים של אמוניה בגוף.
התלות של סילוק אמוניה קשורה ותלויה בגלוטמין. נוצר או נחשף קשר גלוטמין חסר/יתר אוראה. הקשר לעליה במדדי האוראה תלוי אם כן בקצב סינתזת הגלוטמין. רוצה לומר ששיפור ביצירתו של הגלוטמין ההיקפית היא אסטרטגיה מבטיחה לטיפול בהיפר-אמונמיה
נושא האמוניה והגלוטמין יורחב בהמשך המאמר –
במצבי לחץ ייצור הגלוטמין על ידי הגוף לא מספיק
ריכוז הגלוטמין וריכוז הדם תלויים בפעילויות אנזימתיות כלומר ב GS גלוטמין סינתטאז או GLS. סינתזת גלוטמין אנדוגנית אינה עונה לדרישות גוף האדם בתנאים קטבוליים (סטרס), כגון סרטן [מקור1, מקור2, מקור3], אלח דם [מקור1, מקור2], זיהומים [מקור1] , ניתוחים [מקור], טראומות [מקור], כמו גם במהלך פעילות גופנית אינטנסיבית וממושכת [מקור1, מקור2]. גלוטמין לוקח על עצמו את תפקידה של חומצת אמינו חיונית בתנאי מחסור כאלו על ידי קידום עלייה במקביל בביטוי GLS ועיכוב פעולת ה-גלוטמין סינתטאז GS [מקור] ]. עם זאת, ראוי להדגיש כי למרות שריכוז הגלוטמין בפלזמה מצטמצם מהריכוז הנורמלי שלו (כלומר 500-800 מיקרול/ליטר) ל -300–400 מיקרול/ליטר, תאי חיסון בהתאם לחומצת אמינו זו, נמצאים עובדה שהושפעה היטב מבחינת התפשטות ותפקוד [מקור]. מצד שני, הקטבוליזם הגבוה ברקמות מוביל להפחתת מלאי הגלוטמין ברקמות אנושיות, בעיקר בשריר ובכבד (איור 3). ריכוז הגלוטמין הנמוך ברקמות האדם משפיע על כל הגוף מאחר וחומצת אמינו זו מספקת אטומי חנקן לסינתזה של פורינים, פירימידינים וסוכרי אמינו [מקור]. אם השפלת (degradation) הגלוטמין הגבוהה ברקמות אלה נמשכת, מספר רב של מסלולים מטבוליים ומנגנונים, התלויים בזמינות הגלוטמין, מושפעים ממנה לרעה, וכתוצאה מכך נוצר דיכוי חיסוני. לאחרונה דיווחו מחקרים כי גם זיהומים חיידקיים (למשל, Escherichia coli) יכולים לשנות את חילוף החומרים של הגלוטמין ולרתום אותו (את הגלוטמין) כדי לדכא את ההשפעות המזיקות של מתח חומצי ורעילות נחושת [מקור]. מכאן שפתוגנים חיידקיים יכולים להסתגל ולשרוד על ידי שינוי מסלולי חילוף החומרים החשובים לאסטרטגיות אנטיבקטריאליות שהוטלו על ידי המארח.
האיברים המטבוליים מרכזיים בהומיאוסטזיס של גלוטמין
המעיים [מקור]
המעיים הדקים והגסים מסוגלים לעבד כמויות גדולות של גלוטמין המסופק הן על ידי התזונה והן על ידי זרם הדם
[מקור1, מקור2]. גלוטמין כמצע אנרגיה למעי חשוב ורלוונטי כמותית הרבה יותר מאשר הגלוקוז. באנטרוציטים למשל, ניתן להסב את פחמן הגלוטמין תהליך כזה מתרחש בשני מסלולים עיקריים, כלומר: (i) על ידי יצירת delta1-pyrroline-5-carboxylate; (ii) או על ידי הסבה לאלפא-קטוגלוטרט כמתווך במחזור קרבס (the Krebs cycle). בהתבוננות במסלול הראשון ניכרת יצירת פרולין, אורניטין וציטרוללין מפחמן גלוטמין (proline, ornithine, and citrulline) באמצעות כ -10% מריכוז חומצת האמינו שמצויה באותו הזמן במעי. 10–15% נוספים של גלוטמין משולבים בחלבון הרקמה; החלק הגבוה יותר (כ -75%) הוא מטבוליזם במחזור קרבס למטרות ייצור אנרגיה [מקור1, מקור2].
הידרוליזה של גלוטמין לגלוטמט, המזורזת על ידי GLS, מתאימה לתגובה הראשונה הנובעת מצריכת גלוטמין [מקור]. למרות שהמעיים היא האתר העיקרי לצריכת גלוטמין, ריכוז הגלוטמין ברקמת המעי נמוך. הסיבה לכך היא פעילות GLS גבוהה (3-6 מיקרול/שעה/מ"ג חלבון), וגם זיקה גבוהה של GLS עבור המצע, גלוטמין. מעניין שיש קשר בין נוכחות GSL לבין שימוש בגלוטמין על ידי סוגי תאים מסוימים. כמעט כל ה- GLS המצוי בתאי המעי נקשר לקרום המיטוכונדריה. האפנון של פעילות GLS ברקמת המעי חשוב לשמירה על שלמות הרקמות ולאפשר ספיגה מספקת של חומרים מזינים, כמו גם כדי למנוע טרנסלוקציה חיידקית לזרם הדם (כלומר, ספטימיה) [מקור]. מצבים ממושכים של צום ותת תזונה קשורים להפחתת פעילות גלוטמינאז תלוי פוספט ה -GLS; מצד שני, פעילות GLS עולה בתקופה שלאחר הארוחה, לאחר מתן האכלה אנטרלית של חומצות אמינו מסועפות ו/או l-alanyl-l-glutamine [מקור].
המסלול הפרוטאוליטי תלוי ATP-ubiquitin הקשור לפרוטאזום ידוע כגורם לפוגת חלבונים/פפטידים אנדוגניים קצרי מועד או חריגים, כמו גם השתתפות בוויסות התגובה הדלקתית. המסלול הפרוטאוליטי התלוי ב- ATP-ubiquitin עשוי להיות חשוב למחזור החלבונים של רירית המעיים, שהם קצרים מאוד. אכן, הגורם הגרעיני של משפר גנים פוליפפטיד קפה אור במעכבי תאי B (IκB) מאפשרת לגורם הגרעיני kappa-light-chain-enhancer של תאי B מופעלים (NF-κB) טרנסלוקציה בגרעין, וכך שעתוק של גנים פרו -דלקתיים [מקור1, מקור2, מקור3] (איור 3). גלוטמין מגרה את סינתזת החלבון ומפחית פרוטוליזה תלויה ביוביקוויטין באנטרוציטים מכיוון שחומצת אמינו זו מפחיתה את ביטוי הגן של האוביקוויטין. גלוטמין יכול להגביר את ביטוי הגנים של האנזים סינתז ארגינין-סוקסינט בתאי Caco-2 (תא קו אפיתל של המעי הגס האנושי). גלוטמין מפעיל את הקינאזות (ERKs) ותאי הקיבולת c-Jun N (JNK) באנטרוציטים, וזה מוביל לעלייה משמעותית בביטוי הגן c-Jun ובפעילות גורם השעתוק המכונה activator חלבון 1 (AP-1) [מקור1, מקור2]. פעולה זו של גלוטמין מגבירה את ההשפעות של גורמי גדילה על התפשטות ותיקון התאים. הלם חום (43 מעלות צלזיוס – Hsp70s ) גורם למוות של תאי אפיתל במעי, אשר יכול להחמיר עקב מחסור בגלוטמין. עם זאת, כפי שקורה ברקמות השריר, תוספת גלוטמין מאפשרת הפחתה, תלויה במינון, במוות התא הקשור לחבטות חום במעי. השפעה זו של גלוטמין נובעת בחלקה מיכולתה של החומצת האמינית של הגדלת ביטוי הגנים של HSP 70 [מקור].
הערה: מספר מסלולים תומכי הישרדות התפתחו ברבות הזמן בגוף החי כדי לסייע לתאיו לשרוד בתנאים קשים. 'תגובת הלם חום' וחלבוני הלם החום הוא מסלול כזה שמסייע להישרדותם של התאים [מקור]. חלבוני הלם החום של 70 קילודלטון(kilodalton) (Hsp70s או DnaK) הם משפחה של חלבוני הלם חום המתבטאים בכל מקום בגוף. חלבונים בעלי מבנה דומה קיימים כמעט בכל האורגניזמים החיים. חלבוני ה- Hsp70 התוך תאיים הם חלק חשוב במנגנוני התא לקיפול חלבונים, ביצוע פונקציות שפרון (chaperoning מכונים גם חלבוני סוכך) והם מסייעים למגוון רחב של חלבונים להתקפל למבנה מרחבי (מבנה שניוני ומבנה שלישוני) תקין תוך כדי ובסיום תהליך התרגום, כאשר הם עצמם אינם חלק מהמבנה הסופי שסייעו בהיווצרותו. חלבוני הסוכך גם מסייעים להגן על התאים מפני ההשפעות השליליות של מתחים פיזיולוגיים. [מקור1, מקור2, מקור3] בנוסף, Hsp70s הקשורים לממברנה זוהו כמטרה פוטנציאלית לטיפולים בסרטן [מקור] ואלו הממוקמים בחוץ מחוץ לתא זוהו כבעלי מבנים הקשורים לממברנה וללא קרום [מקור].
לויסות של ייצור הציטוקינים תפקיד מרכזי בפתוגנזה של מחלות מעי דלקתיות (IBD). דווח כי רירית המעיים של חולי IBD (מחלת קרוהן או קוליטיס כיבית) מייצרים כמויות אדירות של ציטוקינים פרו-דלקתיים, כגון אינטרלוקין (IL-) 1β, IL-6, IL-8 ופקטור נמק-גידול-אלפא (TNF-α), בניגוד לעלייה בייצור ציטוקינים אנטי דלקתיים, כגון IL-10. לדוגמה, Coeffier, et al. [מקור] אימת שגלוטמין מפחית את ייצור הציטוקינים הפרו-דלקתיים על ידי רירית המעי בקרב בני האדם, כנראה על ידי מסלול שלאחר התמלול.
למאמרי: תאוותיה של הזיקנה – איך להתבגר יפה, טוב ובריא
גלוטמין נמצא כמי שיכול להיות פתרון יעיל לוויסות מצבים דלקתיים בהם ייצור הציטוקינים שהוזכרו למעלה יצא מאיזון.
שרירים
זמינות הגלוטמין וחילוף החומרים בגוף קשורים ישירות לרקמת שריר השלד. שרירי השלד הם כמותית האתר הרלוונטי ביותר של מלאי גלוטמין, סינתזה ושחרור למרות פעילות האנזים GS הנמוכה יחסית לכל מסת יחידת רקמת שריר [מקור]. לפיכך, שרירי השלד ממלאים תפקיד בסיסי בחילוף החומרים של הגלוטמין, מכיוון שזו אחת הרקמות הנפוצות ביותר הנמצאות בגוף האדם [מקור]. תכולת הגלוטמין השרירית תואמת 50-60% מסך חומצות האמינו החופשיות הנמצאות ברקמת שריר השלד. כ -80% מגלוטמין הגוף נמצא בשריר השלד, וריכוז זה גבוה פי 30 מזה שנרשם עבור פלזמה אנושית [מקור1, מקור2]. ריכוזי חומצת האמינו החופשיים ברקמת השריר תלויים בסוג סיבי השריר. מחקרים שנערכו בשריר השלד של חולדות הראו כי ריכוז הגלוטמין גבוה פי שלושה בסיבי שריר איטי (סיבים מסוג 1) מאשר בסיבי שריר מהירים (סיבים מסוג 2). ריכוז גלוטמין גבוה בסיבי שריר איטיים נובע מפעילות אנזים GS גבוהה וזמינות ATP לסינתזת גלוטמין [מקור].
הורמונים, כגון אינסולין וגורמי גדילה דמויי אינסולין (IGF), מעוררים את הובלת הגלוטמין אל הסביבה התוך תאית, בעוד שגלוקוקורטיקואידים מעוררים שחרור גלוטמין לחלל החוץ-תאי. שיפוע הטרנסממברנה של גלוטמין דרך שריר השלד הוא גבוה, עובדה המגבילה את דיפוזיה של חומצות אמינו דרך קרום התא. גלוטמין מועבר באופן פעיל לתאים דרך מערכת תעלות תלויה בנתרן, שתוצאתה היא צריכת ATP. העברת הגלוטמין דרך קרום תאי השריר מהירה יותר מההובלה של כל חומצות האמינו האחרות [מקור]. מעניין ששמירה מתמדת על זמינות הגלוטמין בנוזל התוך -תאי, כמו גם על שיפוע הריכוז הגבוה של גלוטמין על פני קרום התא, נתמכת במסלולים רבים, כגון זיקה של מערכת ההובלה לחומצת האמינו, יחס המחזור התוך -תאי שלה והחוץ -תאי אספקה, ריכוזי הנתרן התוך-תאיים וההשפעה של חומצות אמינו אחרות המתחרות על מולקולות נשאות [מקור1, מקור2].
במהלך המצב שלאחר הקליטה, כ -50% מסינתזת הגלוטמין בשריר השלד מתרחשת באמצעות קליטת גלוטמט ממחזור הדם, עובדה המאפיינת חלק ממעגל הגלוטמין-גלוטמט. בנוסף, קטבוליזם של חלבון שריר מייצר גלוטמין ישירות, למרות שהוא מוביל גם לשחרור BCAA, גלוטמט, אספרטט ושחרור אספרגין. שלדי הפחמן של חומצות אמינו אלה משמשים לסינתזת גלוטמין דה נובו [מקור1, מקור2]. גלוטמין ואלנין תואמים, בהתאמה, 48% ו -32% מחומצות האמינו שמשחרר שריר השלד במצב שלאחר הקליטה; הגלוטמין המכיל שני אטומי חנקן למולקולה הוא המקור העיקרי לשחרור חנקן השריר. שערי החליפין של הגלוטמין והאלנין עולים על שפע גופם, והופעתם בחלבון השריר תואמת 10–15%, ובכך מצביעה על הצורך המתמיד בסינתזת גלוטמין ואלנין דה נובו בשריר השלד [מקור]. קצב סינתזת הגלוטמין בשריר השלד (כ- 50 ממול/שעה) גבוה מזה שנרשם עבור כל חומצת אמינו אחרת. לפיכך, גלוטמין ואלנין אמורים לנבוע מההמרה ההדדית של חומצות אמינו בתוך התא, בתהליך התלוי בתנאים המטבוליים של התא, המושפעים ממצב התזונה וההורמונלית של האדם, כמו גם מפעילות גופנית [מקור1, מקור2].
אחד המחקרים הראשונים על מטבוליזם של גלוטמין בשרירים במצבים קטבוליים תיעד כי ירידה בריכוז הגלוטמין בשריר השלד קשורה לירידה בשיעור ההישרדות של חולי מצב אלח דם.
מצב רפואי מסכן חיים, הנגרם כתוצאה מתגובה חיסונית לזיהום חמור.
הירידה החמורה בריכוז הגלוטמין בשרירים בחולים חולים קריטיים (ירידה של 80% בממוצע בריכוז התקין עקב פירוק חלבון) מלווה בסינתזת גלוטמין מוגברת ושחרור משריר השלד. זה קורה בגלל הגדלת שליחות ה- RNA (mRNA) ושל פעילות האנזים GS בשריר השלד במהלך מצבים קטבוליים קשים. גלוקוקורטיקואידים עשויים להגדיל את כמות ה- mRNA GS ברקמת השריר באמצעות תהליך תלוי בקולטן של גלוקוקורטיקואיד המתרחש בציטוזול. ברגע שהגלוקוקורטיקואיד נקשר לקולטן הציטוזולי שלו הם מועברים לגרעין, שם הם נקשרים לאזורים המכילים יסודות תגובה של גלוקוקורטיקואידים, אשר גורמים לתעתיק גנים של GS, בין היתר [מקור1, מקור2].
למרות שפעילות ה- GS עולה בתגובה ללחץ פיזיולוגי, ייתכן כי כמות החלבון לא תגדל במקביל לזו של ה- mRNA, ובכך מצביעה על הפעלת מנגנוני בקרה לאחר תעתיק. לפיכך, נראה כי פעילות האנזים הנ"ל נשלטת באמצעות ריכוז הגלוטמין התוך תאי באמצעות מנגנון בקרה לאחר תעתיק, אשר מגביר את פעילות האנזים GS כאשר ריכוז הגלוטמין התוך-תאי יורד. עם זאת, האנזים GS אינו יציב יחסית בנוכחות גלוטמין; לכן, ריכוז הגלוטמין התוך -תאי המוגבר מוביל להידרדרות GS מהירה יותר. בנוסף, גלוקוקורטיקואידים ודלדול הגלוטמין התאי פועלים באופן סינרגי על ידי הגדלת ביטוי ה- GS בשריר השלד [מקור].
מחקרים במבחנה שנערכו עם מספר סוגי תאים הראו שגלוטמין יכול גם לשנות את ביטוי הגנים של חלבוני התכווצות
(Contractile Proteins גם החלבונים המתכווצים), כלומר חלבונים המתווכים החלקה של סיבים התכווצותיים (של ההתכווצות) של שלד התא, ושל שריר הלב והשלד [מקור]. (סיבי התכווצות הלב והשריר מורכבים מצרורות פולימרים של אקטין המחליקים זה לצד זה על ידי פעילותו של מיוזין הוא החלבון המוטורי וחלבוני ההתכווצות – Contractile Proteins למשל טרופונין וטיטין troponin and titin [מקור].) על פי מחקר אחד, גדילה והתבגרות קרדיומיוציטים לוותה בתכולת mRNA מוגברת בחלבונים, כגון שרשרת כבדה אלפא-מיוזין (α-MHC) ואלפא אקטין; שני הפרמטרים נחשבו להיפרטרופיה (העלאת מסת השריר) לא פתולוגית [מקור1, מקור2]. מחקרים אחרים מדגישים את התפקיד הרלוונטי שמגלם הגלוטמין בתיווך הפעלת מסלולים, כגון מטרה היונקים של רפמיצין (mTOR), הנחשב לגודל רקמות ומווסת המוני חיוני, בחולים בריאים או חולים. למעשה, השימוש בחומצות אמינו, בעיקר של לאוצין, כגורמים אנבוליים בתאי השריר מפריע לפעולה באמצעות mTOR כאשר גלוטמין אינו זמין [מקור]. למרות התפקיד המהותי שממלא הגלוטמין בוויסות הביטוי של גנים הקשורים לתכולת השריר, אין מחקרים in vivo התומכים בהשערה כי תוספת המיושמת לבדה יכולה לקדם עלייה במסת השריר.
תפקיד משמעותי נוסף שמגלם הגלוטמין קשור ליכולתו לווסת תגובות הגנה והתנגדות לפציעות, אשר ידועות גם בתור השפעות נוגדות חמצון וציטופרוטקטיביות.
[מקור].
הלחץ החמצוני הגבוה שנוצר במצבי קטבוליזם גורם למספר השפעות שמסתיימות בגירויים פרו-אפופטוטיים דרך מסלולים קלאסיים, כמו אלה של NF-κB. מיני חמצן ריאקטיביים (ROS), הן הרדיקליים והן המינים הלא-רדיקליים, מגיבים למינרלים, לקרום פוספוליפידים ולחלבונים, בין שאר התרכובות הרלוונטיות, להומאוסטזיס תאי [מקור]. גלוטמין יכול לווסת את הביטוי של חלבוני הלם חום (HSP). על פי מחקר שנערך עם עכברים מודלקים בחריפות (נתון לאנדוטוקסמיה, שהוא מודל אלח דם), זמינות הגלוטמין המוגברת ברקמות החיות סייעה לשמור על ביטוי ה- HSP, בעיקר בשנות ה -70 (הצורה הנפוצה ביותר), 90 , ומשפחת 27 kDa. תוצאות בנוגע לשרירי השלד והכבד נרשמו ברמות חלבון וביטוי גנים. בנוסף, גנים אחרים הגיבו מאוד לגלוטמין, כגון גורם הלם החום 1 (HSF-1), החשוב לסינתזת HSP, ואנזימים המקושרים למערכת נוגדי החמצון (איור 3). הגלוטמט הנובע מגלוטמין הוא מצע חיוני לסינתזת גלוטתיון, עובדה שמשנה את ביטוי הגנים, כגון גלוטתיון S-רדוקטאז (GSR) וגלוטתיון פרוקסידאז 1 (GPx1). המאפיינים הציטופרוטקטיביים והנוגדי חמצון של גלוטמין עשויים להיות חשובים במיוחד במצבי קטבוליזם גבוהים, בהם הפעולה וביטוי המסלולים הדלקתיים המתווכים על ידי NF-κB מאופננים [מקור1, מקור2] .
הכבד
הכבד הוא מטבולי מאוד ויש לו תפקידים רבים, כולל ניקוי רעלים של מרכיבי דם המגיעים ממערכת העיכול, ייצור מרה לסיוע בעיכול, מטבוליזם של פחמימות, שומנים, חלבונים ותרופות, איזון pH בדם, סינתזה של חלבוני פלזמה, וכן אחסון וסינתזה של גליקוגן ושומנים.
הכבד ממלא תפקיד מרכזי בחילוף החומרים בחנקן. החנקן נכנס לכבד כאמוניה חופשית וכחומצות אמינו שגלוטמין ואלנין מהוות את ה"קודמן" החשוב ביותר. במהלך ניקוי הרעלים של אמוניה היא מתהפכת כאן לאוריאה. מהלך זה כרוך בדימינציה ובטרנסמינציה [מקור]. אמוניה חופשית, עשויה להיתקל בבעיה ולהיות מוגבל במצבים של מחסור בגלוטמט. מצב כזה יכול להתרחש כאשר נוצר עומס גבוה של חנקן [מקור]. ראינו שרמות ה- mRNA של אנזימי דמינציה ופירמינציה פרופריטליים עלו עם תכולת החלבון בתזונה. באופן דומה, רמות ה- mRNA של דה -הידרוגנאז הפריצנטרלי גלוטמט ואמינוטרנספרז אורניטין, היצרנים העיקריים של גלוטמט באזור זה וגלוטמין סינתטאז הפרינטרלי, עלו כולם עם עלייה ברמות החלבון בתזונה. על בסיס שינויים אלה ברמות ה- mRNA, אנו מסיקים כי: (א) גלוטמט מיוצר באופן פרצנטרי בכמויות מספיקות כדי לאפשר ניקוי רעלים של אמוניה על ידי סינטזה של גלוטמין ו (ב) בנוסף לתפקיד הקטליטי של אורניטין במחזור האורניטין המקומי, פירוק אורניטין pericentral מספק גלוטמט לגמילה מאמוניה [מקור].
גלוטמין הוא מבשר חשוב ליצירת מטבוליטים אחרים, כגון גלוטמט
כפי שצוין כבר, גלוטמין הוא מבשר חשוב ליצירת מטבוליטים אחרים, כגון חומצות אמינו (גלוטמט), רכיבי TCA (α-ketoglutarate) ונוקלאוטידים (AMP, purines ו- pyrimidines), יחד עם הפעלת המלווה תפקוד (בתיווך תגובה HSP) והגנה נוגדת חמצון (בתיווך גלוטתיון, GSH). לכן, גלוטמין הוא קריטי לחילוף החומרים באנרגיה ולריבוי הפטוציטים בכבד. בנוסף,
גלוטמין הוא מבשר חשוב לגלוקונאוגנזה, במסלול זה מיוצר גלוקוז מתרכובות שאינן פחמימות, כגון פירובט, גליצרול או חומצות אמינו. גלוקונאוגנזה הוא מהווה מסלול מטבולי מרכזי בכבד. בעזרתו הכבד יכול לשמור על רמות הגלוקוז בדם בצום וברעב בעקבות דלדול מאגרי הגליקוגן.
במהלך מחלה קשה, שריר השלד הוא הספק העיקרי של גלוטמין, בעוד הכבד הוא צרכן מרכזי שלו [מקור1, מקור2]. צריכה זו תומכת ברבות מפעולות הכבד המפורטות לעיל, אך כחומצת אמינו מרכזית המעורבת בחילוף החומרים בחנקן, ספיגת הגלוטמין בפטוציטים שבכבד מסדירה את פעילות מחזור האוראה בשל הפיכתו לגלוטמט NH3 על ידי GLS [מקור]. כתוצאה מכך, הכבד מווסת את רמת הדם ואת ניקוי הרעלים של NH3 באמצעות מחזור אוראה באמצעות גלוטמין [מקור]
סינטזה של פוספט קרבמויל (Carbamyl phosphate – CP) מובילה לאוראה – מהלך תלוי גלוטמין
[מקור]
פוספט קרבמיל (CP) ידוע כתווך חיוני לביוסינתזה של פירימידין וארגינין/אוראה. NH3 ו- NH4+הם שרידים מטבוליים רעילים מקטבוליזם של חומצות אמינו, ודם שמועבר לכבד מהמעיים כשהוא מוצף ב- NH3/NH4+ (אמוניה).
במיטוכונדריה של הפטוציטים מתרחשת תגובה מאוד חשובה: ה- NH3 נפגש עם ATP ויון הביקרבונט (HCO3-) ומתחיל תהליך אשר מובילה להיווצרותו של הפוספט קרבמויל (CP) על ידי סינתזה CP (CPS), הוא אמצעי ביניים מרכזי במחזור האוראה. תהליך זה מתבצע תחת השגחתו המזרזת של האנזים אורניטין טרנסקרבמילאז, אורניטין מגיב עם פוספט קרבמויל CP בדרכו ליצירת ציטרוליין – חומצה אמינית שמעורבת ביצירת אוראה בכבד [מקור]. התהליך הזה עובר לאחר מכן מספר תגובות ביוכימיות היוצרות ארגינין, אחת מ-20 חומצות האמינו הנפוצות בטבע, התהליך ממשיך הלאה ובסופו של דבר מתקבלת אוראה, שמופרשת מהציטוזול של הפטוציט לדם.
בתגובה האחרונה ליצירת אוראה, אורניטין מתחדש כדי לאפשר את המשך המחזוריות של מחזור האוראה עם NH3 נוסף. חשוב לציין,
ריכוזי הגלוטמין במיטוכונדריה הם שמסדירים את השטף במהלך יצירת CP.
רמות גלוטמין גבוהות מגבירות גלוטמט ו- NH3 באמצעות פעילות GLS, כאשר NH3 מגיב עם אורניטין ליצירת CP. NH3 הוא גם שותף של GLS בכבד [מקור1, מקור2], ומאחר ש- גלוטמינאז תלוי פוספט ה-GLS בכבד אינו מעוכב על ידי גלוטמט [מקור1, מקור2], הגלוטמט המיוצר יכול ליצור N-acetylglutamate, שהוא מפעיל הן של GLS והן של CPS [מקור1, מקור2]. כתוצאה מכך, שני המנגנונים הביוכימיים הללו גורמים לשטף גבוה לכיוון היווצרות אוראה עקב רמות גבוהות של NH3 במיטוכונדריה (שמקורן בדם במערכת העיכול והידרדרות הרמות של גלוטמין), הזיקה הגבוהה של CPS ל- NH3 והפעילות המוגברת של GLS. עם זאת, נראה כי הדור האולטימטיבי של אוראה מוסדר על ידי רמת הגלוטמין שנמצא בתאים, וכתוצאה מכך ספיגתו מהסביבה החוץ-תאית.
ההובלה התוך, ובין ותאית של גלוטמין בהפטוציטים היא מרכזית בהמרת NH3/NH4+לאוראה, הפרשתה לאחר מכן ואיזון pH בדם עקב השפעות על HCO3-.
הפטוציטים הפריפורטליים (ליד וריד הפורטל שבכבד) מקבלים דם וחומרים מזינים מהמעי ואחראים בעיקר לייצור אוראה באמצעות גלוטמין כמפורט לעיל.
עם זאת, הפטוציטים הדיסטליים ליד וריד הכבד (חיוניים), מנצלים כל שאר NH4+מהדם, כולל זה שעוקף את הפטוציטים הפריפורטליים, לסינתזה מחדש והפרשה של גלוטמין למחזור הדם. בתרחיש אחרון זה, NH3/NH4+נכנס לפטוציטים, ובעזרת גלוטמט כמצע, גלוטמין נוצר על ידי GS. תהליך זה מבטל כל NH3/NH4+שנמלט מהתהליך הפריפורטללי, תוך כדי חידוש הגלוטמין ששימש את הפטוציטים הפריפורטליים ביצירת אוראה וסילוק חנקן. האזורים התפקודיים השונים של הכבד הודגמו על ידי מצב הביטוי של אנזימים המטבוליזם של גלוטמין, כך שרמות גבוהות של גלוטמינאז תלוי פוספט ה-GLS נמצאו באזור הפורטל[מקור1, מקור2], בעוד שרק 7% מהפטוציטים הביעו GS, ואלו נמצאו במיוחד סביב ורידי הכבד המרכזיים [מקור].
המחזור הדו -תאי או הכבד של גלוטמין בין אזורי כבד אלה מתווך גם על ידי מובלי קרום ספציפיים בפטוציטים הפריפורטליים וחיי -חיים. מערכות הובלה אלה שולטות גם ב- pH תוך ותאי על ידי טרנסלוקציה של נמל H+על כניסת Na+וגלוטמין. גלוטמין מהתזונה נלקח על ידי הפטוציטים הפריפורטליים יחד עם שני יוני+Na, בעוד שאחד H+מוחדר בכיוון ההפוך מהפטוציט לחלל החוץ -תאי. תהליך זה מונע על ידי ריכוזי הגלוטמין והנא+מחוץ לתא (כלומר בדם), וגם הריכוז התוך -תאי של H+. בעיקרו של דבר, הובלה כיוונית זו מוסדרת גם על ידי הפרש ה- pH היחסי בין החלל התוך -תאי לתא, כך שספיגת גלוטמין בכבד הפרופורטל מובילה לחמצון חוץ -תאי ולבסיס תוך -תאי, ואילו ייצוא גלוטמין מהפטוציטים חיוניים מוביל לחמצת תוך -תאית ולהתכלות חוץ -תאית [מקור]. ניסויים בכבדי חולדות מפולפות הראו כי עלייה קלה באלקלי ב- pH חוץ -תאי (0.4 יחידות) יכולה לשפר את הייבוא המיטוכונדריאלי של גלוטמין להפטוציטים, כאשר H+מועבר חיצונית כדי להפחית את ה- pH החוץ -תאי ולשמור על שיווי משקל. ריכוז הגלוטמין המיטוכונדריאלי עלה לכ -15-50 מ"מ, בעוד ריכוזי הגלוטמין החוץ -תאי (0.6 מ"מ) והציטוסולי (6 מ"מ) נותרו ללא שינוי במודלי זלוף אלה [מקור1, מקור2]. לכן, הרגולציה והשטף באמצעות גלוטמינאז תלוי פוספט ה-GLS בהפטוציטים הפריפורטליים מוסדרים על ידי הריכוז התת-תאי של גלוטמין, ולא רק קצב כניסת הגלוטמין ממקורות תאיים. הסינתזה והשחרור של גלוטמין לדם מ הפטוציטים מתאפשרת על ידי ריכוז ציטופלזמה וריכוז חוץ -תאי נמוך יותר של גלוטמין, אשר חווה התנגדות על ידי שטף ציטוזולי של H+[מקור].
חשוב לציין כי ייבוא ויצוא של גלוטמין משפיע גם על איזון אוסמוטי ולכן הוא משפיע גם על נפח הפטוציטים. יש לכך השלכות נוספות על תפקוד הכבד, כולל סינתזת ושחרור מרה [מקור], אך הדבר הזה גם מסדיר תהליכים אנאבוליים, כגון גליקוגן, שומנים וסינתזת חלבונים [מקור]. ספיגת הגלוטמין משפרת במידה רבה, את ההתנפחות וההידרציה של התאים הפטוציטים [מקור], מה שמוביל לסינתזת גליקוגן וחומצות שומן [מקור1, מקור2], ובהמשך גם להפחתת פרוטאוליזה בתיווך קינאזות חלבונים המופעלים על ידי P38 (p38 MAPK) [מקור]. חומצות אמינו אחרות, כגון גליצין ואלנין, יחד עם הורמונים אנבוליים, כגון אינסולין, קידמו התנפחות של פטוציטים, מה שמוביל לתהליכים ביו -סינתטיים מוגברים [מקור], בעוד שהורמונים קטבוליים, כמו גלוקגון, הפחיתו את רמות הגלוטמין התוך תאי וגרמו להתכווצות של הפטוציטים [מקור]. כתוצאה מכך, התרחשה התייבשות עקב ירידה ברמות של הגלוטמין התוך תאיים שמאופיינת בירידה בנפח התא, התחלת התהליך הקטבולי ותנאים עמידים לאינסולין, ולאחרונה הוכח כי עירוי היפרטוני עלול לגרום לויסות ויסות של גלוקוז בבני אדם [מקור].
הכבד הוא איבר רגיש לאינסולין וכמו שריר השלד, אחראי לסילוק הגלוקוז באמצעות סינתזת גליקוגן. התפתחות עמידות לאינסולין ותנאים גלוקוטוקסיים הבאים יכולים להתקדם להפרעות כרוניות, כגון מחלת כבד שומני לא אלכוהולית (NAFLD), המאופיינת בהצטברות שומנים מוגזמת, וסטטו-הפטיטיס לא אלכוהולית (NASH), המאופיינת בתצהיר מוגבר של מטריצה חוץ-תאית (ECM) [מקור1, מקור2]. הפרעות כרוניות אלה עלולות להוביל לנזקים נוספים בכבדוציט, המתבטאים בשחמת הכבד ואולי גם בקרצינומה הפטו -תאית. הכבד יכול להיפגע בדרכים שונות, כולל זיהום (למשל, הפטיטיס B ו- C), אלכוהוליזם, מחלות מטבוליות ותזונה לא בריאה ממושכת. נזק זה מעורר סביבה כבדית פרו-דלקתית, המובילה לפיברוזיס ברקמת הכבד, הגורמת לפגיעה בתפקוד הכבד [ מקור]. פיברוזיס לא מטופל מתפתח בסופו של דבר לשחמת הכבד, שהיא לרוב בלתי הפיכה [ מקור]. מתווך מרכזי של פיברוזיס בכבד הוא תא הכוכב הכבד (HSC), שהוא תא מזנכימלי ופיברוגני השוכן בחלל תת-האנדותל של דיסה בין האפיתל הפטוציט לסינוסידים. בעוד שהם בדרך כלל במצב שקט, תאים אלה הופכים לפעילים בעקבות עלבון בכבד, והם מגיבים לציטוקינים ומתרבים כדי לסייע בתיקון פציעות. עם זאת, הפעלת יתר או כישלון בפתרון מצב ההפעלה שלהם (הפעלה כרונית כתוצאה מחשיפה מתמשכת לגירויים פרו-דלקתיים) יכולים להוביל לתצהיר ECM במרחב הדיסה שיש לו השלכה שלילית לתפקוד הפטוציטים ולארכיטקטורת כבד תקינה, כגון אובדן מיקרווילי [מקור1 , מקור2]. תאי קופר, מקרופאג בכבד, מופעלים גם הם בתנאים אלה, ויחד עם ,HSC מקדמים סביבה כבדית פרו-דלקתית. מפעילים דלקתיים של תאים אלה נמצאים מעבר להיקף כתב היד הזה, אך הוכח כי HSC דורשים חילוף חומרים של גלוטמין כדי לשמור על התפשטות. הוכח כי HSC מופעל היה תלוי בהמרת גלוטמין ל- ∝-קטוגלוטרט וחומצות אמינו לא חיוניות להתפשטות, והפחתת גלוטמין פגעה משמעותית בהפעלת HSC [מקור]. בנוסף, גלוטמין יכול לשמש כמבשר לסינתזת פרולין, המהווה מרכיב מרכזי ביצירת קולגן ויצירת ECM [מקור].
גלוטמין והשפעתו על תפקודם של תאי מערכת החיסון
גלוטמין נחשב לראשונה למולקולה חשובה ביולוגית בשנת 1873 כאשר עדויות עקיפות סייעו לאפיין אותה כמרכיב מבני של חלבונים; ואז, בשנת 1883, נמצא גלוטמין חופשי בשפע בצמחים. מעניין לציין שמספר המחקרים שבאו אחרי המחקר שערך סר האנס אדולף קרבס האדם שגילה בשנת 1932 את מעגל האוריאה. (1900–1981 Adolf Krebs)גדל באופן ניכר. באותה תקופה, ולראשונה בהיסטוריה של המדע, סר קרבס חשף שרקמות יונקים יכולות לבצע הידרוליזה וסינתזה של גלוטמין [מקור]. בשנות החמישים, Eagle, et al. [מקור] דיווח שגלוטמין נוצל על ידי פיברובלסטים מבודדים בכמויות גדולות יותר מכל חומצת אמינו אחרת במדיום הדגירה של התא. גלוטמין סווג אז כחומצת אמינו שאינה חיונית והיה קשה למדוד את רמות הפלזמה והרקמות שלו מה שפגע באיכות המחקר. לאורך שנות השישים, השבעים והשמונים, הנס קרבס, פיליפ רנדל (1926–2006), דרק וויליאמסון (1929–1998) ואריק ניוזהולם (1935–2011) עבדו על ויסות מטבולי (סדרה של תגובות כימיות) תוך שימוש במודלים שונים של מחקר, במחקר מבחנה, שביצעו כרקע לניסויים בבני אדם וב in vivo. מצאו כי למרות שגלוקוז הוא הדלק העיקרי והמטבוליט החיוני, למספר רב של תאים בגוף, גם לגלוטמין תפקיד מרכזי כאן. בתחילת/אמצע שנות השמונים, אריק ארתור ניוזהולם (Eric Newsholme) הצליח לקדם הוכחות לכך שגלוטמין הוא מאפנן חשוב לתפקוד הלוקוציטים, כמו למשל בלימפוציטים. [מקור] ובמקרופאגים [מקור]. מחברי הדו"ח הזה, Newsholme P et al. (1986; 1987) [מקור1, מקור2, מקור3, מקור4], הם שדיווחו לראשונה כי מקרופאגים מנצלים גלוטמין באופן פעיל. בשנת 1997 תיארו Pithon-Curi et al., [מקור1, מקור2] לראשונה את צריכת הגלוטמין על ידי נויטרופילים. מחקריהם של אריק ופיליפ ניסהולם (Eric and Philip Newsholme) על מטבוליזם של גלוטמין בלימפוציטים ובמקרופאגים, בהתאמה, גרמו לבז ופרסומים רבים הציפו את המדע, וקפצו מממוצע של שניים או שלושה פרסומים בשנה בסוף שנות השישים ותחילת שנות השבעים לכ -50 פרסומים בשנה.
קצב צריכת הגלוטמין של כל תאי החיסון במהלך זיהום ו/או קטבוליזם גבוה, דומה או גדול יותר מצריכה של הגלוקוז [ מקור1, מקור2], במקביל גדל גם הביקוש לגלוטמין על ידי תאי מערכת החיסון, יחד עם שימוש מוגבר בחומצת אמינו זו על ידי רקמות אחרות, כגון הכבד, עלול להוביל למחסור בגלוטמין בגוף האדם.
שרירי השלד, מאותגרים ומעלים את תרומתם לשמירה על ריכוז הגלוטמין בפלזמה (איור 2). השפעה זו, בהתאם למצב, ולגודל נחיצותו של הגלוטמין עשויה לתרום משמעותית להחמרת של מחלות וזיהומים, ו/או להגדיל את הסיכון לזיהום לאחר מכן, עם השלכות אפשריות של סכנת חיים – דרישת גלוטתיון על-ידי תאי החיסון במצבי סטרס היא בהחלט אחד האתרים החשובים ביותר של סינתזת גלוטמין [מקור].
בתאי החיסון, גלוקוז הופך בעיקר ללקטט (גליקוליזה), ואילו גלוטמין הופך לגלוטמט, גלוטמינוליזה – glutaminolysis
אספרטט ואלנין על ידי חמצון חלקי ל- CO2, תהליך הפיכתו לגלוטמט נקרא גלוטמינוליזה [מקור] (איור 3). המרה ייחודית זו ממלאת תפקיד מרכזי בתפקוד האפקטיבי של תאי מערכת החיסון [מקור]. יתר על כן, דרך מסלול הפנטוז פוספט, המסלול קרוי כך כיוון שנוצרים בו פנטוזות, סוכרים בעלי חמישה אטומי פחמן, וכיוון שהוא כרוך בהעברת קבוצות זרחה (פוספט) בין המולקולות השונות המשתתפות בו [מקור], מסלול מטבולי המקביל למסלול הגליקוליזה, התאים יכולים לייצר ריבוז-5-פוספט (סוכר בעל חמישה פחמן), שהוא מבשר לסוכרי הפנטוז הנראים במבנה ה- RNA וה- DNA, כמו כמו גם גליצרול -3 פוספט לסינתזת פוספוליפידים [מקור]. מצד שני, התדרדרות הגלוטמין יווצרת NH3 ואספרטט ומובילה לסינתזה של פורינים ופירימידינים של ה- DNA ו- RNA. הביטוי של מספר גנים בתאי מערכת החיסון תלוי במידה רבה בזמינות הגלוטמין [מקור]. לדוגמה, התפקיד של הגלוטמין בשליטה על ריבוי תאי מערכת החיסון מתרחש באמצעות הפעלה של חלבונים, כגון קינאזות ERK ו- JNK. שני החלבונים פועלים על הפעלת גורמי שעתוק, כגון JNK ו- AP-1, דבר שמוביל לשעתוק של גנים הקשורים להתפשטות תאים. לדוגמה, ריכוז גלוטמין מתאים מוביל לביטוי של סמני משטח תאי לימפוציטים מרכזיים, כגון CD25, CD45RO ו- CD71, וייצור ציטוקינים, כגון אינטרפרון-גמא (IFN-γ), TNF-α ו- IL- 6 [מקור1, מקור2, מקור3, מקור4]. לפיכך, גלוטמין פועל כמצע אנרגיה ללוקוציטים וממלא תפקיד חיוני בהתפשטות תאים, בפעילות תהליך תיקון רקמות ובמסלולים תאיים הקשורים לזיהוי פתוגנים [מקור].
נויטרופילים
נויטרופילים הם תאים השייכים למערכת החיסון. תפקידם העיקרי בליעה וחיסול חיידקים או פטריות ומניעת הזיהום שנגרם מהם. הנויטרופילים מהווים אחד משלושת סוגי הפגוציטים במערכת החיסון, וכן אחד משלושת סוגי הגרנולוציטים. נויטרופילים צורכים גלוטמין בשיעורים הגבוהים ביותר [מקור1, מקור2, מקור3]. בנויטרופילים חלק ניכר מהגלוטמין הופך לגלוטמט, אספרטט (באמצעות פעילות מחזור קרבס) ולקטט. גלוטמין מסייע לאזן את ייצור הסופר –אוקסיד ROS באמצעות NADPH (ניקוטינאמיד אדנין דינוקלאוטיד פוספט) ו אוקסידאז שבנויטרופילים. באופן דומה, לזה בו המקרופאגים, שיוזכרו מיד, משתמשים בגלוטמין לארגנין ובכך מתאפשרת סינתזה של תחמוצת החנקן (NO) באמצעות פעולת האנזים NO synthase (iNOS), באמצעות NADPH כמקור לאנרגיה [מקור1, מקור2, מקור3].
Macrophages מקרופאגים
מקרופאגים הם אחד המרכיבים החשובים של מערכת החיסון המולדת ומצויים ברקמת חיבור, בקשרי הלימפה, בדם, במח העצמות, בטחול ובכבד . המקרופאגים ממלאים תפקיד חשוב בתגובה החיסונית הראשונית והם חלק מ"קו ההגנה הראשון" של הגוף. בזמן דלקת שנוצרה מהתקפת חיידקים, למשל, הם מסוגלים לבלוע ולעכל את החיידקים הפולשים, ובתגובה להוראה מתאים אחרים של מערכת החיסון, שמפרישים חלבונים הקרויים ציטוקינים להעברת מסרים בין תאים, הם מסוגלים גם להשמיד את החיידקים שבלעו [מקור]
מטבוליזם של גלוקוז וגלוטמין מושפע באופן עמוק במהלך תהליך הפעלת המקרופאג [מקור1, מקור2]. נבדקו ההשפעות של תיוגליקולאט (גירוי דלקתי) ושל באסילוס קאלט-גורין-BCG (גירוי הפעלה) על גלוקוז מקרופאג ומטבוליזם של גלוטמין [מקור]. או תיוגליקולאט או Bacillus Calmette-Guérin—BCG משפרים את הפעילויות של הקסוקינאז (hexokinase ) וציטראט סינתז, וגם חמצון גלוקוז ואילו BCG מגביר באופן ניכר את חילוף החומרים של גלוטמין. מתן ליפופוליסכריד (LPS) גורם גם לשינויים בולטים בחילוף החומרים ובתפקוד המקרופאגים (לסקירה בנושא זה, ראו נגי והצ'מי [כאן]. מטבוליזם של גלוקוז וגלוטמין מעורב גם באותות קיטוב המווסתים את תוכניות התעתיק הנדרשות ביכולת המקרופאג לבצע פונקציות מיוחדות. חלבון קינאז B (PKB או Akt), קומפלקס mTOR 1 (mTORC1), mTORC2 וחלבון קינאז מופעל על ידי AMP (AMPK) ממלאים תפקיד קריטי במסלולים מטבוליים ובהפעלת איתות קשורה [מקור1, מקור2]. למשל, תאיים. גלוטמין עשוי לתפקד כאות התזונה הספציפי הנגרם על ידי רעב לוויסות הזמינות של – mTORC1.
לאחרונה זוהו אוכלוסיות שונות של מקרופאגים, כגון M1 ו- M2 [מקור1, מקור2, מקור3]. ה- M1 ו- M2 הם למעשה שני קצוות של קשת שטרם ידועה לחלוטין של מצבי הפעלה של מקרופאגים [מקור1, מקור2, מקור3] . תכנות מחדש של מסלולי איתות מעורבים ביצירת מקרופאגים פנוטיפ M1 או M2. התכנות המטבולי מחדש של מקרופאגים כולל שינויים מרכזיים בחילוף החומרים בגלוטמין ובגלוקוז [מקור]. אף לא דיווח אחד לא מציין כי זיהה את הדרישה של חומצות שומן לקיטוב המושרה על ידי מקרופאג בבני אדם IL-4 [מקור]. אולם סוגיה זו עדיין שנויה במחלוקת. מעניין להוסיף כי מקרופאגים מתכנתים מחדש את חילוף החומרים ואת תפקודם לקיטוב לתאים פרו או אנטי דלקתיים, וזוהי תוצאה של התנאים הסביבתיים והגירויים שמתרחשים בקרבתם [מקור]. טיפול במקרופאגים באמצעות LPS מקדם מעבר מזרחן חמצוני תלוי גלוקוז לגליקוליזה אירובית-אפקט ורבורג [מקור]. Pyruvate kinase M2 מווסת את פעילות גורם החמצן 1-אלפא (Hif-1α) והבעת ביטוי IL-1β, היות ומולקולת מפתח להשראת אפקט ורבורג במקרופאגים המופעלים על ידי LPS [מקור]. בשל מנגנון זה, מקרופאגים מסוג M1 מפגינים עלייה מהירה בהיווצרות – ATP הנדרשת לתגובת ההגנה של המארח [ מקור1, מקור2, מקור3]. למחזור TCA של מקרופאגים M2 אין בריחה של שטף מטבולי ואילו למקרופאגים M1 (שטופלו ב- LPS) יש שתי נקודות של סטיית שטף מצע, אחת מתרחשת בתגובת שלב האיזוציטראט דהידרוגנאז ואחת נוספת בהיווצרות פוסט סוקסינאט. כתוצאה מכך, ישנה הצטברות של חומרי ביניים במחזור TCA (למשל, succinate, α-ketoglutarate, citrate, and itaconate) המסדירה את הפעלת מקרופאג LPS [מקור]. לאיטקונאט תכונות אנטי דלקתיות בזכות יכולת ההפעלה שלו את גורם 2 גרעיני אריתרואיד 2 הקשור לגורם 2 (Nrf2) באמצעות חלבון 1 (KEAP1) הקשור ל- ECH [מקור]. ראה כי הגלוטמין נדרש במלואו להשראת IL-4 של הפעלה חלופית של מקרופאג [מקור1, מקור2]. ליו ושות' (Liu, et al). [מקור] דיווחו על α-ketoglutarate,אחת משתי נגזרות קטון של חומצה גלוטרית, שנוצר באמצעות הגלוטמינוליזה, ומקדם התמיינות של מקרופאג M2. דווח עוד, כי PPARγ נדרש לביטוי גנים המושרים על ידי IL-4 וגירוי של נשימת מקרופאגים וחמצון גלוטמין [מקור]. תכונת חילוף החומרים של מקרופאג משתנה בהתאם למיקרו-הסביבה הספציפית של הרקמות בן הוא פועל, ויש לכך חשיבות קריטית לתפקוד המקרופאג שנמצא ברקמות האלו. הצפק (The peritoneum) הוא קרום נסיובי דק ושקוף העוטף את דופנות חלל הבטן ואת חלקם הגדול של האיברים בחלל הבטן. צפק זה עשיר בגלוטמט, תוצר של מטבוליזם של גלוטמין המשמש מקרופאג שם בכדי לגרום לשינויים מטבוליים ספציפיים תחת חישה מיקרוביאלית [מקור]. ככלל, מטבוליזם הגלוטמין בהחלט ממלא תפקיד חשוב מאוד כתומך סינרגטי ומאפנן את הפעלת המקרופאגים.
לימפוציטים Lymphocytes תאי T, תאי B ותאי NK – גלוטמינוליזה
לימפוציטים הם הסוג השני בשכיחותו מכלל תאי הדם הלבנים – מדובר בשם כולל לשלושה סוגי תאי לחמה שפועלים בעיקר בלימפה ומכאן גם שמם: תאי T, תאי B ותאי NK הפעלת הלימפוציטים נסמכת על מסלולים מטבוליים ספציפיים כדי לייעל את תפקודה [מקור1, מקור2] לימפוציטים מגיבים למגוון רחב של גירויים באמצעות הפעלת מסלולי איתות תאיים, אשר בתורם מובילים לשגשוג הסלולר הזריז בתא, הגירה והבחנה, כולל ייצור ציטוקינים. אירועים אלו קשורים באופן הדוק לצב האנרגיה של התא, ולכן המסלולים מייצרי האנרגיה שלו עשויים לתת רמזים וצפי לגבי הפונקציונליות הכללית של תאי הלחימה האלה [מקור]. הראשון לדווח על שימוש של גלוטמין כמקור אנרגיה על ידי לימפוציטים היה אריק ניוזהולמה (E A Newsholme) [מקור].
גלוטמין משמש את הלימפוציטים – ויותר מכך מסתבר שהוא מנוצל על-ידם בשיעור גבוה (פי ארבעה מזה של גלוקוז, כמקור ידוע של אנרגיה) בהמשך הם מייצרים גם גלוטמט, אספרטט, לקטט ואמוניה. מסלול חילוף החומרים של גלוטמין כולל את התגובות המזרזות על ידי גלוטמינאז, אמינוטרנספרז אספרטט, אוקסוגלוטראט דהידרוגנאז, סוקסינט דהידרוגנאז, פומאראז, דהידרוגנאז מלט ופוספנולפירובאט קרבוקסיקינאז. -CoA לחמצון מלא. חמצון הגלוטמין כאן חלקי בלבד, ומקביל למונחים שמשמשים לתיאור מסלול החמצון החלקי של גלוקוז ללקטט כגליקוליזה, כאשר המונח גלוטמינוליזה משמש לתיאור תהליך חמצון הגלוטמין החלקי. תפקידה של הגלוטמינוליזה בלימפוציטים ואולי בתאים המתחלקים במהירות לספק גם חנקן ופחמן לשימוש תהליכי הסינתזה של מקרומולקולות (למשל פורינים ופירימידינים ל- DNA ו- RNA) וגם לאנרגיה. מסתבר כי רוב האנרגיה לתהליך זה בלימפוציטים מסופק להם על ידי חמצון מלא של חומצות שומן וגופי קטון [מקור]. השיעורים הגבוהים האלו מעניקים תנאים אידיאליים ומאפשרים שליטה מדויקת ורגישה בקצב השימוש של חומרי הביניים של מסלולים אלה לביוסינתזה כאשר היא נדרשת על-ידי הגוף בכדי להפוך יותר גלוקוז או גלוטמין לזמין עבור תאיו [מקור]. תהליך התפשטות התאים דורש הן ATP להוצאה אנרגיה גבוהה והן כמבשרי ליוסינתזה של מולקולות מורכבות, כגון שומנים (כולסטרול וטריגליצרידים) ונוקלאוטידים לסינתזת RNA ו- DNA. כדי לבצע פעילות של התפשטות מהירה תחת כנדרש, הלימפוציטים עוברים מזרחון חמצוני לגליקוליזה אירובית בתוספת גלוטמינוליזה, וכך הם מגדילים באופן ניכר את ניצול הגלוקוז והגלוטמין כספקי אנרגיה.
החלפת גלוקוז על ידי גלוטמין, גלוטמין וריבוז, או גלוטמין ואורידין מונעת זירוז אנזים גליקוליטי (glycolytic enzyme) – במסלול הגליקוליזה היא רצף של עשר תגובות המזרזות על ידי אנזימים, גליקוליזה היא המסלול המטבולי שאינו דורש חמצן. ברוב האורגניזמים, הגליקוליזה מתרחשת בחלק הנוזלי של התאים, בציטוזול. הסוג הנפוץ ביותר של גליקוליזה הוא Embden – Meyerhof – Parnas (EMP) כאן אנו מתבוננים במסלול שממיר גלוקוז C6H12O6 לחומצה פירובית, CH3COCOOH. ולהתפשטות תימוציטים (thymocyte). המעבר ממטבוליזם אירובי למטבוליזם אנאירובי מתרחש כאשר תימוציטים שמופעלים על ידי מיטוגן (מיטוגן הוא פפטיד או חלבון קטן המניע תא להתחיל בחלוקת תאים) עוברים התפשטות. [מקור] ניצול הגלוקוז ויצירת הלקטט עולה פי 18 ו -38 פי, בהתאמה, במהלך ההתפשטות. הכמות המוחלטת של ייצור 14CO2 על ידי פירובט דיהידרוגנאז נשארת קבועה, בעוד ייצור 14CO2 על ידי מחזור החומצה הטריקקרבוקסילית מופחת במהלך המעבר ממצב מנוחה למצב מתרבים. תוספת של 2,4-דיניטרופנול, אשר מנתק זרחון חמצוני, ופנאצינמתוסולפט, מקבל אלקטרונים, ואספקה של ADP. ההתחדשות הציטוזולית משתפרת NAD+ על ידי ואינדוקציה של האנזימים הגליקוליטיים במהלך התפשטות שמתחרה ביעילות בתחבורה של החנקן NADH ובחמצון שלו לאחר מכן במיטוכונדריה. תימוציטים שעוררים מיטוגן במדיום קונבנציונאלי המכיל גלוקוז. הם מעוררים אנזימים הגליקוליטיים שלהם פי 8-10 בשלב S של מחזור התא ומתחלקים בתוך תקופה של 72 שעות. כנזכר לעיל, החלפת גלוקוז על ידי גלוטמין, גלוטמין וריבוז, או גלוטמין ואורידין מונעת זירוז אנזים גליקוליטי והתפשטות תימוציטים. לא ניתן לחקות את השפעת הגלוקוז על אינדוקציה של אנזים גליקוליטי על ידי 3-O-methylglucose או 2-deoxyglucose. ניכר כי גלוקוז נדרש להתפשטות והזרמת האנזים הגליקוליטי שמתווך את המעבר מייצור אנרגיה חמצוני לגליקוליטי. במהלך המעבר G1/S של תימוציטים כפי שמלמד המחקר הניסוי [מקור]. גריינר (Greiner), ושותפיו למחקר מדווחים כי השימוש במסלול הגליקוליטי האנאירובי מאוד גדל לאחר גירוי אנטיגני עם קונקנאוואלין (ConA) בתימוציטים שנחקרו במעבדה על בעלי-חיים (חולדות) [מקור]. הראשון לדווח על שימוש של גלוטמין על ידי לימפוציטים היה כנזכר למעלה אריק ניוזהולמה (E A Newsholme), [מקור]. נמצא כי גלוטמין נדרש לתהליך התפשטות תאי ה- T ו- הB-של הלימפוציטים, כמו גם לסינתזת חלבונים, ייצור IL-2 נוגדנים המוצגים על ידי התאים האלה. בנוסף לכך הצטברו ראיות שמצביעות על כך ש
חילוף החומרים של גלוטמין ממלא תפקיד מרכזי בהפעלת לימפוציטים.
הגם שהביוכימיה של התמיינות הלימפוציטים מסוג B באדם לתאי פלזמה אינה מובנת לחלוטין [מקור]. גלוטמין נדרש להתמיינות הלימפוציטים שפועלים להגנת גוף האדם ופועלים בתאי הפלזמה שלנו וכן ליצירת תאי פלזמה בתרבויות תאים חד-גרעיניות של דם היקפי ולטרנספורמציה לימפובלסטית [מקור1, מקור2].
הגליקוליזה ממלאת תפקיד חשוב בתפקודי תאי T הקשורים לייצור ציטוקינים דלקתיים, בעיקר INF-γ ו- IL-2 [מקור]. תוצריו של גליצראלדהיד 3-פוספט דהידרוגנאז ( glyceraldehyde 3-phosphate dehydrogenase GAPDH) mRNA על ידי שימוש ב- siRNA מקדם הפחתה של INF-γ בלימפוציטים [מקור]. לכן הפעילות הגליקוליטית הגבוהה קשורה כאן בקשר הדוק להתמיינות של תאי Th0 לתאי Th1 [מקור].
עיכוב המסלול הגליקוליטי שמתרחש כאן חוסם את התהליך הזה אבל מתרחש מסיבתו תהליך אדיר וחשוב ביותר – כי חסימתו מקדמת התמיינות לתאי Treg. הם תת-אוכלוסייה מיוחדת של תאי T הפועלים לדיכוי תגובה חיסונית, ובכך שומרים על הומאוסטזיס. והרי כבר הוכח כי Tregs מסוגלים לעכב ריבוי תאי T וייצור ציטוקינים ולמלא תפקיד קריטי במניעת אוטואימוניות נושא שנקשר בסובלנות עצמית
[מקור]. הגליקוליזה שמוגברת על ידי תאים מתרבים, קשורה לספיגה מוגברת של גלוקוז ולהגברת הביטוי והפעילות של אנזימים גליקוליטיים, ואילו ניצול הגלוקוז במסלול הזרחון החמצוני (OXPHOS) יורד. לכן, "המתג המטבולי" עומד בדרישות הגוברות ליותר אנרגיה, ומייצר חומרי ביניים מטבוליים הנדרשים לביוסינתזה של מקרומולקולות ומדכא את התכונות המטבוליות של לימפוציטים במנוחה. אספקה קטנה מדי או לא מספקת של חומרים מזינים או עיכוב מטבולי ספציפי מונע הפעלה והתפשטות של תאי T מאחר וחוסר היכולת להשתמש בגלוקוז מעכב את התמיינות תאי T במבחנה וב in vivo [מקור1, מקור2, מקור3]. הדינמיקה המיטוכונדריאלית קשורה קשר הדוק עם חילוף החומרים (סדרה של תגובות כימיות, מזורזות על ידי אנזימים) ותפקוד הלימפוציטים מסוג T. תאי T מפעילים ומופעלים מנקבים את המיטוכונדריה (הערה בנושא למטה) ומגדילים כך את הפעילות של מסלולים אנבוליים (מסלולים אנבוליים הם תגובות כימיות שלוקחות מולקולות קטנות ופשוטות, ומפיצים אותן לאלמנטים גדולים ומורכבים יותר, כדי שהתגובות האלה יתקיימו, חייבת להיות אנרגיה זמינה. נושא ששב ועלה למעלה) ואילו לימפוציטים מסוג memory T מפעילים מסלולים קטבוליים, גם הם מתבצעים על מנת להשיג אנרגיה וצמצום כוח כמו חמצון חומצות שומן (FAO). [מקור1, מקור2]. HIF1-α ממלא תפקיד מרכזי בהתבגרות התאים הדנדריטים והפעלתם של תאי T. גורם זה שולט בתכנות מחדש של חילוף החומרים של הלוקוציטים, באמצעות שינויים בביטוי הגנים, ובכך תפקודי תאי החיסון [מקור]. עולה מכאן שגליקוליזה וגלוטמינוליזה קשורים קשר הדוק שמבטיח תפקוד תקין של הלימפוציטים. הגלוטמין משמש גם כמבשר לסינתזה של פוטרסין ופוליאמינים. רמות גבוהות של פוליאמינים בתאי גידול ובתאי B ו- T במחלות אוטואימוניות, נמצאו כממלאים תפקיד בבקרה על תפקוד תאים חיסוניים תקינים ונקשרו עם אוטואימוניות ותכונות חיסוניות של תאים חיסוניים [מקור].
הערה: מיטוכונדריות מנוקדות – punctate mitochondria המיטוכונדריה היא אברון דינמי בתא שמסוגל לווסת את גורל התא, הומאוסטזיס שלו, ואת כושר ההישרדות ועמידתו בפני מחלות בתאים אוקריוטיים – בעלי גרעין [מקור1, מקור2]. היא נקשרת באברונים המטבוליים. למעשה המיטוכונדריה היא מוקד של פעילות מטבולית, בתוך הסביבה הסלולרית, מתרחשות מספר רב של תגובות כימיות. מערכת התגובות הללו היא שמכונה חילוף החומרים, מסלול מטבולי או סדרה של תגובות כימיות. בכלל זה המיטוכונדרית שולטת גם בחילוף החומרים של תאי T. תאי TE Activated effector T (TE) התגלו כמגבירים של מסלולים אנבוליים של חילוף החומרים, כגון גליקוליזה אירובית, וכן שהם מכילים מיטוכונדריה מנוקדות, בעוד שתאי memory T (TM) עוסקים במסלולים קטבוליים, כמו חמצון חומצות שומן (FAO). [מקור1, מקור2, מקור3, מקור4, מקור5] ביקוע מיטוכונדריאלי יוצר מיטוכונדריה נפרדות ומפוצלות שיכולות להגביר את ייצור מיני החמצן הוא דבר טבעי (ROS) [מקור].
הגלוטמין מאוד חשוב לבריאותנו. ככלל יש לבחון את מצב הגלוטמין בבואנו להביא ריפוי למחלות קשות
הגלוטמין מאוד חשוב לבריאותנו. ככלל בתחום הבריאות והמחלות, יש לבחון גם את מצב הגלוטמין. שיעור צריכת הגלוטמין על ידי תאי החיסון דומה או אפילו גדול משיעור צריכתו של הגלוקוז.
מחקרי מעבדה (מחקרי מבחנה) וב in vivo קבעו שגלוטמין הוא חומר מזין חיוני להתפשטות לימפוציטים וייצור ציטוקינים, מקרופאגים פגוציטים וכן לפעילות הפרשה והרג חיידקי נויטרופילים. כולם נדרשים ללחימה במחלות ופולשים זרים.
ברמה הבסיסית ביותר, חומצות אמינו הן אבני הבניין של החלבונים בתאים וברקמות שלנו, ואחרי המים הם התרכובת השנייה בשכיחותה ביונקים. ניתן להשיג חומצות אמינו מחלבונים אנדוגניים ו/או אקסוגניים (כלומר מתזונה), ולזמינותם חשיבות בסיסית להישרדות של תאים, לתחזוקתם ולהתרבותם. בני האדם פיתחו מסלולים ביוכימיים ומטבוליים כדי לשלוט בזיהום פתוגני על ידי הגברת קטבוליזם של חומצות אמינו כדי לסייע לתגובות החיסון, ובכך להגביל את זמינות החומרים המזינים המכילים חנקן למיקרואורגניזמים פולשים [מקור]. מנגנון זה הוא יתרון גם עבור המארח שמאפשר לנו לשלוט בתגובות הדלקתיות לזיהומים.
בין 20 חומצות האמינו המפורטות בקוד הגנטי, גלוטמין מספק את הדוגמה הטובה ביותר לרב -תכליתיות של חילוף החומרים של חומצות אמינו ותפקוד מערכת החיסון.
גלוטמין היא חומצת האמינו הנפוצה והגמישה ביותר בגוף, והיא בעלת חשיבות בסיסית במטבוליזם המתווך, בחילופי חנקן בין -אורגניים באמצעות הובלת אמוניה (NH3) בין הרקמות ולהומאוסטזיס ה- pH. כמעט בכל תא גלוטמין יכול לשמש מצע לסינתזת נוקלאוטיד (פורינים, פירימידינים וסוכרי אמינו), ניקוטינאמיד אדנין דינוקלאוטיד פוספט (NADPH), נוגדי חמצון ועוד מסלולים ביו -סינטטיים המעורבים בשמירה על שלמות התפקוד והתפקוד [מקור1, מקור2].
רוב התאים בגוף מתפקדים עם תחלופה קבועה ו/או אספקה של חומרים מזינים, אולם תאים של המערכת החיסונית לעיתים קרובות צריכים לתפקד תחת מיקרו -סביבה מוגבלת של חומרים מזינים [מקור].
נכון לעכשיו, גלוטמין מסופק באופן שגרתי כמרכיב בתוסף תזונה קלינית לחולים לפני ואחרי הניתוח, וגם לספורטאים מובחרים רבים לשיקום תפקודי החיסון. למרות שישנן עדויות הולכות וגוברות התומכות בהשפעות התיווך החיסוני של תוספי גלוטמין, עדיין נותרו מספר שאלות ושיקולים ספציפיים. לפיכך, אין במאמר זה לראות המלצה ליטול מהם..

במצבים קטבוליים (כשמופרשים הורמונים שנקשרים בסטרס – למשל קורטיזול -) הגלוטמין יכול להיות חיוני לתפקוד מטבולי
שחרור הגלוטמין למחזור הדם והזמינות שלו חשובה ונשלטת בעיקר על ידי איברים מטבוליים מרכזיים, כגון המעיים, הכבד ושרירי השלד. במצבים קטבוליים (כשמופרשים הורמונים שנקשרים בסטרס – במצבים בהם הגוף חווה סכנה כלשהי.) הגלוטמין יכול להיות חיוני לתפקוד מטבולי, אך זמינותו עלולה להיפגע עקב פגיעה בהומאוסטזיס בחילוף החומרים בין הרקמות של חומצות אמינו.
[הסבר קצרצר: קורטיזול הוא הורמון סטרס חזק מאוד והוא מופרש במצבים קיצוניים. הפרשתו מעודדת פירוק של גליקוגן וחלבונים בשריר ובכבד, שומנים, מדכא את מערכת החיסון, גורם למאזן סידן שלילי דרך עיכוב ספיגתו במעי והגברת הפרשתו דרך הכליה (שתן), מגביר פירוק עצם, מגביר את התכווצות הלב ואת יצירת כדוריות הדם האדומות] .
מסיבה זו,
גלוטמין מהווה כיום חלק מפרוטוקולי תוספי תזונה קליניים ו/או מומלץ לאנשים עם דיכוי חיסון לשנות את תפריט התזונה של אנשים שחווים סטרס, עליה בהורמון הסטרס – הקורטיזול – כמו להוסיף מיץ ירוק (חסה, כרוב, חרדל ועלי רוקט) לארוחת הבוקר שלהם.
עם זאת, במגוון רחב של מצבים קטבוליים/היפרקטבוליים (למשל חולים כרוניים, פוסט טראומתים, עם אלח דם, ספורטאים מותשים), כיום מאוד קשה לקבוע האם להמליץ על תוספי גלוטמין (אוראלי/אנטרלי או פרנטרלי) על סמך ריכוז חומצת האמינו פלזמה/זרם הדם (מצב המכונה גם גלוטמינמיה) [מקור] מיץ ירוק תמיד יכול להועיל אלא אם כן יש להוריד גם את חומצת השתן Uric acid.
הגלוטמין והאמוניה
האמוניה קיימת בטבע בשתי צורות הן כ – NH3 והן בצורת יונית של האמוניה כיון אמוניום (NH4+). שתי הצורות נזכרות לאורך כל המאמר אלא אם מדובר באמוניה באופן כללי אז רשום "אמוניה". תגובת הבופר: NH3+ H+ -> NH4+ משמשת לשמירה על הכמות היחסית של כל צורה והגנה על ה – pH. בתנאים ביולוגיים, ה- pKa (אנזים pKa פרוטאין קינאז A מזרחן אנזימים רבים החשובים לתהליכי מטבוליזם.) של תגובה זו הוא בערך 9.15 ותגובה זו מתרחשת כמעט מיידית. כתוצאה מכך, רוב האמוניה בתנאים פיזיולוגיים קיימת כ- NH4+, ורק כ -1.7% מכלל האמוניה מופיעים כ- NH3 ב- pH 7.4 שמכונה בסיסי (בהבדל מחומצי) [מקור]. האמוניה היא חלקיק קטן מאוד, שנמצא בסידור א -סימטרי של יוני מימן טעונים חיובית סביב מולקולת חנקן מרכזית שהופך את מולקולת האמוניה הזו לחלקיק קוטבי יחסית [מקור]. בכליות מזהים חדירות מוגבלת ומינימלית של האמוניה דרך ממברנות השומנים. אפיון חדירות כזו גורמת להתפתחות של שיפוע טרנס -אפיתל (transepithelial gradient of ammonia) של האמוניה בכליות [מקור1, מקור2]. יצוין כי רוב הפרשת האמוניה הכליתית נובעת מייצור תוך -כליתי, ולא מסינון גלומרולרי (נושא זה נמצא בניגוד לרוב המומסים בכליות שמופרשים בסינון גלומרולרי.) [מקור].
מטבוליזם של אמוניה בכליות
ייצור אמוניום מגלוטמין מתבצע בכליות באבוביות המפותלות הפרוקסימליות
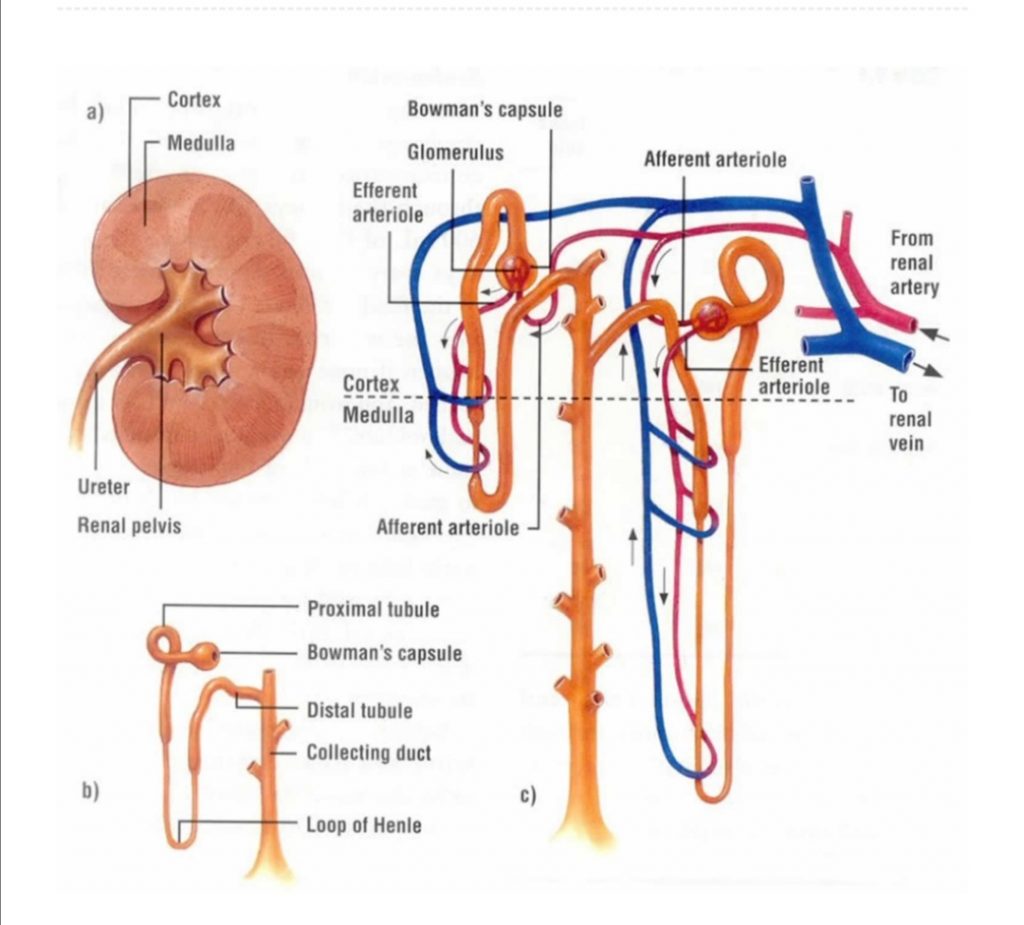
אחת הדרכים (ישנן מספר) שבהן הכליה מפרישה חומצה (וחוסכת נתרן) היא באמצעות ייצור אמוניה מגלוטמין באבוביות המפותלות הפרוקסימליות (the proximal convoluted tubules). באבובית המפותלת הפרוקסימלית, האמוניה שנוצת מופרשת לתוך הנהור הצינורי (בתמורה לנתרן מסונן), שם היא משתלבת עם כלור מסונן ליצירת אמוניום כלוריד (המופרש לאחר מכן). בתהליך זה, אמוניאגנזה, נוצרים גם שלושה ביקרבונטים בתוך התא הצינורי הפרוקסימלי, הם מופרשים לאחר מכן לפלזמה (נוזל הדם) ביחד עם הנתרן (כדי לשמור על אלקטרוניות) עם הטרנספורטר הבזולטרלי NaHCO3. בדרך זו הכליה שומרת על נתרן, מפרישה כלוריד ויוצרת ביקרבונט חדש (x3), וגם נפטרת מחומצה (כאמוניום כלוריד). כך מתמודדת הכליה עם שינויים ב – pH. – מהלך זה נראה היטב באיור שמופיע כאן.
בתנאים רגילים, חילוף החומרים של אמוניה, כולל אמוניאגנזה נטו (ammoniagenesis)הובלת אמוניה של תאי אפיתל כלייתי להפרשתה בשתן כנדרש. כפי שהוזכר למעלה המרכיב הגדול מבחינה כמותית הוא של ביקרבונט חדש שנוצר [מקור1, מקור2, מקור3, מקור4, מקור5].
אמוניאגנזה כלייתית – Renal ammoniagenesis – כלומר ייצור אמוניה בכליה נובעת בעיקר ממטבוליזם של גלוטמין [מקור], המייצר אמוניה וביקרבונת ביחס שווה של 2 NH4 (+) ו- 2 HCO3 (-) עבור כל גלוטמין שעובר חילוף חומרים. הצינורית הפרוקסימלית (the proximal convoluted tubules) היא האתר העיקרי לאמוניאגנזה [מקור], אך ישנן עדויות לאמוניאגנזה על ידי תאי האפיתל של הכליות [מקור]. אמוניה המיוצרת בכליה מופרשת לשתן או מוחזרת למחזור הדם המערכתי דרך הוורידים שבכליות. אמוניה המופרשת בשתן מקדמת הפרשת חומצה;
אמוניה המוחזרת למחזור הדם עוברת חילוף חומרים בכבד
הגלוטמין מוביל את האמוניה NH3 כנזכר לעיל, הוא גם מוביל חנקן ואפילו פחמן [מקור1, מקור2]. הגלוטמין הוא חומצת אמינו l-α המכילה חמישה פחמנים; בנוסף לכך הוא מסווג ביחס ל pH הפיזיולוגי שלו, כחומצת אמינו ניטרלית, בעוד שהוא מסווג מבחינה תזונתית כחומצת אמינו לא חיונית. והוא כנזכר למעלה משמש לסינתזת אוראה בכבד, לאמוניאגנזה כלייתית, לגלוקונאוגנזה בכבד ובכליה, וכדלק נשימתי מרכזי לתאים רבים [מקור]. לגלוטמין יש שתי קבוצות אמינו: קבוצת האמינו (α the α-amino group) וקבוצת האמיד (amide group) שרשרת הצד בהידרוליזציה, ותכונות אלה מקנות לו את התפקיד שהגלוטמין (Gln), מגלם כמוביל חנקן ומוביל NH3 – אמוניה [מקור].
גלוטמין ממלא תפקיד מכריע כנשא חנקן לא רעיל בין האיברים בגוף האדם [מקור1, מקור2, מקור3] [מקור1, מקור2], לפיכך, במצב הצום הרגיל, הכליה נוטלת גלוטמין מזרם הדם
[מקור1, מקור2, מקור3, מקור4, מקור5, מקור6, מקור7,מקור8], למרות שהוכח כי הכליה משחררת גלוטמין בנסיבות מסוימות [מקור1, מקור2, מקור3]. קליטת הכליה של גלוטמין בבני אדם נעה בין 7 ל -10 גרם ליום, כמות השווה 10-15% מכלל הגלוטמין הנמצא בכל הגוף [מקור1, מקור2, מקור3]. לאחר קליטת הגלוטמין מתחיל מטבוליזם (פרוק) בעיקר על ידי האנזים הגלוטמינאז התלוי בפוספט intramitochondrial (EC 3.5.1.2); רק 10% מהגלוטמין הניטל מהדם עוברים מטבוליזם על ידי γ-glutamyl transferase שנמצא בקרום תאי (EC 2.3.2.2) האבובית הפרוקסימלית הדיסטלית של הכליה [מקור1, מקור2 – Figure 1]. תהליך זה (פעילות גלוטמינאז) מניב אמוניה וגלוטמט.
הגלוטמין תורם את האמוניה שבשרשרת הצדדית שלו להיווצרות אוראה (שמסולקת מהגוף במקרה הבריא – על ידי הפרשה שלה על ידי הכליות) ות הפורינים (הדרושים לסינתזה של חומצות גרעין). להמרה של חומצה גלוטמית לגלוטמין, שבה מתווספת קבוצת אמוניה לחומצה גלוטמית (המזרזת על ידי גלוטמין סינתז), יש חשיבות מרכזית בוויסות הרמות הרעילות של אמוניה בגוף.
הגלוטמין שנוצר בגוף האדם בייצור עצמי אך ניקלט בגוף גם מהמזון (שעורה, אפונה, כרוב אדום גם מסלק ועלי תרד) הוא דלק מועדף למעיים [מקור] כמו גם למספר רקמות המתחלקות במהירות, למשל אלה של מערכת החיסון [מקור1, מקור2, מקור3, מקור4, מקור5].
האתר החשוב ביותר לסינתזת גלוטמין בגוף הוא כנראה שריר השלד [מקור]. בתנאים של ביקוש מוגבר, אספקת גלוטמין אנדוגנית יכולה להפוך לגורם מגביל לסינתזת חלבונים ולתהליכים מטבוליים אחרים; מסיבה זו, הגלוטמין מכונה לעתים חומצת אמינו חיונית מותנית [מקור1, מקור2].
במוח היא מומרת לחומצה גלוטמית, אשר יחד עם גלוקוזה מהווה דלק למוח. חשובה מאוד לתפקוד המוח ומגבירה GABA -gamma-amino-buytric-acid. חומצת אמינו הפועלת גם כמעביר בין עצבי. מונעת רמות גבוהות של אמוניה, ומאזנת את רמות הסוכר בדם, שלהם השפעה על תפקודים קוגנטיביים. לחומצה גלוטמית תפקיד חשוב בטיפול ובמניעה של היפוגליקמיה.
הצטברות גלוטמין נצפית במחלת אלצהיימר, מחלת הנטינגטון ובמחלת לו גריג. בנוסף, רמות גבוהות של גלוטמין נקשרו לעלייה ברמת הרדיקלים החופשיים במוח, שפוגעים ביכולתם של המיטוכונדריה בתאי המוח לייצר אנרגיה. פגיעה בייצור זה גורמת לאקסיטוטוקסינים, כמו חומצה גלוטמית, להפוך לרעילים יותר. פגיעה זו קטנה בצורה משמעותית באתלטים פעילים, שכן פעילות גופנית גורמת לצריכת גלוטמין על ידי השרירים [מקור.
למאמרי – להחלים מאלצהיימר – Alzheimer's disease מחלה קשה, שאפשר להשתקם ממנה – כאן
חולשת שרירים, דלדול שרירים לפעמים דורש נטילת תוספי גלוטמין בשל ירידה במאגרי הגלוטמין.
תפקיד הכליה בחילופי גלוטמין בין -אורגניים (GLN) במהלך החמצת (ראו גם Figure 1). סינתזת אוריאה פוחתת במהלך החמצת. אמוניה (AMM) המגיעה מהמעי או מהכליות ונמלטת מסינתזת האוריאה הפרופורלית, נלקחת לאחר מכן ב hepatocytes החיי במסלול הסינתזה של גלוטמין (GS) ליצירת GLN. GLN בתורו משתחרר בחזרה למחזור הדם ולאחר מכן עובר פירוק על ידי גלוטמינאז (G-ase) במעיים ובכליות. במהלך החמצת, יותר AMM נוצר בכליה, וחלק גדול יותר מופרש בשתן.
הכליות ממלאות תפקיד בסינתזה והחלפה בין -אורגנית של מספר חומצות אמינו.
החשיבות הכמותית של חילוף החומרים (מטבוליזם – הוא התהליך שבו הגוף ממיר את המזון והשתייה לאנרגיה בעזרת אנזימים ותהליך ביוכימי מורכב, קלוריות במזון ובמשקאות משולבות עם חמצן כדי לשחרר את האנרגיה לטובת הגוף.) של חומצות אמינו בכליות בגוף אינה ברורה. כאשר בוחנים את תפקיד הכליה בחילופי הבין -אורגנים של חומצות אמינו, בדגש על היבטים כמותיים כולל עיון מעמיק בספרות הרלוונטית (PubMed) שבים ורואים ש
הכליות לוקחות את הגלוטמין והופכות אותו לאמוניה.
ככל שנעמיק בנושא זה, סביר להניח, שנגיע למסקנה החד-משמעית שאין בלתה כי תזונה מיוחדת, ספציפית למחלות החוסר בגלוטמין, מועשרת בארגינין, גלוטמין ודיפפטידים, או תזונה מחלימה: כרוב אדום, שיבולת שועל ושעורה גם שילוב של השלושה היא המנוע ליצירת החלמה.
הפרשת אמוניה באמצעות השתנה היא אמצעי פשוט, טבעי וישיר להפרשת עודף של פרוטונים [מקור], שהם בעיקר אלה שמקורם בצריכת חלבון תזונתי [מקור]. עם זאת, מספר פרסומים סיפקו קווי ראיות [מקור1, מקור2, מקור3, מקור5] לכך שלכליות יש תפקיד חשוב מאוד בחילופי מטבוליטים חנקניים בין איבריים. נתונים אלה מצביעים על כך שתזונה מותאמת במדויק, כלומר יחודית או ספציפית למחלות, ובמקרה זה גם מועשרת בארגינין, גלוטמין דיפפטידים, או שילוב של השניים, לצד משקה כרוב אדום טבעי סחוט חיי – עשויה למעשה להיות הטיפול המטבולי בכליה וכל זאת על מנת להשיג תוצאות ו או השפעות מועילות.
תהליך ההחלפתו של הגלוטמין בכליות והפיכתו לאמוניה רגיש ל- pH ומשמש לשמירה על הומאוסטזיס בסיס חומצי ולהפרשת חנקן בשתן
[מקור]. בדרך זו, חילוף החומרים של גלוטמין ואמוניה בכליות משלים לסינתזת אוריאה בכבד. סיטרולליין, הנגזר מהתמוטטות הגלוטמין במעי, הופך לארגנין על ידי הכליה. לאחר קליטת פנילאלנין בכליות מופיעה שחרור טירוזין סטוכיומטרי, וספיגת גליצין מלווה בשחרור סריני. כמה אוליגופפטידים מנוהלים (למשל, גלוטמין דיפפטידים) מומרים בכליות למרכיבים המרכיבים אותם לפני שניתן יהיה להשתמש בהם בתהליכים מטבוליים. הכליות ממלאות תפקיד חשוב בחילופי הבין -אורגנים של חומצות אמינו. מבחינה כמותית, לכמה חומצות אמינו חשובות הכליות חשובות כמו המעיים בחילוף החומרים המתווך. הכליות עשויות להוות "מתווכים" מכריעים של ההשפעות המועילות של פתרונות האכלה מיוחדים, ספציפיים למחלות, כגון אלה המועשרים בדיפפטידים של גלוטמין ( – glutamine as a dipeptide. dipeptide) [מקור1, מקור2, מקור3]. מושג הדיפפטיד שיך לעולם התעשיה ולתרופות שרבים חולקים על השפעתם לטווחים ארוכים. באמצעותו משתמשים בגלוטמין סינתטי הוא בהבדל מהגלוטטמין הטבעי יציב ומסיס מאוד במצב שהוא מכיל דיפפטידים [מקור]. דיפפטידים – פפטיד הוא שרשרת קצרה של חומצות אמינו המתקשרות זו בזו באמצעות קשרי פפטיד ואילו הדיפפטיד הוא סוג של פפטיד שיש בו שתי חומצות אמינו המחוברות לקשר פפטיד יחיד או חומצת אמינו אחת עם שני קשרי פפטיד. בעוד המונח הראשון רגיל הדיפפטיד הוא מונח ספציפי בו משתמשים לציון שם סוג מסוים של פפטידים. יצוין שהדיפפטידים טבעיים – למשל החלבונים התזונתיים מתעכלים לדיפפטידים וחומצות אמינו בגופנו. יתר על כן, גופנו יכול לספוג דיפפטידים במהירות רבה יותר מאשר חומצות אמינו רגילות. הסיבה לכך היא שקליטתם מתרחשת באמצעות מנגנון נפרד. הוא יתרונו של הדיפפטיד של הגלוטמין מקובל בקרב ספורטאים, אבל לתוסף גלוטמין אין כל השפעה על המערכת החיסונית של האתלטיקה – טוען המחקר [מקור].
הכליה לוקחת את הגלוטמין והופכת אותו לאמוניה.
הכליות מבצעות מטבוליזם לגלוטמין, The kidneys metabolize glutamine בעיקר בטובול הפרוקסימלי, ומפרישות יוני אמוניה כתוצאה מכך, כאשר מכל מולקולה של גלוטמין נוצרות שתי מולקולות של אמוניה ואניון דו ערכי אחד.
אמוניה (NH3) היא ספק חנקן מרכזי בחילוף החומרים בגוף, הנחוץ לסינתזה של חומצות אמיניות. מעבר לאמוניה נוצרת במעי האדם. שם מקורה בפרוק חלבונים מהמזון על ידי חיידקי מעי, אמוניה וספת, נושא מאמר זה מסונטזת בגוף במטבוליזם של חומצות אמיניות כמו חומצה גלוטמית, כלומר מגלוטמין או בריאקציה בה אדנוזין מתפרק על ידי האנזים Adenosine deaminase והופך ל-Inosine ולאמוניה. בכבד אמוניה הופכת לשתנן (Uric acid) בסדרת ריאקציות במסגרת מעגל האוריאה. אמוניה זו באה לשמור על איזון חומצה/בסיס – PH. האנזים גלוטמינאזה מפרק גלוטמין ליצירת חומצה גלוטמית ואמוניום (+NH4) בהמשך מופרש אמוניום בשתן מה שמפחית את מאזן החומצה בדם.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
מאמרים אחרונים
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- הפרעה אנדוקרינית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- מחסור בברזל
- מה הם בקע (קִילֶה) חתך, מדוע הם מתרחשים ומה לעשות?
- קרום התא – הממברנה והדלקת הכרונית
- אי ספיקת כליות – טיפול ללא תרופות
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- אילוף הכליות הסוררות
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- מזון כתרופה
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- תזונה תאית
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- להתסיס שיבולת שועל – מתכון וכל הסודות
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- להתסיס שיבולת שועל – מתכון וכל הסודות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- תרופה ישראלית חדשה לקורונה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – על השעורה (דגן) ופעולות נוגדות דלקת כולל עיכוב גורם נמק גידול אלפא – Tumor necrosis factor alpha (TNF-α).
- על הנקמה ודמימותיה
- גודש נוזלים בריאות – בקרב חולי כליה
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
- קטואנאלוג ketoanalogue
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- חרדה
- מגילת רות האלמנה שיצאה ממרחב הנוחות
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה – סדרת מאמרים.
- למה אני לא מצליח להתמיד – והסוכר
- על ההזנחה –
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- חזרה לבסיס – עקרונות צירופי המזון
- ניתוק רגשי – על הקורוציונה
- די לכאב
- ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
- התודעה השלילית
- ביקורת מבזה
- תרופה ישראלית חדשה לקורונה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – על השעורה (דגן) ופעולות נוגדות דלקת כולל עיכוב גורם נמק גידול אלפא – Tumor necrosis factor alpha (TNF-α).
- על הנקמה ודמימותיה
- גודש נוזלים בריאות – בקרב חולי כליה
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
שעורה ופעולות נוגדות דלקת כולל עיכוב גורם נמק גידול אלפא – Tumor necrosis factor alpha.
על הנקמה ודמימותיה
If you have any questions left –
I'd be happy to answer any questions.
For a direct application form to Yaron Margolin – please click here
Recent Articles
- The day will come when we will sit in front of the fireplace-
- Of sexual desire and the wish for intimacy and the two different languages in which they materialise:
- Six degrees of guilt
- Kidney Failure Taming the Rogue Kidneys Vital Information
- קטואנאלוג ketoanalogue
- תרופה ישראלית חדשה לקורונה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- על הנקמה ודמימותיה
- גודש נוזלים בריאות – בקרב חולי כליה
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- גודש נוזלים בריאות – בקרב חולי כליה
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- אילוף הכליות הסוררות
- The day will come when we will sit in front of the fireplace-
- Of sexual desire and the wish for intimacy and the two different languages in which they materialise:
- Six degrees of guilt
- Kidney Failure Taming the Rogue Kidneys Vital Information
- עשרת המזונות הבריאים ביותר לחולי כלייה – שיבולת השועל וה β- גלוקנים חלק – 6.
- עשרת המזונות הבריאים ביותר לחולי כלייה – צרור נבטי הברוקולי והסולפורפאן חלק – 5.
- עשרת המזונות הבריאים ביותר לחולי כלייה – קסמי הכוסמת – המטפלת של דפנותה העורקים – 4
- עשרת המזונות הבריאים ביותר לחולי כלייה – תפוח האדמה והבוטיראט. 3.
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- The day will come when we will sit in front of the fireplace-
- Of sexual desire and the wish for intimacy and the two different languages in which they materialise:
- Six degrees of guilt
- Kidney Failure Taming the Rogue Kidneys Vital Information
- עשרת המזונות הבריאים ביותר לחולי כלייה – שיבולת השועל וה β- גלוקנים חלק – 6.
- עשרת המזונות הבריאים ביותר לחולי כלייה – צרור נבטי הברוקולי והסולפורפאן חלק – 5.
- עשרת המזונות הבריאים ביותר לחולי כלייה – קסמי הכוסמת – המטפלת של דפנותה העורקים – 4
- עשרת המזונות הבריאים ביותר לחולי כלייה – תפוח האדמה והבוטיראט. 3.
- עשרת המזונות הבריאים ביותר לחולי כלייה – החסה
- עשרת המזונות הבריאים ביותר לחולי כלייה. 1
- הערכות שונות במדידת אשלגן בפלזמה שוללות לפעמים שלא בצדק יתר אשלגן בה – היפרקלמיה פסאודו היפרקלמיה – Hyperkalemia
- מדד חדש לבריאותך – ביטול האסרוסקלרוזים
- אי ספיקת כליות – טיפול ללא תרופות
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
מבוא לפסיכותרפיה מכלולית והוליסטית
הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
מגילת רות האלמנה שיצאה ממרחב הנוחות
יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
מעגל המוזר – התפתחות ה"אני" בשנה התשיעית לחייו
איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
למה אני לא מצליח להתמיד – והסוכר
גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
חזרה לבסיס – עקרונות צירופי המזון
ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
איך לצאת ממצבי תקיעות בחיים – שיטת שלוש השאלות בגובה העיניים
על היכולת להשתקם, לקום מאבק הדרך ומכאב הפרידה
ריגוש רעיוני או התקווה והדופמין – יחשפו בפניך כל הסודות שבהתמכרות שבהמתנה – ריגוש, המתנה, תקוה ודופמין – המאמר כאן.
מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה – סדרת מאמרים.
שלושת המיצים
לחלק הראשון הבצל והפלפלים
לחלק השלישי – תפוח אדמה והבוטיראט
לחלק החמישי – נבטי הברוקולי וחלבון הנעורים
לחלק השישי – שיבולת השועל והבטא קלגן
לחלק השביעי – על האצות והפוקוקסנטין
עשרת המזונות הבריאים ביותר לחולי כלייה. 1
מדד חדש לבריאותך – ביטול האסרוסקלרוזים
אי ספיקת כליות – טיפול ללא תרופות
אוראה – למה האוראה מוגברת ומופחת בדם Urea
הקורטיזול וכאבים בבית החזה וביד שמאל
להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
-אי ספיקת כליות להחלים ללא תרופות – על הGFR ונזקי התרופות
ההומוציסטאין – האויב הגדול של האנדותל ובריאות העורקים
אי ספיקת כליות – אילוף הכליות הסוררות – כל מה שחשוב לדעת – חלק ג
אריתרופויטין (EPO) Erythropoietin
רוצה להחלים מפגיעה במערכת העיכול ללא תרופות?
להחלים בפשטות ממחלת ריאות חסימתית כרונית
שחיקת סחוס, למה לסבול? – ללא ניתוח ללא תרופות – טיפול להחלמה
עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
ההומוציסטאין – האויב הגדול של האנדותל ובריאות העורקים
פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
התרופות והרע – ביוטין B7 ויטמין H
על לחם חוקם של עסקים – מה באמת חשוב לדעת בכדי להצליח (פרק א')
טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
חזרה לבסיס – עקרונות צירופי המזון
ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
מגיע לי – העדר הכרה במאמץ של השועט קדימה, בהחלט יכול להוביל לכישלונה של קריירה מזהירה.
סוכרת כלייתית (נפרופתיה סוכרתית) כן, אפשר להחלים".
כאבי גב – פתרון טבעי, עדין ופשוט לבעיה שלך
כאבי גב לא דורשים ניתוח – רק מגע יד עדינה
צום חי – הוא תרופה טבעית. אזהרה לקטונים (Lactones) –
אי ספיקת כליות מתוקה: (נפרופתיה סוכרתית) אפשר לצאת בשלום מהצרה המסוכנת לסוכרתיים – צום חי
אי ספיקת כליות – מתכונים לדיאטה מאוזנת – טעימה להשתגע.
אילוף הכליות הסוררות – איך להחלים מאי ספיקת כליות להקליק כאן
"אילוף הכליות הסוררות" תחילת פרק א
ההמשך לפרק א' של "אילוף הכליות הסוררות"- כאן.

I have read so many posts about the blogger lovers however this post is really a good piece of writing, keep it up
you are really a excellent webmaster. The web site loading speed is incredible. It sort of feels that you are doing any unique trick. Furthermore, The contents are masterpiece. you have performed a great process on this topic!
I really like your blog.. very nice colors & theme. Did you design this website yourself or did you hire someone to do it for you? Plz respond as I'm looking to design my own blog and would like to find out where u got this from. appreciate it
whoah this blog is wonderful i really like reading your articles. Keep up the great paintings! You realize, a lot of people are hunting round for this info, you could help them greatly.
I have read so many posts about the blogger lovers however this post is really a good piece of writing, keep it up
whoah this blog is wonderful i really like reading your articles. Keep up the great paintings! You realize, a lot of people are hunting round for this info, you could help them greatly.
I have read so many posts about the blogger lovers however this post is really a good piece of writing, keep it up
"Al-Ahliyya Amman University
thats my deepest pleasure to read your comments to the yaronmargolin.com website! We will recommend you to all of our clirnts! Thank you and hope to see you on our website again!