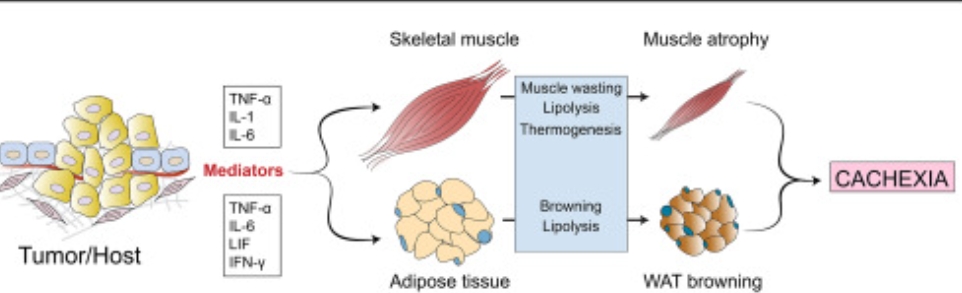
קכקסיה (כיחשון – Cachexia) היא תסמונת של בזבוז משאבים גופניים הקשורה למספר מחלות כולל מחלת כליות כרונית (CKD) סרטן ואי ספיקת לב. הוצאה מוגברת של אנרגיה בסיסית בהפרעות אלו מובילה לבזבוז של רקמת השומן ושריר השלד באמצעות קטבוליזם משופר של שומן וחלבונים נושא שניכר בעליה לא מוסברת של מדד האוראה והקריאטינין בגוף.
"קכקסיה" (Cachexia) היא מושג חדש יחסית בעולם הרפואה, התסמונת מוגדרת כירידה בלתי רצונית, של כחמישה אחוזים במשקל הגוף וירידה בחוזק השרירים על פני תקופה של שישה חודשים לפחות. מסת השומן בגוף יורדת, ואיתה גם יורקת מסת השריר, בדומה למה שקורה בקבוצה מחלות הקרויות "תסמונות הידלדלות". החולים נחלשים ומידלדלים, וגם ההשפעות הפסיכולוגיות של המצב עליהם ועל משפחותיהם גדולות מאוד [מקור].
למעלה ממחצית החולים בשלבים הסופניים חווים אותה, בעיקר בקרב חולי כליה שהחלו דיאליזה, בקרב חולי סרטן הלבלב ובסרטני מערכת העיכול. קכקסיה נחשבת לגורם התמותה הישיר בכשליש מהמקרים ובכ 75% מהמתים בדיאליזה מתים מ קכקסיה. מחקרים קליניים מעידים שהקכקסיה עלולה להפריע לטיפולים ולפגוע ביכולת החולים לעמוד בהם [מקור].
אחת התופעות החידתיות בנוגע לקכקסיה היא שלא עוזר ללוקים בה, גם אם הם מגבירים את צריכת הקלוריות, להשיב לעצמם את משקלם. סטרואידים וקנביס רפואי מגבירים את התיאבון, אך ככל הידוע הם לא משפיעים לטובה על מסת השומן והשריר. כיום, למרבה הצער, אין לרפואת הממסד טיפול לבלימת התופעה, בוודאי שלא להחלמה ממנה. ובעקבות מיעוט המחקר הבסיסי חסרים גם מחקרים קליניים שיסייעו למבקשים להשתמש במזון כתרופה. למרות זאת, בשנים האחרונות היא מתחילה לקבל את תשומת הלב הנחוצה.
קכקסיה היא תסמונת בזבוז משאבים ללא צורך שקשורה לבזבוז של רקמת השומן ושריר השלד באמצעות קטבוליזם משופר של שומן וחלבונים [מקור] . כמחצית מכלל חולי הסרטן סובלים מקצ'קסיה [מקור]. עד 75% מחולי CKD שעברו טיפול בדיאליזה דווחו כמי שמראים סימני בזבוז [מקור1, מקור2]).
Cachexia מובילה לתוצאות גרועות ומהווה גורם סיכון ממשי לתמותה.
קצ'קסיה שונה מאוד מתת תזונה מכיוון שלא ניתן להתגבר עליה באמצעות תוספי תזונה [מקור1, מקור2].
קולטן PTH/PTHrP מתווך במחלת הקכקסיה במודלים של אי ספיקת כליות וסרטן
פרופ' ד"ר סרקן קיר (Dr. Serkan Kır) מאוניברסיטת טקסס בדאלאס שהצטרף לאוניברסיטת קוץ' (2017) בתור פרופסור במחלקה לביולוגיה מולקולרית וגנטיקה. מומחה בינלאומי בנושא השפעות שליליות של גידולים על חילוף החומרים של המארח, היפר-מטבוליזם שמונע על ידי גידולים ואובדן רקמות השומן והשלד פרסם מאמר מפתח בשם: "PTH/PTHrP Receptor Mediates Cachexia in Models of Kidney Failure and Cancer" בשנת 2015 ( Published online 2015 Dec 6. קולטן PTH/PTHrP מתווך במחלת הקכקסיה במודלים של אי ספיקת כליות וסרטן) בו בן השאר מסביר פרופ' ד"ר סרקן קיר (וחבר שותפיו למחקר) כי הם זיהו חלבון הקשור להורמון הפארתירואיד: פפטיד דמוי הורמון פאראתירואידי (PTHrP), הוא פוליפפטיד קטן ש"מחקה" חלקית את פעולת ההורמון PTH, וגורם לסיבוכי היפרקלצמיה (יתר סידן בדם) יתכן שבקשר לתופעות ממאירויות שונות. נושא זה מעלה את התגליות של Fuller Albright אנדוקרינולוג אמריקאי שתרם תרומות רבות לתחום חילוף החומרים של סידן. בשנת 1941 אולברייט פרסם ב ב-N Engl J Med פרשת מקרה של מטופל שלו עם קרצינומה גרורתית של הכליה במקרה שתיאר נמצאה רמת סידן גבוהה במיוחד. אולברייט קידם את הבנתנו בנושא ותרם תרומה עצומה להבנה של הפרעות הקשורות לאנורמליות של סידן ופוספט בגוף [מקור]. אולברייט יצא מהנחה שגידולים מסוימים יכולים לגרום להיפרקלצמיה, על ידי שהם
מפרישים PTH או גורמים דמויי-PTH, כגורם לביטוי גנים תרמוגני ולבזבוז שמתרחש במאגרי רקמת השומן (Kir et al., 2014) [מקור].
מחקר פורץ דרך זה, מעורר תקווה בקרב המטפלים שמבקשים החלמה ולא רק למכור רצפטים וכן בקרב חולים שמבקשים להיאבק על החלמה כי
נטרול של PTHrP על ידי נוגדן ספציפי פחת הבזבוז של רקמת שומן ושריר השלד.
למאמרי – מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
למאמרי – חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
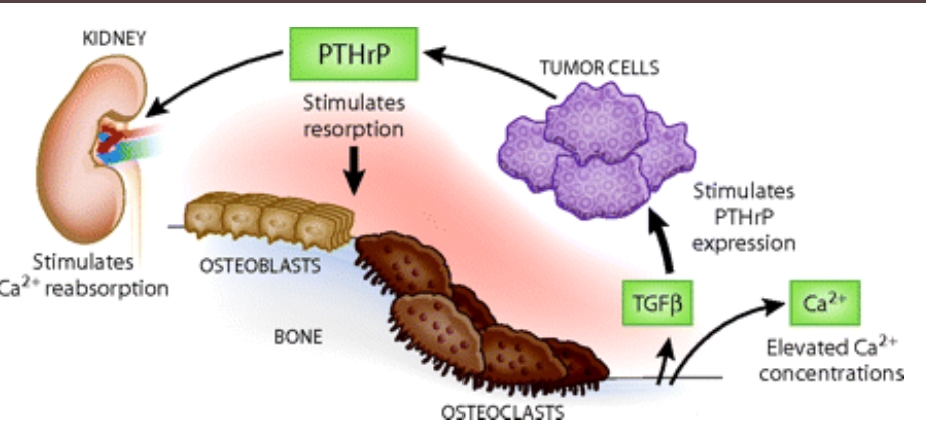
מחקר זה התבצע בחיות מעבדה על עכברים נושאי גידול [מקור]. גילוי הקולטן [חלבון המצוי על קרום תא או בציטופלסמה, שאליו נקשר הליגנד (מולקולה קטנה המבטאת אות כימי שהתא מתוכנן לקלוט).] ל-PTHrP, קידם נושא זה וחשף כי קולטן PTHrP יכול לשמש גם את PTH בפעילותו הביולוגית תוך הפעלה זהה של G-protein (guanine nucleotide-binding proteins – חלבונים השייכים לקבוצת אנזימי GTPases ומשתתפים במסלולי מעבר אותות בתא, שהם מסלולי בקרה תוך־תאיים אשר מופעלים בתגובה לאותות חיצוניים. [מקור] על פי (Jüppner) [מקור], ועל ידי שימוש בעכברי knockout, בהם הוסר קולטן זה התבררה ביתר-שאת החשיבות של PTHrP, כאשר Lanske הראה, בשנת 1998 עם צוות חוקריו ב-Endocrinology שהקולטן ל-PTHrP שימש את שני הליגנדים PTH/PTHrP בפעילותם בשלבים המוקדמים של התפתחות העצם [מקור]. PTHrP מתבטא יתר על המידה על ידי גידולים רבים ונוכחותו במחזור הדם מתאם עם מידה רבה יותר של בזבוז בחולי סרטן גרורתי [מקור]. PTHrP והורמון פארתירואיד (PTH) חולקים את אותו קולטן משטח התא, קולטן PTH/PTHrP או PTHR [מקור]. בעוד שגידולים מפרישי PTH מאוד נדירים, היפרפאראתירואידיזם משני (פעילות יתר הנובעת מרמת זרחן גבוהה או רמת סידן נמוכה, לרוב עקב מחלה כרונית של הכליות.) בעיה זו נצפתה לעתים קרובות בקרב חולי CKD ]מקור1, מקור2, מקור3]. פרופ' ד"ר סרקן קיר מצא כי, באמצעות שימוש בעכברי knockou- שהוסר מהם ה-PTHR קולטן ספציפיים לשומן, נחשף תפקידו של מסלול ה-PTH/PTHrP השומני במחלת הקצ'קסיה שקשורה הן ל-מצבי אי ספיקת כליות מתקדמת CKD בהן נמצא מדד ה- GFR מתחת ל 20 והן למקרי מחלת הסרטן. התוצאות הראו שעכברים חסרי PTHR ברקמת השומן שלהם בריאים. הם פשוט עמידים לקצ'קסיה המונעת מאי ספיקת כליות וגידולים [מקור].
נתונים חדשים חושפים ציר פעולה בעל תפקיד חשוב עבור PTH וקולטן PTH/PTHrP (PTHR) בקצ'קסיה הקשורה ל-CKD. "
[מקור]
כריתת נפרקטומיה – מדדי אוראה עולים באופן בלתי מוסבר
כריתת כליה חד צדדית (כריתת נפרקטומיה) שכיחה כיום. כריתת כליה מבוצעת במטופלים הסובלים מנזק חמור לכליות כתוצאה ממחלה, פציעה, או מצב גנטי ומולד. הכליה הנותרת חווה זרימת דם כלייתית (RBF) מוגברת והיא גם עוברת סינון יתר וכן עובדת ברמה גבוהה יותר כדי לפצות על גזלת הכליה השנייה על נושא זרימת הדם הכלייתית פרסמתי מאמר עומק – אפשר לעיין בו – כאן). יצוין כי זרימת דם מוגברת זו שלילית וקשורה לנזק לפקעית הכליה נזק גלומרולרי [מקור1, מקור2]. הוכח כי זרימת הדם הכלייתית (RBF) לאחר השתלת כליה מנבאת את אובדן השתל [מקור]. לפיכך, מדידת זרימת הדם הכלייתית (RBF) הופכת יותר ויותר בחוגים שלא מצלחים ולא הצליחו לשקם את תפקוד הכליות, לכלי חשוב ביותר. כלי גורלי וכלי זה גם הכרחי לקידום החלמה וכמובן מחקר. בנוסף מסתבר כי כריתת נפרקטומיה קשורה קשר ישיר או גורמת לקכקסיה. כריתת כליות היא מודל ניסיוני נפוץ ברפואת הממסד, אבל תוצאותיו הלא מדווחות בחוצות כשזה כרוך בהסרה של כליה אחת ו-2/3 מהשניה מפחידות אחרי הכול [מקור]. הגיע הזמן לדעתי שהממסד הרפואי יפתח את עיניו לדרכי החלמה המבוססות על מזון כתרופה, שיחות אישיות ו"לחיצות החלמה". עכברים שעברו נפרקטום סובלים מקכקסיה ויש להם PTH מוגבר במחזור הדם שלהם. החוקרים ( פרופ' ד"ר סרקן קיר) השתמשו בכריתת כליה על-מנת להבין, לחקור את התפקידים של PTH בקצ'קסיה הקשורים בפועל במחלת אי ספיקת כליות–CKD. עכברים שעברו נפרקטום פיתחו
אורמיה שהוערכה על ידי זיהוי עליה ברמות חנקן בדם שבאות לידי ביטוי במדדי אוריאה בדם (BUN). בנוסף זוהתה עליה במדדי ה- PTH בדם.
המעונינים יכולים לראות נושא זה בטבלא – כאן.
.עכברים אלה גם הראו משקל גוף מופחת בהשוואה לקבוצת הבקרה
PTH ממריץ אם כן ביטוי של גנים תרמוגנים ברקמות שומן. עלייה ב-PTH במחזור הדם עשויה לגרום לתרמוגנזה בשומן.
מתייחס לתהליך ייצור החום בתוך הגוף [מקור].
כדי לבדוק את הקשר בין ביטוי גנים תרמוגני ברקמות שומן לבין רמות PTH בבני אדם, החוקרים היסודיים שבו ובדקנו חולי היפרפאראתירואידיזם ראשוני (PHPT). נאספו דגימות שומן תת עוריות עמוקות של צוואר הרחם מחולים שעברו כריתת בלוטת התריס עבור PHPT. ודגימות מקבוצת הביקורת נלקחו מחולים שעברו כריתת בלוטת התריס, עבור פתולוגיות שפירות (כלומר מחלת גרייבס, זפק שפיר וניאופלזמה של תאי הורטל). חשוב לציין, שאף אחד מהחולים לא סבל מפעילות יתר של בלוטת התריס אשר ידוע כמעורב בוויסות תרמוגני. בהשוואת הנתונים: תחילה דגימות שומן תת עוריות ועמוקות של שומן צוואר הרחם מכל החולים ובדקנו רמות mRNA של כמה גנים של סמן שתוארו בעבר על ידי מחקר שבדק ביטוי גנים של אזורים אנטומיים אלו [מקור]. מצאנו שביטוי של UCP1 ו-LHX8 מוגבר בשומן צוואר הרחם העמוק בעוד שהביטוי של LEPTIN ו-SHOX2 מוגבר בדגימות תת עוריות. לאחר מכן השווינו רמות mRNA של גנים תרמוגניים בקבוצות ה-PHPT והביקורת. בעוד שביטוי של גנים אלה בשומן תת עורי אינו שונה בין שתי הקבוצות, זוהה וויסות עלייה משמעותי של CIDEA ו-PGC1A וכן מגמת עלייה לביטוי UCP1 ו- DIO2 בדגימות צוואר הרחם העמוקות של PHPT. לשומן הצווארי העמוק הוכח כבעל מאפיינים של שומן חום ובז' כאחד עם יכולת תרמוגנית משמעותית [מקור]. לכן, סביר להניח מסכם החוקר ש-upregulation של thermogenesis במאגרי שומן כאלה על ידי PTH עשוי לתרום באופן משמעותי להיפר-מטבוליזם – המאמר בשלמותו מובא – כאן. ממצאים נוספים הראו כי PTH ו-PTHrP תלויים לחלוטין בקולטן המוכר היטב PTHR שנדרש להניע את "תוכנית הגנים התרמוגניים" [מקור].
באופן מעניין נמצא כי פעילות גופנית דיכאה את תופעת ההיפר-מטבוליזם ומדדי האוראה הגבוהים בדם. יודגש כי צריכת המזון לא השתנתה – שם
נחשף ציר איתות PTH-PTHR המתווך למחלת הקצ'קסיה באי ספיקת כליות.
ריכוזי הלפטין בסרום גבוהים בקרב חולים עם מחלת כליות כרונית (CKD) ומתואמים עם רמות חלבון תגובתי ב-C, מה שמצביע על כך שדלקת היא גורם חשוב שתורם היפרלפטינמיה ב-CKD.
לפטין הוא הורמון שמקורו באדיפוציטים הפועל כמווסת עיקרי של צריכת מזון והומאוסטזיס של אנרגיה. הוא מסתובב הן כישות חופשית והן כישות הקשורה לחלבון. לפטין משתחרר לדם באופן יחסי לכמות השומן בגוף ומפעיל השפעות מעכבות מתמשכות על צריכת המזון תוך הגדלת ההוצאה האנרגטית. הקולטן ללפטין שייך למשפחת-העל של קולטני הציטוקינים מסוג I ובעל הומולוגיה חזקה לתת-יחידות המשנה של הקולטן IL-6 [מקור]. ציטוקינים מסוג IL-6 ממלאים תפקיד חשוב בוויסות תהליכים תאיים מורכבים כגון הפעלת גנים, שגשוג והתמיינות [מקור], ציטוקינים Gp130 מעורבים בוויסות של תהליכים ביולוגיים רבים, כולל המטופואזה, תגובה חיסונית, דלקת, פעולה קרדיווסקולרית והישרדות נוירונלית. הם מככבים במסלול האיתות gp130/Jak/STAT שבו הקולטן ללפטין מככב כפי שמככבים בו ציטוקינים ורכיבי הקולטנים שלהם.
לפטין משתחרר לדם באופן יחסי לכמות השומן בגוף ומפעיל השפעות מעכבות מתמשכות על צריכת המזון תוך הגדלת ההוצאה האנרגטית. כאשר מאגרי השומן בגוף יורדים, רמות ירידה של לפטין חשות במוח והופכות לעלייה בתיאבון ויעילות מטבולית שנמשכות עד שהמשקל שאבד מתאושש. בנוסף, אותות 'שובע' שקשורים לאכילה עצמה, כגון כולציסטוקינין ופפטיד YY, משתחררים ממערכת העיכול במהלך הארוחה. פפטידים אלו מעודדים תחושת "מלאות" שמקצרת את הארוחה ומעודדת את סיומה [מקור]. גרלין הוא פפטיד מעי נוסף שגדל עם הצום ונחשב כמעורר את תחילת האכילה על ידי גירוי התיאבון [מקור]. שני ההורמונים האלו משתתפים במערכת בקרת ארוחה לארוחה שרגישה בעצמה לשינויים ברמות האינסולין והלפטין. בדרך זו, ניתן להתאים את הגודל והתדירות של ארוחות בודדות כדי למזער שינויים בתכולת השומן בגוף [מקור].
נמצא שהשפעת הלפטין על התיאבון והמטבוליזם תלויה במערכת המלנוקורטין ההיפותלמומית, (ההיפותלמוס), כאשר לקולטן למלנוקורטין-4 (MC-4R), השפעה מכרעת. המלנוקורטינים מפעילים את השפעתם על ידי קשירה והפעלה של קולטני המלנוקורטין במוח. מערכת המלנוקורטין היא אחד הכלים שלנו לווסת את צריכת המזון בדחיפה-משיכה. נושא זה מחזיר אותנו ללפטין כי לפטין, הורמון הגלישה באנרגיה, וגרלין, הורמון הרעב, הם שמווסתים במעלה הזרם של מערכת המלנוקורטין במוח, וכן להפרעות מטבוליות שונות ולדיכוי תפקוד מערכת החיסון. על נושא זה הנכלל במנגנון הפעולה של המתג במוח האחראי על תחושת השובע, פרסמתי מאמר עומק, אותו אפשר לקרוא וללמוד עוד על נושא ההזנה, הרעב, השובר ודרכים חדשות לטפל בו ללא תרופות – כאן.
הכליות חשובות לסילוק הלפטין ממחזור הדם
ריכוזי לפטין גבוההים בסרום היפרלפטינמיה עשויה להיות חשובה בפתוגנזה של קצ'קסיה הקשורה לדלקת ב-CKD [מקור]. הקכקסיה האורמית נחלשה במעבדה בניסוי בחיות (עכברים) db/db, כשהחוקרים הצליחו לייצר מחסור בקולטן לפטין. בקרב חולי כליה (CKD) נמצאו ריכוזי לפטין גבוהים מהנורמה בסרום. לפטין מתפנה בכליה מהמחזור הגופני על ידי הסינון הגלומרולרי ואחריו הלפטין עובר פירוק מטבולי באבוביות הכליה [מקור]. בחולים עם תפקוד כליות תקין, ישנה צריכת של לפטין על ידי הכליות (נטו) של 12% מהלפטין במחזור[מקור], ואילו בחולי המודיאליזה, רמות לפטין בסרום שנלקחו בחשבון לאינדקס מסת הגוף עלו פי ארבעה בהשוואה לקבוצת ביקורות של אנשים בריאים. לפטין בסרום אינו מסולק ביעילות על ידי המודיאליזה עם ממברנות תאית [מקור]. יתר על כן, שחרור לפטין מרקמת השומן מופחת במצבי חמצת מטבולית [מקור]. לפיכך, נוכחות של חמצת מטבולית בחולי מחלת כליות סופנית עשויה להסוות חלקית את ההיפר-לפטינמיה שלהם. ירידה בפינוי לפטין בפלסמה ב-CKD עשויה להיות חלק מלולאת משוב efferent המווסתת את הביטוי של הגן OB בחולים היפר-לפטינמיים עם CKD מתקדם. יתר על כן, מתאם מובהק בין ריכוזי לפטין ו-חלבון C-reactive (CRP) הודגם גם בחולי CKD, מה שמצביע על כך שדלקת היא גם גורם חשוב שתורם להיפר-לפטינמיה ב-CKD [מקור]. מחקרים אורכיים הראו כי חולי דיאליזה פריטונאלית (או ביטנית (PD) שהראו תסמיני קכקסיה, עם רזון שהלך וגבר במהלך תקופת התצפית, היו רמות חלבון C-reactive (CRP) ראשוניות גבוהות יותר. עלייה משמעותית בריכוזי הלפטין בסרום נצפתה בחולי דיאליזה פריטונאלית (או ביטנית PD שאיבדו מסת גוף רזה, בעוד שלא נצפה שינוי כזה בחולי PD שעלו במסת גוף במהלך התחקיר. נושא זה מצביע על כך שהיפר-לפטינמיה עשויה להיות גורם חשוב לקצ'קסיה אורמית [מקור].
היפר-לפטינמיה עשויה להיות גורם חשוב לקצ'קסיה אורמית [מקור], שנוצרת באמצעות איתות דרך הקולטן ללפטין [מקור].
בניסוי בחיות מעבדה הובהר כי קכקסיה האורמית נחלשה בעכברי db/db, בהם הוסר הקולטן ללפטין [מקור1, מקור2]
למאמרי: חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
תגובת הלחץ נפוצה בקרב חולי כליה. נושא עליו פרסמתי – כאן – כולל תגובה רגשית למחלות קשות מצבי לחץ נפשי: חרדה, דיכאון, אובדן תיקווה ובדידות מובילים למצב קטבולי ולאובדן מסת גוף והאדם עלול להרזות מאוד גם מסיבה זו. מדברים על תגובת הלחץ הגופני לטראומה שמייצרת מצב קטבולי. דלדול מסת גוף (הרזיה) והיא במקרה זה גם עלול להוביל לאי ספיקת נשימה, לירידה בתפקוד החיסוני ולהגברת התחלואה שעוררה בפועל את המצב הנפשי. יש לבחון את האירועים כי מצב זה יכול להוביל לתמותה [מקור1, מקור2, מקור3].
למאמרי דיכאון וחרדה בקרב חולי כליה – כאן
למאמרי – anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה – כאן
למאמרי על הברוקולי והסוּלפוראפן – כאן
איזונים שליליים של רכיבים תוך תאיים ועלייה בקצב הפרשת קריאטינין בישרו את תחילת הקטבוליזם.
קטבוליזם הוא רצף של תהליכים מטבוליים אשר מפרקים מולקולות גדולות. תהליכים אלו כוללים פירוק וחמצון של רכיבי התזונה. מטרת התגובות הקטבוליות היא הפקת אנרגיה ואספקת המרכיבים הדרושים לתהליכים אנאבוליים.
רצף של תהליכים מטאבוליים, אשר סה"כ התהליכים דורשים אנרגיה, במהלכם מתקיימת סינתזה של מולקולות מורכבות מאבני בניין קטנות.
במצבים של ניצול חלבונים, שומן ומאגרי מזון בלתי מוסברים אשר נראים במדדי אוראה וקריאטינין גבוהים (כשהאדם נקי מתרופות ולא נוטל תרופות שמעלות את הקריאטינין דוגמת כדורים ללחץ דם וסוכרת) יש לבדוק אם הקצב המוגבר של הפרשת קריאטינין או אוראה נקשר לניטור קטבוליזם של תאים; באמצעות קשר למידע זה הכולל איזונים של מרכיבי התא (חנקן, אשלגן, פוספט ומגנזיום); קל להגיע בבדיקת דם ולהעריך את היעילות של הטיפול התזונתי כדי להפוך תהליך קטבולי זהלמיטבי יותר[מקור].
קטבוליזם גורם לשחרור חומצות אמינו מחלבונים אנדוגניים, כלומר מתוך הגוף עצמו, ואם הם מתחמצנים, הם מייצרים אוראה כתוצר הקצה העיקרי של החנקן [מקור1, מקור2].
קטבוליזם של חלבון הוא פירוק של חלבונים למונומרים נספגים לצורך פירוק נוסף או הרכבה מחדש. קטבוליזם של חלבון בלומן המעי (חלל המעי) חשוב מכמה סיבות, אחת מהן גיוס חומצות אמינו חיוניות לספיגה. חומצות אמינו חיוניות אינן יכולות להיות מסונתזות בגוף האדם, אך הן נחוצות לביו-סינתזה של חלבונים חיוניים, ולכן המקור היחיד שלהן הוא פירוק פוליפפטיד דרך אנזימי עיכול. תהליך זה מתחיל בקיבה וממשיך במעי הדק. שרשראות חלבון גדולות מפורקות כדי להשאיר בסופו של דבר חומצות אמינו חופשיות שניתן להיספג לדם ולהעביר אותן לתאים שונים ברחבי הגוף לצורך פירוק נוסף [מקור].
בנוסף לאוראה כתוצר הקצה העיקרי של החנקן, ניתן למצוא גם שחרור של מרכיבים תוך-תאיים אחרים (אשלגן, פוספט, מגנזיום) עם סטואכיומטריה צפויה (כמויות וריכוז החומרים המשתתפים בתגובות כימיות) [מקור]. ישנן גם עדויות לשיעור מוגבר של הפרשת קריאטינין בחולים עם פציעה טראומטית; כסמן של קטבוליזם יש השלכות פוטנציאליות על הסכנות של תהליך זה מכיוון שריכוז גבוה יותר של ארגינין עלול להוביל לקצב מוגבר של סינתזה של תחמוצת חנקן, גורם שעשוי להיות בעל השלכות חשובות על ההמודינמיקה [מקור1, מקור2]. לפיכך, המטרה הראשונה היא לקבוע אם מאזנים שליליים של מרכיבים תוך-תאיים יכולים להיות סמנים לקטבוליזם של תאים בקרב חולים קשים.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
מאמרים אחרונים
- קכקסיה – הרזון הקטלני של חולי כליות בדיאליזה
- זרימת דם כלייתית
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- הפרעה אנדוקרינית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון
- מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- חרדה
- מגילת רות האלמנה שיצאה ממרחב הנוחות
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה – סדרת מאמרים.
- למה אני לא מצליח להתמיד – והסוכר
- על ההזנחה –
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- חזרה לבסיס – עקרונות צירופי המזון
- ניתוק רגשי – על הקורוציונה
- די לכאב
- ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
- התודעה השלילית
- ביקורת מבזה
- איך לצאת ממצבי תקיעות בחיים – שיטת שלוש השאלות בגובה העיניים
- נמאס לי מהחיים מה עושים
- על היכולת להשתקם, לקום מאבק הדרך ומכאב הפרידה
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- מדד חדש לבריאותך – ביטול האסרוסקלרוזים
- לראשונה, מדענים הצליחו לתרגם לטקסט את הפעילות המוחית של אדם עם שיתוק שאינו מסוגל לדבר.
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- מחסור בברזל
- קרום התא – הממברנה והדלקת הכרונית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- מהו אימון שלפוחית השתן?
- פסוריאזיס, האם הימנעות מגלוטן מסייעת לחולי הפסוריאזיס
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- על הנקמה – פנטזיות נקמה לאחר חווית אירועים טראומטיים
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 18
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 17
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- גלוטתיון כל האמת
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות – פרק א'
- אכל נקי
- אי ספיקת כליות – טיפול ללא תרופות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- אילוף הכליות הסוררות
- גודש נוזלים בריאות – בקרב חולי כליה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית.
- גודש נוזלים בריאות – בקרב חולי כליה
- דלקת כליות אינטרסטיציאלית – השתמשו במי שעורה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מעגל המוזר – התפתחות ה"אני" בשנה התשיעית לחייו

כתיבת תגובה