
מערכת GH/IGF1 הכוללת בתוכה את המתווך להורמון הגדילה גורם גדילה דמוי-אינסולין 1 (Insulin-like growth factor) ואת הורמון הגדילה (GH) בעלת תפקיד מפתח בהתפתחות תקינה של הכליות, ויסות המודינמי גלומרולרי, כמו גם טיפול במומסים שבנוזלים הצינוריים: נתרן, פוספט וסידן [מקור]. GH ו-IGF-1 ממלאים תפקיד משמעותי גם בהתפתחות מוקדמת של נפרופתיה סוכרתית. נפרופתיה סוכרתית היא מצב בו מתרחש סינון יתר בפקעית שבכליה. בדרך כלל סינון יתר מתרחש בפקעית בשל מחלת סוכרת, בה ריכוז הגלוקוז הגבוה שב ומשבש את המאזן ההורמונלי בגוף – מדובר במחלת כליות שאין לממסד מרפא לה וסופה עלול להיות במוות. במחלה זו נפרופתיה סוכרתית מתרחשת
זרימת יתר בעורקיק האפרנטי (Afferent Arteriole) – שמוביל דם בתוך הכליה אל הפקעית
– נושא זה נקשר בנושא העל: זרימת הדם הכלייתית (RPF) הוא זרימת הדם בתוך אבר הכליה עצמו. עליו פרסמתי מאמר בהרחבה – כאן.
למאמרי על זרימת דם כלייתית, כלומר בתוך הכליה עצמה – כאן.
למאמרי – אילוף הכליות הסוררות – מאמר היסוד להחלמה מאי ספיקת כליות – כאן
במצב זה חורי המסננת שבכליות אלו הם חורים שנמצאים באופן טבעי בדפנות הנימים (להלן-הפוריות, (Pores) מתרחבים, המסננת מתקלקלת גם המטען השלילי הקיים בה באופן טבעי נעלם. במצב זה, החלבון אלבומין, אשר במצב תקין נדחה מדפנות הנימים בגלל שהמולקולה שלו גדולה מדי לפוריות ובגלל מטענו החשמלי השלילי (מינוס דוחה מינוס), מצליח לעבור ולחדור לתוך הכליה. מצב זה רע. הכליה מצליחה אז לסנן חלק מהאלבומין ולהוציאו דרך השתן, אולם חלק ממנו שוקע בכליה. השקעים נכנסים אל המזנגיום (Mesangial cells), הוא רקמת החיבור של הפקעית, וסותמים אותה. בתגובה הגוף מגייס מאקרופאג'ים. מקרופאגים הם תאי ריפוי נפלאים תאי בלען (פגוציט) שמשתייכים למערכת החיסון. המקרופאג'ים חודרים אל המזנגיום להצילו ומנסים לסלק את האלבומין ששקע בו ממנו. פעילות המאקרופאג'ים אינטנסיבית וגורמת להרס המזנגיום, ומבנה הפקעית עצמה. ההמשך גרוע עוד יותר כי הפעילות של הפקעית וגם של המזנגיום נפגעים. לא רק במצב של יתר ריכוז של גלוקוז עקב מחלת הסוכרת
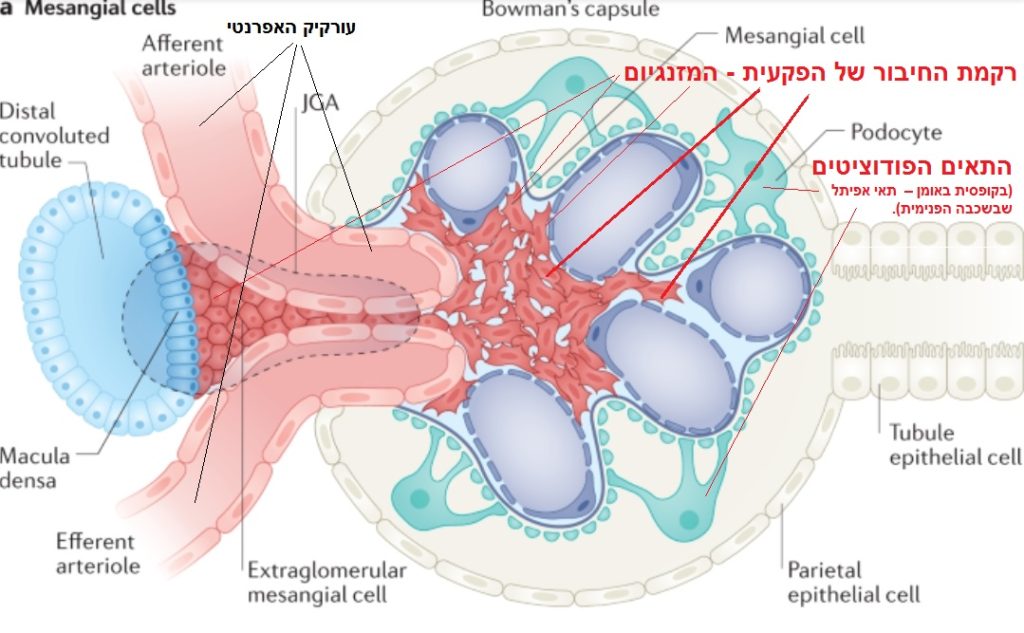
הרס זה מתרחש בכליות גם במצב של חוסר כליה בצד אחד או בהיפרטרופיה של כליות (גדילת יתר או הגדלת יתר) מדובר בזרימת דם יתרה שמתרחשת, הורסת מבני כליה יסודיים (פקעית ורקמת החיבור של הפקעית המזנגיום). גדילת יתר כזו מתרחשת בגופו של תורם כליה לאחר כריתת כליה (חד צדדית) בגופו למתרת תרומה כדי לפצות על העדר בת זוגה שנכרתה.
[מקור1, מקור2, מקור3], דברים אלו יככבו במאמר זה.
השתלת כליה בתקופתנו הייתה להשתלת האיברים הנפוצה ביותר (בארצות הברית). תדירות השתלות הכליה ממשיכה לעלות כל העת וזאת עקב הכישלון העצום של מערכת רפואת הכליות. אנחנו לא שומעים על ריפוי או בלימת המחלה בממסד. כאשר ההשתלה של כליה גם אם היא מאוד יקרה (כ600.000 ש"ח) מציעה שיפור בהישרדות החולה ושיפור באיכות חיים בהשוואה לדיאליזה [מקור]. עידוד החולים להיכנס לתהליכי החלמה מוכחים לא נרשם עדין – ההחלמה אפשרית אבל נושא זה רק הולך ומתרחק מחדרי הדיאליזה וההשתלות – על נושא ההחלמה מאי ספיקת כליות שאפשר לקרוא עוד – כאן, כאן וכאן. עם זאת, השתלה וכריתת כליה נקשרים בסיבוכים שאינם נדירים והמטופלים נתקלים לעתים קרובות בבעיות הדורשות אשפוז, במיוחד בשנה הראשונה שלאחר הניתוח. סיבוכים המתעוררים קשורים בדרך כלל לסיבוכים כירורגיים, תרופות מדכאות חיסון או זיהום עקב דיכוי חיסוני וגדילת יתר של הכליה הנותרת בגוף התורם וישנן גם בעיות נפשיות שנוצרות בעקבות המהלך [מקור]. יש לציין שחלק מהסיבוכים נוירולוגיים, שכיחים, וקשורים לתחלואה ותמותה מוגברת הן בקרב המושתלים והן בקרבם של תורמי הכליות [מקור1, מקור2, מקור3]. נמצא כי תורמי כליה יכולים להיות בסיכון דומה לחולי הכליות והם עלולים לאחר מתן הכליה להגיע בעצמם למחלות כרוניות כרוניות [מקור] סקירה זו דנה באטיולוגיות השכיחות ביותר של סיבוכים נוירולוגיים לאחר השתלת כליה, כולל זיהום, ממאירות, תרופות הקשורות, נוירופתיה חריפה ופתולוגיה נוירולוגית אחרת.
השתלת כליה ממקור אנושי היא חלק מעבודת הממסד הרפואי לכאורה כיסוי על כשל בהחלמת הכליות המקוריות. עבור חולים עם מחלת כליות סופנית (ESRD) שלא מחפשים החלמה ולא מוצאים יכולות להציל את גופם מהמחלה השתלה היא פתרון קסם [מקור1, מקור2]. הבעיה שקיים מחסור בתורמים חיים. בעיה נוספת כאן בגידול העצום בביקוש עקב העלייה בשכיחות המחלה והעדר מסר רחב לגודל הבעיה לציבור. רוצה להגיד שהציבור מכיר את מחלת הסרטן אבל לא מודע כלל לגורלו המר נוכח מחלת הכליות. כשל הריפוי של מחלות הרקע (יתר לחץ דם, סוכרת, אבדן גמישות העורקים, יתר שומנים בדם: טריגליצרידים וכולסטרול) מעורר שכיחות הולכת וגדלה של מחלות כליות כרוניות הקשורות במוות. כאן קסם ההשתלה נכנס לתמונה. הצלת חיים בעזרת תרומת כליה. לפני תרומת כליה, התורמים עוברים הערכות רפואיות מקיפות כדי שיוכרזו כשירים לתרומת כליה, מה שמפחית עוד יותר את מספר התורמים המתאימים [מקור1, מקור2, מקור3, מקור4]. חשוב לדעת כי הצלחת הכליה החדשה אינה מוחלטת וכדאי ללמוד עליה ממקורות מהימנים. בנוסף
קצב הסינון הגלומרולרי (GFR) יורד מיד לאחר כריתת כליה חד צדדית,
וכן מתרחשות עליה מיידיות של זרימת הדם הכלייתית (RPF) [מקור] הן אם מדובר בתורם והן אם מדובר במקבל. לאחר כריתת נפרקטומיה של התורם (במקרה של נזק חמור לכליות, אין ברירה אלא לבצע ניתוח כריתת כליה – מכונה נפרקטומיה.).
רואים עלייה בכמה מדדים שמפצים בכליה שנותרה על כריתת השנייה [מקור] והבולט בהם כנזכר למעלה זרימת הדם הכלייתית RBF [מקור].
הורמון הגדילה (GH) ולמתווך שלו גורם גדילה דמוי אינסולין-1 (IGF-1) הם בעלי השפעות רבות על הכליות [מקור].
IGF-1 הוא פפטיד קטן (משקל מולקולרי 7647) שמווסת את צמיחת התא, כושר הישרדות ואופני התמיינות שלו על ידי פעולה על הקולטן IGF-I, (IGF-IR) [מקור] IGF-1 מסתובב בסרום (בדם) במצב קשור לחלבונים (קושרים שנמצאים בזיקה גבוהה – 99%) וככזה ה IGF-1 מוגדר פפטיד יוצא דופן מכיוון שהוא קשור ביותר מ-99 אחוז לחלבון [מקור]. רוב ה-IGFs בסרום קשורים ל-IGFBP ולתת-היחידה הבלתי-לאבילית לחומצה (ALS), חלבון שמייצב את ה-IGF [מקור1, מקור2], פעולתו של הורמון הגדילה ה-GH מתבצעת על ידי קשירתו לקולטן GH (GHR). מרגע שהוא נקשר אליו הוא מתחיל להפעיל: הוא מעורראת הסינתזה – הייצור העצמי של אינסולין גדילה גורם-1 (IGF1) על-ידי הגוף [מקור].
IGF-1 מסונתז על ידי מספר סוגי תאים תאי גזע (MSCs – mesenchymal cell types) [מקור1, מקור2]. קיימים שני מנגנונים עיקריים של ייצור IGF-1: IGF-1 המסונתז בכבד ומופרש לדם וזה שמסונתז ברקמות היקפיות, ומסתבר שחשיבותו עולה על הראשון בהרבה בנושא דיוננו. הראשון שמיוצר בכבד נמצא בשליטה של הורמון הגדילה – GH, שהוזכר לעיל, וכן Autocrine/paracrine IGF-1 אשר מסונתז ברקמות היקפיות, כגון העצם או תאי לב [מקור]. גם הסינתזה של ה"שני" נשלטת על ידי GH אבל גם על ידי גורמים המופרשים באופן מקומי. כלומר על ידי סוגי התאים שמסביב לאזור הייצור שלו. חלק מה- IGF-1 האוטוקריני/פאראקריני המופרש מברקמות היקפיות נכנס למחזור הדם המערכתי. נושא זה והבנתו מסייעת לפרש שינויים בריכוזי IGF-1 בסרום [מקור]. בנוסף לכך IGF-1 מפעיל את השפעותיו באמצעות הפעלה של הקולטן ל–IGF-1 [מקור]. קולטן זה מופץ באופן נרחב בגוף האדם, מה שמאפשר ל-IGF-1 המועבר בדם לתאם צמיחה מאוזנת בין מספר רקמות ואיברים.
מחקרים אחרונים המשתמשים במודלים של חיות מעבדה (עכבר נוק-אאוט – מחיקת גנים / נוקאאוט פרושו גנים מושתקים [מקור] של רקמה/תא ספציפית וטכניקות תרבית תאים) הוכיחו בבירור ש-IGF-I המיוצר באופן מקומי הוא קריטי יותר (בר השפעה מכריעה בהרבה) מה-IGF-I המערכתי שנוצר בכבד. השפעתו ניכרת בתמיכה ובפיתוח שלד עוברי ואחרי-הלידה בעיצובה של העצם מחדש [מקור].
IGF-1 אוטוקריני/פאראקריני (autocrine/paracrine IGF-1) יכול לעורר צמיחה מקומית, לא מאוזנת ללא תלות ב-GH מערכתית. דוגמאות לסוג זה של ויסות גדילה הן ריפוי פצעים ו
צמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית.
איתות IGF-I/IGF-IR מקומי מקדם את הצמיחה, ההישרדות וההתמיינות של כונדרוציטים (התאים הבוגרים בסחוס) ותאים יוצרי עצם (אוסטאובלסטים), באופן ישיר ועקיף, על ידי שינוי מסלולי איתות אוטוקריניים/פאראקריניים אחרים בסחוס ובעצם, ועל ידי שיפור האינטראקציות בין תאי השלד הללו באמצעים פיזיים והורמונליים. יתר על כן, איתות IGF-I/IGF-IR מקומי רב השפעה על פעולות העצמות האנבוליות של הורמון הגדילה ועל הורמון הפרתירואיד [מקור].
כל תאי השלד, כולל כונדרוציטים (התאים הבוגרים בסחוס), אוסטאובלסטים, אוסטאוציטים ואוסטאוקלסטים, מבטאים רמות משמעותיות של IGF-I, IGF-II ו-IGF-IR [מקור1, מקור2, מקור3, מקור4]. מולקות אלו מהוות רשתות אוטוקריניות/פאראקריניות מורכבות לוויסות שגשוג, הישרדות והתמיינות של תאים, תוך שליטה בקצב התפתחות הסחוס והעצם והעיצוב מחדש [מקור].
בהתרכז בכליות כאחד מאיברי המטרה הן של-GH והן של-IGF-1, טיפול ב-GH העלה את רמות ה-IGF1 mRNA בכליות בחולדות שעברו hypophysectomy, ואישר ייצור IGF1 בכליות מקומי [מקור]. רמות IGF1 גבוהות יותר בדם ורידי של הכליות מאשר בדם העורקי-כלייתי, מה שמצביע על ביוסינתזה של IGF1 כלייתית משמעותית [מקור]. עדויות לפעולה ישירה של IGF1 בכליה מגיעות גם ממחקרים שהראו שטיפול ממושך ב-IGF1 אנושי רקומביננטי (rh) הגדיל את גודל הכליה בחולדות שעברו היפופיסקטום [מקור] והעלה את קצב הסינון הגלומרולרי (GFR) בגברים בריאים [מקור].
קולטני GH ו-IGF נמצאים גם בכליות ומתבטאים בהן בשפע, כולל בתאים הגלומרולריים שבתוך הכליה ובתאים הצינוריים
פעולות פיזיולוגיות ופתופיזיולוגיות של הורמון הגדילה והמתווך שלו
Physiological and pathophysiological actions of growth hormone and its mediator. מקור האיור בצילום מסך מ-כאן.
[מקור]. GH יכול לפעול ישירות על הכליות או באמצעות IGF-1במחזור הדם או המסונתז על ידי פרקרין [מקור] (פרקרין הוא מולקולה או הורמון המיוצר על ידי רקמה כדי לווסת את הפעילות באותה רקמה. מווסתים פרקריניים נבדלים מווסתים אנדוקריניים, בכך שהם מפרישים חומרים ישירות לזרם הדם, ובכך ניגשים גם לרקמות אחרות [מקור]). מערכת GH/IGF-1 מווסתת המודינמיקה הגלומרולרית, גלוקונאוגנזה כלייתית, צינורית נתרן ומים, פוספט וטיפול בסידן, כמו גם סינתזה כלייתית של 1,25 (OH)2 ויטמין D3 והורמון הגורל, מאריך החיים מכונה גם הורמון אנטי-הזדקנות Klotho [מקור]. על הקלוטו פרסמתי מאמר עומק – כאן הקלוטו המוכר לנו מהציר FGF23-Klotho, בכוחו להשפיע על אורך ועל איכות חיינו, גם על תפקודן של הכליות. הוא פועל גם כקולטן של ההורמון הפוספטורי (phosphaturic hormone – חלבונים המווסתים ספיגה כלייתית של זרחן) גורם גדילת פיברובלסטים – 23 – Fibroblast growth factor באבובית הפרוקסימלית 1α של הכליה (הקרובה לפקעית של הכליה), מפחית את הפעלת ויטמין D, ומגביר את 24-הידרוקסילציה של הכליות (והכבד) של 25(OH)D, מה שמגביר את השבתת ויטמין D [מקור].
תרומת כליה מוביל בהכרח לירידה בתפקוד הכליות וקשור לעלייה בפרוטאינוריה, כמו גם לעלייה בלחץ הדם (BP) גדולה מזו המיוחסת להזדקנות רגילה [מקור1, מקור2].
במחקרים מבוקרים נמצא כי החלבון בשתן גבוה יותר בקרב תורמי כליה והפך בולט יותר עם הזמן [מקור].
הפחתה קריטית במסת הכליה, עקב קטיעה, הסרה נוכח תרומה עלולה לגרום ליתר סינון בנפרון הבודד, שבכליה הנותרת, עם פרוטאינוריה נלווית ואובדן מואץ של תפקוד הכליות [מקור].
במקרה של נזק חמור לכליות, והישענות על "נפרולוגיה", בלבד נראה לכאורה שאין ברירה אלא לבצע ניתוח כריתת כליה (נפרקטומיה). ההשפעות של כריתת נפרקטומיה נוכחת גם כאשר מתבצעת לצורך תרומת כליה די גרועות. מסתבר ש
כריתת כליה (נפרקטומיה) או כריתה של תורם חי עלולה לגרום גם לעליה ברמות אנגיוטנסין בשתן (uAGT).
יותר מכך הוצע לאחרונה שעליה ברמות אנגיוטנסין בשתן (uAGT) תשמש כסמן של פגיעה בכליות והפעלת מערכת רנין-אנגיוטנסין תוך-כלית (activated intrarenal renin–angiotensin system) [מקור].
הן אם מדובר בתורם והן אם מדובר במקבל, רואים שוב ושוב לאחר כריתת נפרקטומיה של התורם (במקרה של נזק חמור לכליות, כשאין ברירה אלא לבצע ניתוח כריתת כליה להצילו נושא שמכונה נפרקטומיה.)
עלייה ברמות האנגיוטנסין בשתן Urinary angiotensinogen (uAGT) יכולה להיות תוצאה מכריתת הכליה. ההפעלת של המערכת רנין-אנגיוטנסין תוך-כלייתית מבקשת לסייע ולהשפיע על השינויים המפצים בכליה שנותרה
[מקור], נושא זה שב ונקשר בזרימת הדם הכלייתית RBF – שנזכר בפתיחת המאמר [מקור]. נמצא כי רמות של uAGT יכולות גם לשלוט בפעילותה של מערכת רנין-אנגיוטנסין תוך-כלית (RAS), ושוויסות עלייה של AGT עלול להוביל לרמות גבוהות של הפפטיד אנגיוטנסין ומכאן לעלייה בלחץ הדם. כך שה-uAGT או ה AGT יכולים לשמש כסמן של פגיעה בכליות והפעלת מערכת רנין-אנגיוטנסין תוך-כלית (RAS) [מקור]. רמות האנגיוטנסין בשתן Urinary angiotensinogen (uAGT) נמצא כמדד אפשרי לזרימת הדם בתוך הכליה ולהשפעותיו על לחץ הדם בשל השפעותיו על מערכת רנין אנגיוטנסין תוך-כלית מקומית (RAS) שהוזכר למעלה [מקור]. נושא זה שב ומטופל אך ורק עם מזון כתרופה, מצער שהנפרולוגיה לא כוללת נושא גורלי זה בתכנית הלימודים של הסטודנטים לנפרולוגיה.
יש לזכור כי להפעלת מערכת הרנין-אנגיוטנסין (RAS) תפקיד מכריע בפתוגנזה של יתר לחץ דם ומחלות כליה כרוניות (CKD) [מקור]. בשנים האחרונות ישנו דגש שהולך וגובר על נושא תפקידו של ה-RAS המקומי/רקמתי כנזכר למעלה – התוך כלייתי [מקור]. יחד עם זאת נושא זה שב על עצמו לא רק במחלת כליות או באבר הכליות [מקור1, מקור2] אלא גם ברקמות נוספות בהן המוח [מקור], הלב [מקור]. Angiotensinogen (AGT) הוא המצע הידוע לנו עד כה המצע היחיד לרנין, שהוא האנזים המגביל את הקצב של RAS. למרות שרוב ה-AGT המסתובב מיוצר ומופרש על ידי הכבד, גם הכליות מייצרות את ה- uAGT [מקור]. החלק העיקרי של אנגיוטנסין II הקיים ברקמות הכליה נוצר באופן מקומי מ-AGT שמגיע בזרם הדם לכליה וכן מ-AGT המיוצר באופן מקומי על ידי תאים צינוריים פרוקסימליים בתוך הכליה [מקור1, מקור2].
למערכת הרנין-אנגיוטנסין (RAS) יש תפקיד מרכזי בשמירה על הומאוסטזיס נפח חוץ תאי ולחץ דם באמצעות מנגנונים מורכבים. מלבד ה-RAS הסיסטמי הידוע, התרחשות של RAS מקומי (תוך כלייתי) תועדה. לפני מחלימי הכליות כיום (והם לא בקרב הממסד) עדויות עדכניות ממחקרים פרמקולוגיים וגנטיים, במיוחד אלה המשתמשים בגישות טרנסגניות שונות לתמרן רמות תוך-כליות של רכיבי RAS, אלו שבו והראו את התפקיד המכריע של RAS תוך-כליתי ביתר לחץ דם. מחקרים עדכניים החלו גם לפענח את המנגנונים המולקולריים השולטים בפעילות RAS תוך-כלית. מערכת זו (תוך כלייתית) נמצאת בשליטה של רשתות רגולטוריות מורכבות המורכבות מווסתים חיוביים של קולטן (פרו)רנין, איתות Wnt/β-catenin ותת-סוג קולטן PGE2/PGE2 EP4, ומווסתים שליליים של Klotho, קולטן ויטמין D וכבד X קולטנים. מי שרוצה להתעמק ולהכיר את ההתקדמות האחרונה בהגדרת הוויסות והתפקוד של RAS תוך-כליתי כישות ייחודית הנפרדת מיצירת אנגיוטנסין II מערכתית מוזמן לקרוא במאמר" Physiology and Pathophysiology of the Intrarenal Renin-Angiotensin System: An Update – כאן
יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל – כאן
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
מאמרים אחרונים
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
קכקסיה – הרזון הקטלני של חולי כליות בדיאליזה - זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- הפרעה אנדוקרינית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון
- מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- חרדה
- מגילת רות האלמנה שיצאה ממרחב הנוחות
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה – סדרת מאמרים.
- למה אני לא מצליח להתמיד – והסוכר
- על ההזנחה –
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- חזרה לבסיס – עקרונות צירופי המזון
- ניתוק רגשי – על הקורוציונה
- די לכאב
- ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
- התודעה השלילית
- ביקורת מבזה
- איך לצאת ממצבי תקיעות בחיים – שיטת שלוש השאלות בגובה העיניים
- נמאס לי מהחיים מה עושים
- על היכולת להשתקם, לקום מאבק הדרך ומכאב הפרידה
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- מדד חדש לבריאותך – ביטול האסרוסקלרוזים
- לראשונה, מדענים הצליחו לתרגם לטקסט את הפעילות המוחית של אדם עם שיתוק שאינו מסוגל לדבר.
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- מחסור בברזל
- קרום התא – הממברנה והדלקת הכרונית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- מה היא בדיקת D-dimer
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- מהו אימון שלפוחית השתן?
- פסוריאזיס, האם הימנעות מגלוטן מסייעת לחולי הפסוריאזיס
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- על הנקמה – פנטזיות נקמה לאחר חווית אירועים טראומטיים
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 18
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 17
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- גלוטתיון כל האמת
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות – פרק א'
- אכל נקי
- אי ספיקת כליות – טיפול ללא תרופות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- אילוף הכליות הסוררות
- גודש נוזלים בריאות – בקרב חולי כליה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית.
- גודש נוזלים בריאות – בקרב חולי כליה
- דלקת כליות אינטרסטיציאלית – השתמשו במי שעורה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מעגל המוזר – התפתחות ה"אני" בשנה התשיעית לחייו
- חלב לקוליטיס כיבית: כל מה שחשוב לדעת
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- מהו אימון שלפוחית השתן?
- פסוריאזיס, האם הימנעות מגלוטן מסייעת לחולי הפסוריאזיס
- על הנקמה – פנטזיות נקמה לאחר חווית אירועים טראומטיים
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 18
- מסלול ההתפתחות הנורמטיבי בחיי אדם ודמימותיו בטבלה. עמוד 17
- המפריעון Vaxinia – CF33 בפעם הראשונה הוזרק בניסוי קליני וירוס קוטל תאי סרטן.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- התכנית לשיקום הכליות פרק ז' – עקרונות הטיפול
- התכנית לשיקום הכליות פרק ו' – התבוננו אל מדד האוראה
- התכנית לשיקום הכליות פרק ה' תנגודת לאינסולין
- התכנית לשיקום הכליות פרק ד'
- התכנית לשיקום הכליות פרק ג
- התכנית לשיקום הכליות פרק ב
- התכנית לשיקום הכליות – פרק א'
- אכל נקי
- אי ספיקת כליות – טיפול ללא תרופות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- אילוף הכליות הסוררות
- גודש נוזלים בריאות – בקרב חולי כליה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית.
- גודש נוזלים בריאות – בקרב חולי כליה
- דלקת כליות אינטרסטיציאלית – השתמשו במי שעורה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- פרפור פרוזדורים (A-fib) יכול להפסיק מעצמו.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- לאוקון – יצירת מופת
- אן-לואי ז'ירודה דה רוסי-טריוזון
- תולדות האמנות החילונית ואמנות הריקוד באיטליה
- ג'ונטו פיזאנו מייסד הרנסנס האיטלקי בציור מאת ירון מרגולין
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- פייר בושאן – האיש שהציל את חגיגת הנישואין של לואי ה-14 מאת ירון מרגולין
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
- ולנטין דה בולון צייר גאון – ירון מרגלין בפתח התערוכה בפריז של ולנטין דה בולון

כתיבת תגובה