אפיגנטיקה – על האופן בו אפשר להשתיק גן שמעורר מחלה, בעזרת סיבי תזונה.
האפיגנום הוא קבוצת השינויים הכימיים שמשפיעים על ה-DNA ועל החלבונים הקשורים ל-DNA בתא. מדובר בחלבונים אשר משנים את ביטוי הגנים, וניתנים לתורשה (דרך מיוזה ומיטוזה). השינויים מתרחשים כתהליך טבעי של התפתחות והתמיינות רקמות, וניתן לשנות אותם בתגובה לחשיפה סביבתית או למחלות ואפילו לכוון אותם לבלימת מחלה גנטית או לשנות את כיוונה בעזרת מרכיבים כמו סולפורפאן שנמצא בנבטי ברוקולי [מקור].
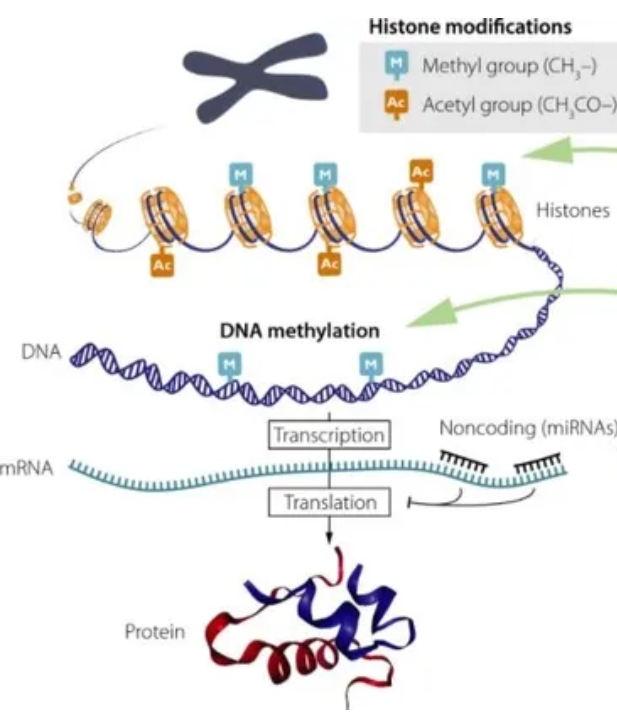
הסוג הראשון של מסלול ההשפעה האפיגנטי נקרא מתילציה של DNA. מסלול זה משפיע ישירות על ה-DNA בגנום. בתהליך זה, חלבונים מחברים תגים כימיים הנקראים קבוצות מתיל לבסיסי מולקולת ה-DNA במקומות ספציפיים. קבוצות המתיל מדליקות או מכבות גנים על ידי השפעה על אינטראקציות בין ה-DNA לחלבונים אחרים. בדרך זו, תאים יכולים לזכור אילו גנים מופעלים או כבויים. הסוג השני של מסלול אפיגנטי, נקרא שינוי היסטון, גם הוא משפיע על ה-DNA אבל באופן עקיף. ה-DNA בתאים עטוף סביב חלבוני היסטון. שרשרת הדנ"א יוצרת סביבו מבנים דמויי סליל המאפשרים למולקולות הארוכות מאוד של ה-DNA להתפתל בצורה מסודרת ככרומוזומים בתוך גרעין התא. חלבונים יכולים לחבר מגוון תגים כימיים להיסטונים. חלבונים אחרים בתאים יכולים לזהות את התגים הללו ולקבוע אם יש להשתמש באזור זה של DNA או להתעלם ממנו בתא זה.
אפיגנטיקה (Epigenetics) משמשת מחלימנים כמוני, ירון מרגולין, כיום, כך שבכוחנו להביא באמצעותה להשתלט על איכות הסביבה של הגנים ולשנות בהווה, בפועל את הדרך שבה תאים משתמשים בהוראות ה-DNA. האפיגנטיקה משנה בפועל את הביטוי של הגנים מבלי לשנות את רצף הדנ"א [מקור].
נקודת הבקרה העיקרית לביטוי הגנים מתרחשת כמעט תמיד בתחילת תהליך ייצור החלבון – נושא שמכונה גם התחלת השעתוק ( the initiation of transcription). ספר ההוראות להחלמה, גדילה, תיקון וגם למחלה עובר מדור לדור. ספר זה הוא הספר הגנטי שנשמר בגוף, בכל תא ב-DNA, ה-DNA הזה מכיל רצף שבו ארבע אבני הבניין מסודרות זו לצד זו לאורך שרשרת – מולקולות ה-DNA. שרשראות אלה ארוכות מאוד, וכוללות עשרות מיליוני בסיסים כל אחת – זה מה שיוצר את הצופן. כדי להביא להחלמה, או למחלה או לצמיחה וייצירת "יש" – התא צריך לתרגם צופן זה כדי לייצר חלבונים – לייצר את החלבונים הנדרשים לבנייה מחדש כשמדובר בהחלמה. בשלב הראשון, אנזים בשם RNA פולימראז, שמשמעו "יצרן RNA", מעתיק מקטע קצר מתוך שרשרת – מולקולות ה-DNA הארוכות מאוד, לרוב מקטע ההעתקה בן כמה מאות או אלפי בסיסים. הוא מעתיק מתוך מולקולת ה-DNA הארוכה ויוצר ממנה מולקולת RNA. תהליך ההעתקה הזה, הוא שנקרא "שעתוק".
לאדם יש טריליוני תאים, המתמחים בתפקודים שונים. תאים אלו נמצאים ופועלים בשרירים, בעצמות, בדם ובמוח, וכל אחד מהתאים הללו נושא בעצם את אותו גֵּנוֹם (בעברית: מִכְלוֹל הַגֵּנִים) בגרעין שלו. ההבדלים בין התאים נקבעים על ידי האופן שבו הם פועלים וכן בזמן – מתי הם מופעלים או מפעילים וכן מכבים קבוצות שונות של גנים בסוגים שונים של תאים.
ויסות זה מסייע להבטיח שכל תא מייצר רק חלבונים הנחוצים לתפקודו. לדוגמה, חלבונים המעודדים צמיחת עצם אינם מיוצרים בתאי שריר. דפוסי שינוי אפיגנטי משתנים בין פרטים, ברקמות שונות בתוך אדם, ואפילו בתאים שונים בתוך רקמה. כך גם תאים מיוחדים בעין למשל מפעילים גנים שמייצרים חלבונים שיכולים לזהות אור, בעוד תאים מיוחדים בתאי דם אדומים מייצרים חלבונים המובילים חמצן מהאוויר לשאר הגוף. האפיגנום שולט ברבים מהשינויים הללו במכלול הגנים (בגנום). השפעות ,סביבתיות, כגון תזונה, אור השמש, איכות האוויר מצב נפשי, משפיעים על נושא זה השפעה מכרעת כאשר מזון בלתי מתאים חודר למערכת וחשיפה למזהמים. אלו יכולים להשפיע על האפיגנום לרעה ולפתח מחלה. שינויים אפיגנטיים יכולים להישמר מתא לתא כאשר תאים מתחלקים, ובמקרים מסוימים, הם יכולים אפילו לעבור בתורשה לאורך הדורות [מקור] נוכח מזון כתרופה למשל סיבים שנמצאים בנבטי ברוקולי, בסויה, בתפוח אדמה חי, התיקון הוא שעובר בתורשה [מקור].
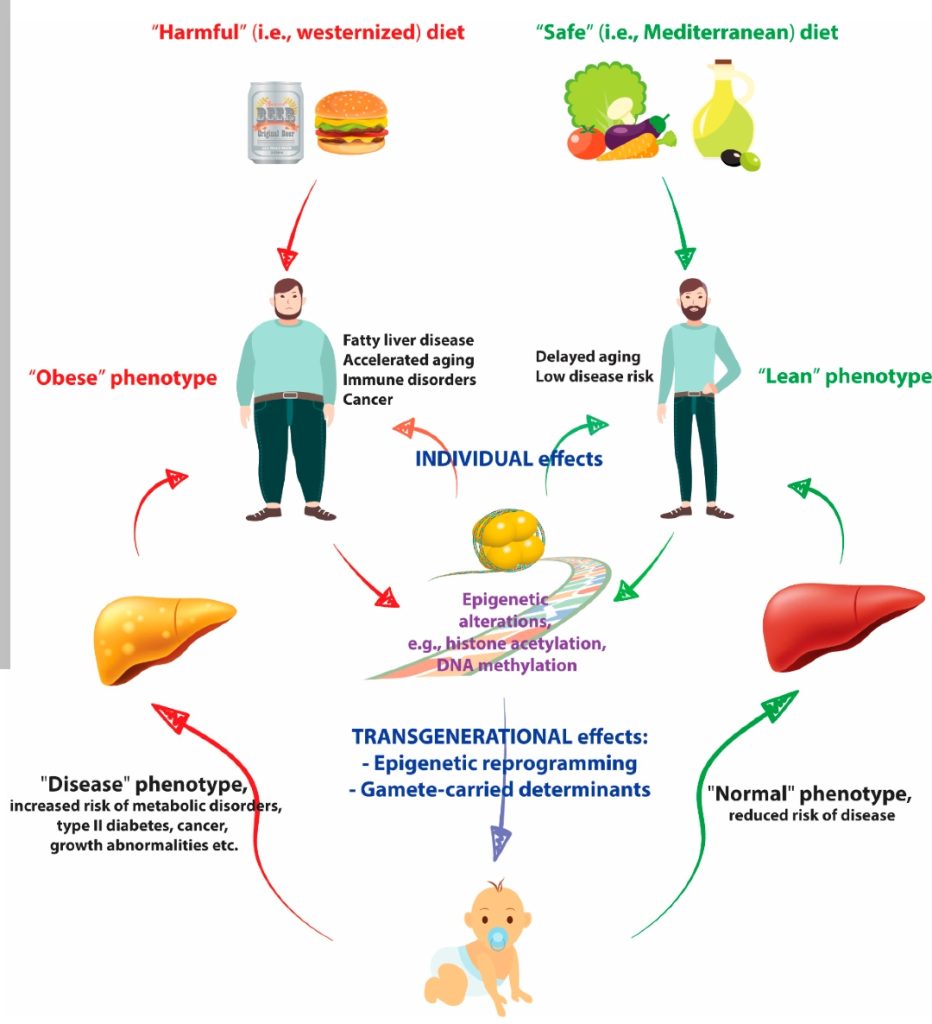
עדויות משכנעות, ומצביעות, שוב ושוב על כך שגורמים סביבתיים ואורח חיים שגויים עשויים להשפיע על הפעלת גנים למחלה. ככלל לתזונה יש השפעות אפיגנטיות משמעותית כולל השפעה חוצות-דוריות, ויותר ויותר מידע נאסף לגבי מתי בני אדם רגישים ביותר להשפעות אפיגנטיות תזונתיות, ולאילו רכיבים תזונתיים צפויים להיות בעלי ההשפעה העמוקה ביותר. חורף הרעב ההולנדי של 1944/5 ומחקרי Överkalix היו חשובים בהצעת השפעות תזונתיות כגון אלו של צריכת קלוריות, מזונות ספציפיים, חומרי הזנה ופיטוכימיקלים; כמו גם חשיבות התזמון על ההשלכות של סימנים אפיגנטיים אלה
[מקור1, מקור2 – Pembrey, M.; Bygren, L.; Golding, J. The Nature of Human Transgenerational Responses. In Environmental Epigenomics in Health and Disease; Springer Berlin Heidelberg: Berlin, Germany, 2013; pp. 257–271, מקור3 – Kyle, U.G.; Pichard, C. The Dutch Famine of 1944–1945: A pathophysiological model of long-term consequences of wasting disease. Curr. Opin. Clin. Nutr. Metab. Care 2006, 9, 388–394
החוקרים כיום מפרקים רקמות נגועות לתאים בודדים ולאחר מכן בוחנים את פעילות הגנים בכל אחד מאותם תאים. המידע נלמד, ונתונים רבים על הגנים שמתבטאים בכל תא מגיעים אלינו, או במילים אחרות, לומדים את טביעת האצבע של כל תא. עבור כל תא החוקרים רוצים לדעת אילו גנים פעילים ועל סמך מידע זה להבין אילו תאים מסוגלים להתחמק מטיפולים ולעשות גרורות. המטרה לבלום את שידור הגנים האלו למחלה – נושא זה הוא תחומה של האפיגנטיקה.

כאשר משתמשים בנבטי הברוקולי ובמקביל בקמח קליפות הרימונים, או בקמח קליפות אננס – עליו כתבתי כאן, השידור החולה של הגנים לא מגיע למטרתו. הסביבה בה הגן נמצא משתנה מהותית והאדם מחלים בעזרת כוחות הריפוי שנתמחים על ידי סיבי תזונה ומה שמכונה היום באופן כללי – אפיגנטיקה.
ניתן להשתמש בגנים מסוימים או בווריאציות גנטיות מסוימות בעזרת שינוי איכות חייהם ולעצור את ביטויים למחלה, מבלי לשנות את המבנה שלהם – כדי לזהות תזונה מועדפת עבור אדם שלקה במחלה במטרה להשיג עבורו את ההחלה מוטל עלינו לחקור את מכלול מצבו ולהתאים לו מזון כתרופה ייחודי – מדובר במאמץ אדיר של הרכבת תפריט להחלמה שתוצאותיו עד כה מעוררות השראה והוא נוכח כיום ופועל בקליניקה של "לחיצות ההחלמה".

המושג "אורח חיים" כולל גורמים שונים כמו תזונה, אור השמש, אוויר ומים (בדגש על ניקיון), קריירה, ריגושים (במידה), מצב נפשי כללי, פעילות גופנית, חיים חברתיים ואהבה, בכלל זה סביבה מכבדת, הגינות, סדר יום יציב, גם ריחוק מעישון וצריכת מזון רעיל לצד סילוקם של מזהמים סביבתיים, והמנעות מעבודה במשמרות לילה ואור כחול. מדובר במנגנונים אפיגנטיים, ובהם מצביעים על מתילציה של DNA,אצטילציה של היסטון [(Histone) הוא חלבון בעל מטען חיובי שמעורב באריזת ה-DNA. חומצות האמינו המרכזיות הבונות את ההיסטון הן ליזין וארגינין.] וביטוי מיקרו-RNA המושפעים בוודאות (ע"פ המחקר המתקדם ביותר כיום), מאיכות הנוזל הבן תאי והתוך תאי בו הם נמצאים ופועלים [מקור1, מקור2, מקור3, מקור4]. המתילציה הינה השינוי (מודיפיקציה) הראשון שנתגלה על גבי החומר הגנטי, שיש לו השפעה על פעילות המידע הגנטי [מקור1, מקור2, מקור3], והיא מעורבת במנגנון הבסיסי של בקרת הפעילות של חומר התורשה בצורה שאינה 'כתובה' באבני הבניין של החומר התורשתי – האפיגנטיקה. במתילציה מתרחשת הוספה של קבוצות מתיל (H3C) למולקולת המַצָּע של האנזים, או החלפה של אטום (או מולקולה) על ידי קבוצת מתיל [מקור].
מתילציה חריגה, שינויים היסטונים וביטוי של מיקרו-RNA (microRNA) נמצאו כמי שעלולים להוביל למחלת כליות כרונית (CKD), מחלה שמתים ממנה [מקור1, מקור2].
סוג נפוץ של שינוי אפיגנטי נקרא מתילציהשלDNA. מתילציה של DNA – היא תוספת פשוטה של קבוצת מתיל (CH3) למיקום 5 על טבעת הפירימידינים של שיירי הציטוזין בזוג ציטוזין-גואנין (CG). [מקור]. מדובר בתקשרות של קבוצות כימיות קטנות הנקראות קבוצות מתיל (כל אחת מורכבת מאטום פחמן אחד ושלושה אטומי מימן) לאבני בניין של DNA. כאשר קיימות קבוצות מתיל בגן, הגן הזה כבוי או מושתק. גן מושק משמעו שלא מופק חלבון מהגן הזה. מתילציה או אצטילציה, אלו דרכים ביולוגיות, טבעיות להשתיקאחד משני אללים של הגן. [מקור].
היסטון – ההיסטונים אחראיים לאריזה היוצאת דופן בצפיפותה של ה-DNA בכרומוזומים. הליפוף הסבוך של ה-DNA סביב ההיסטונים מאפשר למולקולת DNA, אשר אורכה המתוח כ-1.8 מטר, להיצטופף בתוך גרעין התא, שאורכו נמדד בננומטרים [מקור].
מיקרו-RNA (miRNAs) הן מולקולות RNA קטנות, לא מקודדות, אשר עוברות אירועי עיבוד מרובים כדי להגיע לרצף ה-RNA הפונקציונלי (של 21-23 ribonucleotide). הן מתפרשות על פני 18-24 נוקלאוטידים. MicroRNA מווסתים את ביטוי הגנים ברמה שלאחר שעתוק באמצעות זיווג בסיסים עם רצפים משלימים של אזור 3'לא מתורגם (UTR) של RNA שליח (mRNA). אינטראקציה זו גורמת להשתקת גנים על ידי ביקוע של גדיל ה-mRNA או ערעור היציבות של ה-mRNA באמצעות קיצור זנב ה-polyA שלו או עיכוב התרגום של ה-mRNA לחלבונים. [מקור1, מקור2, מקור3].
רוב המחקרים שתמצאו ברשת התרכזו עד כה במתילציה של DNA (בה מדובר להלן,), או באצטילציה של היסטון וביטוי מיקרו-RNA, בעוד שרק כמה חקירות התמקדו בגורמי אורח חיים ביחס לשינויים בהיסטונים ו-miRNAs מתוקף חקירת ההשפעה של סיבים תזונתיים בהם ידובר בהמשך על הגנים של המחלות באו החוקרים למסקנה שהסיבים התזונתיים מסוג אלו הנמצאים בנבטי הברוקולי הם תרופה נגד גנים שמפעילים מחלה. בהחלט נושא הסיבים התזונתיים יעמוד במרכז מאמר זה שכותרתו העל שלו למעשה "מזון כתרופה להשתקת גן שמעורר מחלה".
הגנום האנושי מכיל שני עותקים של גן המקור – עותק אחד שהאדם ירש מהאם ואחד מהאב. עבור מספר קטן של גנים, רק העותק מהאם מופעל; עבור אחרים, רק העותק מהאב מופעל. תבנית זו נקראת הטבעה (imprinting). האפיגנום מבחין בין שני העותקים של גן מוטבע וקובע איזה מהם יופעל. מחלות מסוימות נגרמות מהטבעה לא תקינה. בכלל זה תסמונת Beckwith-Wiedemann, מדובר בהפרעה הקשורה לצמיחת יתר של הגוף ולסיכון מוגבר לסרטן; תסמונת Prader-Willi, קשורה לטונוס שרירים ירוד ולרעב מתמיד, היא גם מובילה ללהשמנה; ותסמונת אנג'למן, היא דוגמא נוספת אשר מובילה בין השאר למוגבלות אינטלקטואלית, כמו גם קשיי תנועה [מקור].
מתילציה של DNA, משפיעה ישירות על ה-DNA בגנום. בתהליך זה, חלבונים מחברים תגים כימיים הנקראים קבוצות מתיל לבסיסי מולקולת ה-DNA במקומות ספציפיים. קבוצות המתיל מדליקות או מכבות גנים על ידי השפעה על אינטראקציות בין ה-DNA לחלבונים נוספים [מקור].
הדנ"א (גן) הוא מקטע שקט אלא אם כן הוא מתעורר על ידי הפעלתו – בהשפעת גורמי תיעתוק אשר נקשרים לאזור האיתחול שלו, בגופנו DNA מלופף סביב חלבונים שנקראים "היסטונים".
הדנ"א עטוף בחלבונים, וה"אבר" או המכלול הביולוגי הזה נקרא כרומטין (Chromatin).
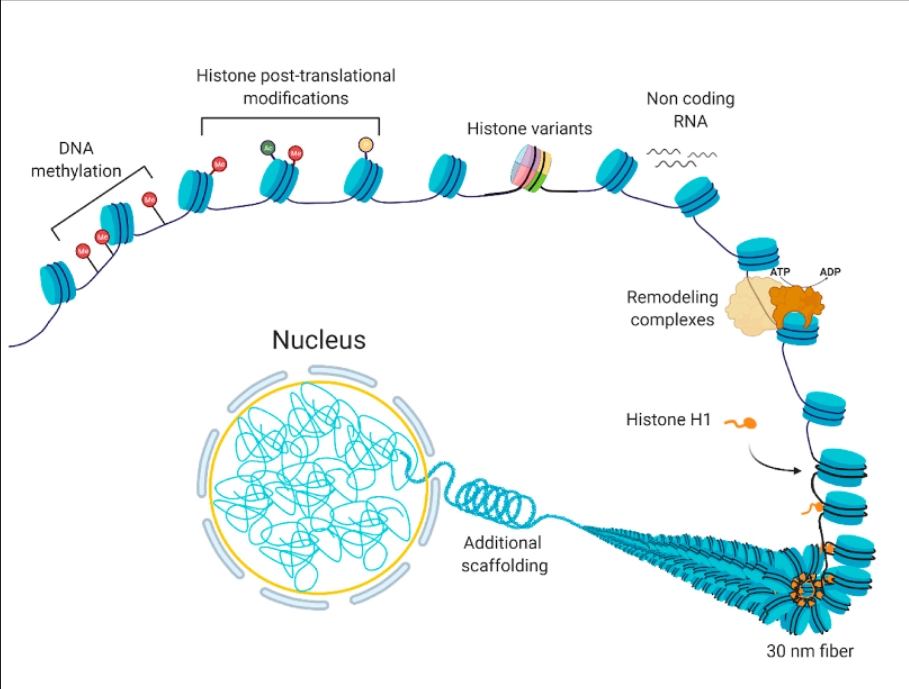
הכרומטין – Chromatin הוא קומפלקס המכיל את ה-DNA ואת החלבונים הקשורים אליו. הדנ"א אם כן הוא סליל כפול שארוז בחלבונים. חלבונים אלה נקראים היסטונים, ההיסטונים הם חלבונים בעלי מטען חיובי, סביבם כאמור לעיל, כרוך ה-DNA כמעין סליל. המבנה המורכב הזה, הוא אבן היסוד שבונה את הכרומטין מכונה – הנוקלאוזום [מקור]. מדובר במבנה דינמי שיכול להשתנות (הכרומטין) במהלך חיי התא מבחינת הצורה וההרכב (מחזור התא). הכרומטין עשוי משרשרת של אבני בניין אלו – הנוקלאוזומים והשרשרת הזו מקופלת ומוחזקת על ידי חלבונים נוספים והוא הכרומטין מסתבר כיום מרכיב מכריע כמארגן גנום, ומי שמכוון את פעילות ה-DNA [מקור].
שינוי היסטון, אפשרי וכולל מונו-, די-וטרי-מתילציה, אצטילציה, יוביקוויטילציה, זרחון וריבוזילציה, וכל אלו מתרחשים לרוב בקצה ה-N של זנבות ההיסטון
[מקור – Luger, K. Structure and dynamic behavior of nucleosomes. Curr. Opin. Genet. Dev.2003, 13, 127–135].
שינוי כזה משפיע אף הוא על ה-DNA אבל באופן עקיף. השינויים האלה יכולים להשפיע על צפיפות הכרומטין, ולהוביל בהמשך שינוי בנגישות של ה-DNA ומכאן למעורבותו בוויסות הגנים
[מקור1 – מקור – Luger, K. Structure and dynamic behavior of nucleosomes. Curr. Opin. Genet. Dev.2003, 13, 127–135, מקור2].
לדוגמה, מתילציה על ליזין 4 על הזנב השלישי של היסטון 3 (H3K4me3) מובילה בדרך כלל להפעלת גנים, בעוד שמתילציה של ליזין 9 (H3K4me9) ו/או 27 (H3K4me27) קשורה להשבתת גנים [מקור]. בדרך כלל, מתילציה של היסטון מובילה למבנה כרומטין מעובה ולדיכוי ביטוי גנים [מקור]. בדיוק כמו ששאריות ליזין וארגינין יכולים להפעיל מתילציה על היסטונים, ליזין יכול גם להיות אצטילציה. אצטילציה של היסטון מובילה בדרך כלל למבנה כרומטין פתוח והוא שמקדם ביטוי גנים.
[Pan, Y.-X.; Zhang, Y.; Chen, D. Epigenetic Mechanisms of Colon Cancer Prevention: What Can Nutrition Do? In Molecular Mechanisms and Physiology of Disease; Springer: New York, NY, USA, 2014; pp. 277–353.].
היסטון אצטיל טרנספראזות אחראיות לאצטילציה, והיסטון דאקטילאזות (HDACs) אחראיות להסרת קבוצות אצטיל. HDACs יכולים לכוון הן לחלבוני היסטון והן לחלבונים שאינם היסטונים כגון גורמי שעתוק ואנזימי תיקון DNA
[Xu, W.S.; Parmigiani, R.B.; Marks, P.A. Histone deacetylase inhibitors: Molecular mechanisms of action. Oncogene2007, 26, 5541–5552],
ולכן הם חשובים בבקרה של ביטוי גנים. ניתן להשתיק גנים על ידי מתילציה של איי CpG וגנים אלה יכולים להשתיק גם על ידי שינויים היסטונים ללא מתילציה של CpG
[Mathews, L.A.; Crea, F.; Farrar, W.L. Epigenetic gene regulation in stem cells and correlation to cancer. Differ. Res. Biol. Divers.2009, 78, 1–17.].
ה-DNA בתאים עטוף סביב חלבוני היסטון, היוצרים מבנים דמויי סליל המאפשרים למולקולות הארוכות מאוד של ה-DNA להתפתל בצורה מסודרת לכרומוזומים בתוך גרעין התא. חלבונים יכולים לחבר מגוון תגים כימיים להיסטונים. חלבונים אחרים בתאים יכולים לזהות את התגים הללו ולקבוע אם יש להשתמש באזור זה של DNA או להתעלם ממנו בתא זה [מקור].
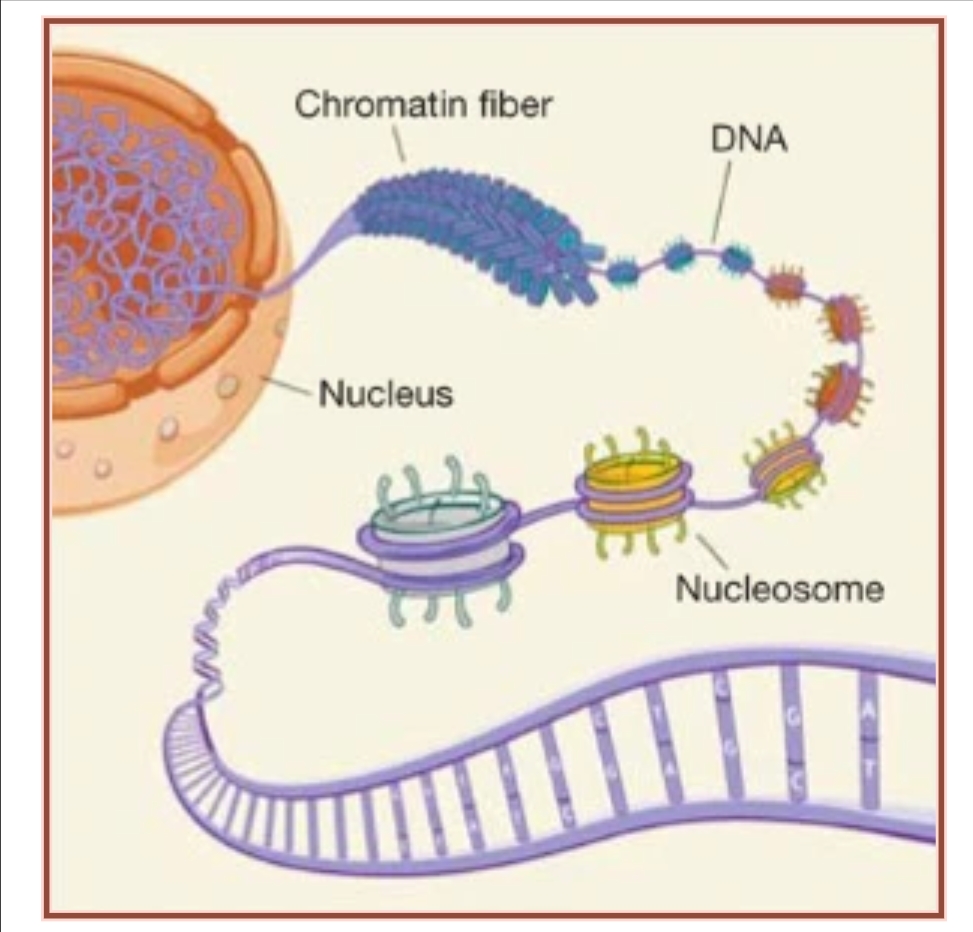
מנגנון אפיגנטי נוסף נקשר בהיסטונים (האריזה של הדנ"א) ובכושרי השינוי והזרימה הטבעיים שמתרחשים ב"אריזה" – גם היא – ההיסטונים משתנים.
ניתן להחליף את ארבעת הסוגים הבסיסיים של חלבוני היסטון אשר סביבם מלופף ה-DNA עם גרסאות אחרות ולשנות את מהותם על ידי פעילות כימית במגוון דרכים בעזרת חומצות אמינו (חלבונים) הפועלים על הרחבות דמויות זנב של היסטונים.
שינויים כאלה חלים באמצעות קבוצות אצטיל או מתיל, וגם על ידי צורות מסוימות של RNA כגון מיקרו- mRNA) RNA), ו-RNA התערבותי קטן (siRNA). מנגנונים אלה הם למעשה כוחות שינוי הפועלים או מעורבים בשינויים שמתרחשים במבנה של הכרומטין, נושא זה הוא מי שקובע בפועל אם גן יופעל או יושתק, אם האדם יחלה, ימות, או יחלים וזו גם אחת הסיבות שהתרופות לכאורה לא מתאימות, הן משפיעות לרעה לכאורה על איכות הסביבה בשל הרעלים האורמיים שהן יוצרות במערכת העיכול. בדומה לוויסות המתילציה, גם האצטילציה מווסתת על ידי אנזימים: היסטון אצטיל טרנספראז מוסיף קבוצות אצטיל [מקור], והיסטון דאצטילאזות [מקור].(HDACs) מסירים אותן.
בניסויים בתרבית תאים, סיבי תזונה מסיסים ומרכיבים אנטי אוקסידנטיים ואני דלקתיים תזונתיים, וויטמינים כויטמין E, ויסודות קורט כמו סלניום (אגוזי ברזיל) נמצאו משפרים את איכות הסביבה התוך גופית ובמיוחד את המטריקס – הנוזל התוך גופי, ומי שמעכבים את הפעילות או הביטוי של מתיל-טרנספראזות DNA. כתוצאה מכך, גנים מושתקים והם כפי שמאמר זה מסביר, מבצעים פונקציות מפתח בתהליכים תאיים כגון ניקוי רעלים, בקרת צמיחת תאים או תיקון DNA מופעלים מחדש ותורמים למניעת מחלות כרוניות. האיור הוא צילם מסך מהמאמר: " Is personalised nutrition better for cancer prevention? " – כאן
באופן כללי, ההמשגה: "שינויים אפיגנטיים" מתייחסת לשינויים במתילציה של DNA, שינויים בהיסטונים, כמו גם RNA רגולטורי, כולל RNA ומיקרו-RNA לא מקודדים וארוכים.
[מקור].
כיום ידוע שיכולות להתקיים בכרומטין מתילציות בודדות, דימתילציה, טרימתילציה, אצטילציה, פוספורילציה, יוביקוויטינה או שינוי אחר [מקור]. יותר ממאה שינויים כבר זוהו בכרומטין. במחקר אחר חוקרים זיהו למעלה מ-50,000 שינויים משפרים פוטנציאליים בגנים של האדם [מקור1, מקור2, מקור3].
מתילציה של DNA
המתילום הוא ההתפלגות הגנומית של רצף ה-DNA. המתיל הקיים בתא עובר שינוי ביחס לסביבה או לשלב ההתפתחותי. מתילציה של DNA כוללת הוספה קוולנטית של קבוצת מתיל בעמדה 5 של טבעת הפירימידין של ציטוזין המיוצגת כ-5-מתיל C או CMe. שעתוק רוב הגנים המקודדים לחלבונים ביונקים מתחיל בפרומוטורים עשירים ברצפי CG, כאשר הציטוזין ממוקם ליד נוקלאוטיד גואנין המקושר על ידי פוספט הנקרא CpG site. קטעים קצרים כאלה של DNA צפוף ידועים כאיי CpG. ניתן לבצע מתילציה של DNA בדלילות לאורך הגנום באזורים בין-גניים, או בצפיפות רבה יותר באיי CpG שלעתים קרובות, אך לא רק ממוקמים באזורי פרומטור של גנים מדכאי גידולים (TSG), גנים לתיקון DNA או אונקוגנים [מקור].
בגנום האנושי 60-80% מ-28 מיליון דינוקלאוטידים CpG עוברים מתילציה [מקור1, מקור2]. מבנה הכרומטין הסמוך למקדמי האי CpG מקל על שעתוק, בעוד שאיי CpG מתילטים מקנים דחיסה הדוקה לכרומטין, המונעת את תחילת השעתוק ואת ביטוי הגנים.
אתרי CpG עוברים מתילציה על ידי אחד משלושה אנזימים הנקראים DNA methyltransferases (DNMTs). מגוון DNMTs אחראים לדפוסי מתילציה של DNA שנקבעו במהלך העובר. סוג אחד של מתילטרנספראז של DNA, DNMT1, אחראי לשמירה על דפוסי מתילציה תקינים על ידי העתקתם בדיוק בין דורות תאים במהלך השכפול. DNMT2 קשור לתאי גזע עובריים ולמתילציה פוטנציאלית של RNA. DNMT3a ו-DNMT3b מעורבים במתילציה דה נובו ( (דה נובו מציין שהמהלך נוצר בתוך האורגניזם, בהבדל ממוטציה דה נובו: ביטוי בגנטיקה שפירושו צורה של מוטציה גנטית המתרחשת לראשונה אצל בן משפחה.) של DNA באתרי CpG [מקור1, מקור2].
שינויים אפיגנטיים – מתילציה של DNA מתרחשת בקרב חולי כליות ובמחלת כליות כרונית (CKD)
[מקור].
– המחקרים שהוצגו ביולי 2022 על ידי הנפרולוג פרופ' יאצק ריש Rysz J, Franczyk B, Rysz-Górzyńska M, Gluba-Brzózka A. מMedical University of Lodz כוללים סקירה שמתארת מתילציה (methylation) ומצביעה על כך שמתילציה שונה של DNA יכולה לווסת את הביטוי של גנים פרו-דלקתיים ופרו-פיברוטיים (pro-fibrotic genes), כמו גם אלה החיוניים להתפתחות ותפקוד הכליות, ובכך לעורר את התקדמות מחלת הכליות. במקרה זה ניכרת גם עלייה חריגה של הומוציסטאין, (אויב האנדותל) היפוקסיה ודלקת [מקור]. דגימות כליות הוכיחו דבר קיומו של קשר בין שינויים במתילציה של DNA ופיברוזיס לירידה במדד הסינון הפקעתי = המוערך (eGFR) ב-CKD [אנושי[מקור
שינויים אפיגנטיים קיימים בכל סוגי הסרטן בבני אדם וכיום ידוע שהם משתפים פעולה עם שינויים גנטיים ומניעים את התכונות שנגלות לעיננו (פנוטיפ) של הסרטן ואי ספיקת כליות [מקור]. שינויים אלה כוללים מתילציה של DNA, שינויים במהות של היסטונים, תְּמוּרָה של כרומטין, מיקרו-RNA ורכיבים אחרים של כרומטין. שינויים כאלו השינויים שמתרחשים, הם שינויים לרעה ונוכחים בעוצמה רבה גם במחלת הכליות. כאשר הגנטיקה הסרטנית והאפיגנטיקה בוודאות נקשרות בקשר בל יינתק ביצירת הפנוטיפ הממאיר;
שינויים אפיגנטיים יכולים לגרום למוטציות בגנים, ולהפך, מוטציות נצפות לעתים קרובות בגנים שמשנים את האפיגנום.
טיפולים אפיגנטיים, שהמטרה המרכזית בהם להפוך את השינויים הללו לטובה, הם סטנדרט אחד כיום לטיפול בהפרעה פרה-לוקמית ובצורה של לימפומה. היישום של טיפולים אפיגנטיים בטיפול בגידולים מוצקים מתגלה גם כמסלול טיפולי בר-קיימא אשר מוביל לחקר הסיבים הבריאותיים שבתזונה [מקור].
"ההתקדמות המעניינת ביותר" בהבנת שינוי הכרומטין מתרחשת בשלוש השנים האחרונות במעבדה, אומר קג'י ז'או (Keji Zhao) חוקר מהמכון הבריאות הלאומי של ארה"ב (the US National Institutes of Health). חוקרים במעבדתו היו אחת הקבוצות הראשונות למפות את דפוסי המתילציה והאצטילציה בכל הגנום בחלבוני היסטון אנושיים [מקור].
ניתן לכבות גן בצורה תורשתית סומטית על ידי שינויים אפיגנטיים, ולא על ידי מוטציה של רצף ה-DNA
[מקור].
מדובר בהשתקה אפיגנטית – צמצומה של האסדרה (דה-רגולציה – צמצום של פיקוח). התערבות במנגנון האפיגנטי והיא נקשרת בתילציה לא הולמת של שיירי ציטוזין (C) כמו שמתרחש במוטיבים של רצף CpG השוכנים באזורי בקרה אשר שולטים על ביטוי הגנים.
גם הדנ"א וגם ההיסטונים מכוסים בחומרים כימיים, כמו קבוצות מתיל ואצטיל.
האפיגנום הוא שפע של תרכובות כימיות שיכולות לומר לגנום [ההרכבה השלמה של DNA (חומצה דאוקסיריבונוקלאית)] מה לעשות [מקור].
השכבה השנייה של המבנה נקראת "אפיגנום" והיא זאת שמעצבת את המבנה הפיזי של הגנום [מקור]. האפיגנום עוטף בצורה הדוקה גנים לא פעילים ומונע את השעתוק שלהם (השעתוק הוא תהליך שבו נוצר העתק של גן מסוים, כשלב ראשוני בתהליך יצירת החלבונים (כפי שהוסבר למעלה). במהלך השעתוק נוצר וההעתק הזה הוא RNA שנוצר באמצעות האנזים RNA פולימראז. ההעתק הזה משמש לתרגום לחלבון. הוא השעתוק וראשיתו של התהליך שמכונה “ביטוי גנים”. מדובר בתהליך שכולל רכיבים רבים [מקור].), מה שחשוב לעניננו שבאזורים של גנים פעילים הוא משתחרר ומאפשר להם להשתעתק (אחרי השעתוק נשלחת מולקולת RNA אל המרכז לייצור חלבונים שנמצא בתוך התא – הוא באברון שנקרא ריבוזום. בהגיע ה-RNA לריבוזום, ה-RNA שליח נתקל בשני סוגים נוספים של מולקולות RNA. הראשון בהם הוא "RNA ריבוזומי" (rRNA), שהוא אחד המרכיבים המרכזיים של הריבוזום עצמו. השני נקרא "RNA מעביר" (tRNA), והמבנה התלת-ממדי שלו, המזכיר את צורת האות האנגלית L, מאפשר לו לשחק תפקיד מפתח בתרגום המידע הגנטי שה-RNA שליח הביא וליצור ממנו חלבון. צד אחד שלו נקשר לרצף של שלושה בסיסים ב-RNA שליח, והצד השני נקשר לחומצת אמינו – מולקולה קטנה שהיא אבן הבניין של החלבונים. לכל רצף של שלושה בסיסי RNA יש tRNA שנקשר אליו, ולכל tRNA ישנה חומצת אמינו מסוימת, המתאימה לאותו רצף בסיסים, שאליה הוא נקשר מצידו השני. הריבוזום מחבר את חומצות האמינו שהוא מקבל ממולקולות ה-tRNA, וכך הוא יוצר שרשרת של חומצות אמינו המבוססת על רצף הבסיסים המדויק שה-RNA שליח העתיק מה-DNA. השרשרת הזאת היא חלבון ספציפי שמיועד למלא תפקיד זה או אחר בתא. התהליך הזה, המתרחש כולו בתוך הריבוזום, נקרא תרגום [מקור]). שינויים ב-DNA, כולל מתילציה של DNA, הם מווסתים חיוניים לתעתוק המשנים את ביטוי הגנים והם מוקד ענייננו משום שכאן לפעמים מתרחשת ההשפעה הגורלית על התקדמות המחלה או על התרחשותם של סיבוכים [מקור]. הדנ"א עצמו נשאר קבוע לכל החיים, אך האפיגנום שמכסה אותו גמיש הרבה יותר. סמנים אפיגנטים מגיבים לאותות סביבתיים כמו תזונה ולחץ (עקה), [מקור]
מנגנונים העומדים בבסיס האפיגנטיקה
כפי שהוסבר, כל תא באורגניזם נושא גנום זהה, אולם למרות היציבות של הוראות אלו, הפנוטיפ הסופני בתוך האורגניזם אינו קבוע וסטייה נגרמת על ידי שינויים בביטוי הגנים בתגובה להשפעות סביבתיות. מתילציה של DNA, שינוי היסטון והשתקה הקשורה ל-RNA הם הדרכים העיקריות לשליטה בשינויים אלה [מקור],

מסתבר שמזון כתרופה, למשל נבטי ברוקולי יכול לשנות גורל חיי אדם ולהשתיק גן למחלת הסרטן, הכליות ויתר לחץ דם
מתילציה של DNA
מתילציה של DNA היא תוספת פשוטה של קבוצת מתיל (CH3) למיקום 5 על טבעת הפירימידינים של שיירי הציטוזין בזוג ציטוזין-גואנין (CG).
המנגנון של מתילציה של DNA בבני אדם כביונקים מבוסס על מתיל-טרנספראזות של DNA (DNMTs), שאחראי להתהוותם של מודלים של מתילציה בכל הגנום, וחלבוני מתיל-CpG קושרים (MBDs), שאחראים לקריאת הסימנים הרלוונטיים. בין מתיל-טרנספראזות ה-DNA, אלו המסווגים כ-DNMT3A ו-DNMT3B הם שני האנזימים העיקריים האחראים על מתילציה דה נובו (דה נובו מציין שהמהלך נוצר בתוך האורגניזם מחדש.), בעלי פונקציות כמו שיפוץ מתילציה ודיכוי במהלך העובר. DNMT1, חשוב נוסף, ממלא תפקיד בביסוס דפוס המתילציה ודיכוי שעתוק על ידי התמקדות ספציפית ברצפי CpG עם hemi-methlyated. זוהו גם אנזימים כגון DNMT2 ו-DNMT3L, הממלאים תפקידים נלווים ביצירת הקומפלקס [מקור1, מקור2, מקור3]. דה-רגולציות במתילציה של DNA, בהיותה מנגנון דינמי וממלאת תפקיד מרכזי בשליטה בתזמון התהליכים התאיים, נקשרו למחלות רבות כגון סרטן, מחלות לב וכלי דם ונטייה להשמנה [מקור1, מקור2].
עד כה זוהו מספר מרכיבים תזונתיים שנחשבים כיום בקרב החוקרים למשפיעים על התפתחות או עיכוב של מחלה כרונית, או עיקוב תשדורת הגן למחלה. רכיבים אלו כוללים פולאט (folate) מירקות עלים ירוקים, חומצות קינמיות מקפה (cinnamic acids from coffee), שזיפים וקיווי, פוליפנולים כמו אפיגאלוקטצ'ין-3-גלאט (EGCG) תה ירוק, רזברטרול מענבים אדומים ומוצריהם, סולפורפאן ואיזותיוציאנטים מירקות ממשפחת המצליבים ברשימה זו נמצאים גם ליגנאנים מזרעי פשתן, סלניום וויטמין E. סבורים שרבים מהתרכובות התזונתיות הללו מספקות אפקט מגן מפני מחלות כרוניות, חלקן מגינים מפני התדרדרותה של מחלת הכליות, אחרים מגינים על מערכת הנשימה, הדם ואחרים נגד סרטן בכך שהם פועלים נגד ביטוי גן למחלה או על ידי השפעה על שינויים אפיגנטיים [מקור]. השפעות תזונתיות כאלה עשויות להיות ספציפיות לאיברים
[מקור1 – Verma, M. Cancer control and prevention by nutrition and epigenetic approaches. Antioxid. Redox Signal. 2012, 17, 355–364, מקור2].
המתילום הוא ההתפלגות הגנומית של רצף ה-DNA המתיל הקיים בתא והוא מסוגל לעבור שינוי ביחס לסביבה או לשלב ההתפתחותי. מתילציה של DNA כוללת הוספה קוולנטית של קבוצת מתיל בעמדה 5 של טבעת הפירימידין של ציטוזין המיוצגת כ-5-מתיל C או CMe. שעתוק רוב הגנים המקודדים לחלבונים ביונקים מתחיל בפרומוטורים עשירים ברצפי CG, כאשר הציטוזין ממוקם ליד נוקלאוטיד גואנין המקושר על ידי פוספט הנקרא CpG site. ה"p" ב-CpG מייצג את הקשר הפוספודיאסטרי שבין ציטוזין (C) לגואנין (G), הנוצר בעת פילמור חומצת הגרעין [מקור]. קטעים קצרים כאלה של DNA צפוף ב-CpG ידועים כאיי CpG. הגנום של אדם צעיר ובריא מאוכלס בדלילות באתרי CpG באזורים בין-גניים ורצפים חוזרים ונשנים, ורבים מהאתרים הללו מתילטים [מקור]. אזור זה נתון לפורענות – במחלות כרוניות, לעיתים קרובות מתרחשת היפו-מתילציה (hypomethylation) של אזורים אלה, ומכאן שהכרומטין נהיה מרווח או ארוז פחות בצפיפות וניתן לתמלל את ה-DNA [מקור1, מקור2, מקור3, מקור4].
במאמר "Epigenetics across the human lifespan" מאת ריא ר' קנהרקר (Riya R. Kanherkar) וצוות החוקרים שלה נזכר אוסף של השפעות אפיגנטיות על בני אדם. אלו מגיעות ממקורות שונים במרחב חיינו. בעוד שחלק מאלה עשויים להועיל לבריאות ולהתנהגות, יסודות חיים אחרים עשויים להזיק ולהפריע לגוף ולנפש ביוצרם חוסר איזון, שעלול להתבטא כמחלה או הפרעה פסיכולוגית. חלק מההשפעות המועילות המפורטות במאמר משנת 2014 הן פעילות גופנית, מיקרוביום עשיר ומאוזן (חיידקי מעיים מועילים) והסתייעות ברפואה אלטרנטיבית נטולת תרופות, ואילו השפעות מזיקות כוללות חשיפה לכימיקלים רעילים ולתרופות [מקור]. החוקרים מדגישים כי לגורמים כגון תזונה, שינויים עונתיים, מצב פיננסי, מצב פסיכולוגי, אינטראקציות חברתיות, תרופות טיפוליות וחשיפה למחלות עשויות להיות השפעות מזיקות בהתאם לאופי הספציפי של ההשפעה האפיגנטית שנוצרת. מקור האיור בצילום מסך מ- כאן.
המזון לא רק משפיע על הגנים שלנו, אלא השוני הגנטי בין אדם לאדם קובע גם איזה חילוף חומרים יעבור המזון שאנו אוכלים.
תחום הנוטריגנומיקה מנסה למצוא תשובות לשאלה כיצד נוטריינטים או דפוסי תזונה שונים משפיעים על בריאות האדם.
[מקור].
השפעת התזונה על שינויים אפיגנטיים והתפתחות ו/או התקדמות של מחלה כרונית
השפעות התזונה על מתילציה של DNA.
השפעות אפיגנטיות על בני אדם. מחקרים אפיגנטיים כוללים ניתוח של גורמי מנגנונים אפיגנטיים בתחום אי ספיקת כליות ומחלות כרוניות קשות אחרות. מספר מחקרים הציגו את ההשפעה של ויסות אפיגנטי, במיוחד מתילציה של דנ"א, על אי-ספיקת כליות וירידה של מדד הסינון הגלומרלי [מקור1, מקור2, מקור3].
צום חלבון – בחולדות ידוע שהגבלת חלבון שמגיע כמזון מהאם – הגבלה מתונה בתזונה שלו משנה פנוטיפים בצאצאים של חולדה לרעה, הגבלת חלבון זו היא צורה של רעב, מתבטאת ביתר לחץ דם, דיסליפידמיה ופגיעה בחילוף החומרים של גלוקוז. נושא הרעב נחקר רבות בבני אדם ומתקף ממצאים אלו. עם זאת, חריגות אלו ניתנות לביטול על ידי תוספת פולאט. הוכח כי השראת פנוטיפ שונה על ידי דיאטת הגבלת חלבון אימהית במהלך ההריון כרוכה בשינויים במתילציה של DNA ובשינויים היסטונים בגנים ספציפיים, כולל הקולטן לגלוקוקורטיקואידים (GR) (נמוך ב-33%; P <0.001) ו-PPARα ( נמוך ב-26%; P <0.05) בכבד של צאצאים צעירים ובוגרים [מקור1, מקור2].
מודל דבורת הדבש הדגים אף באופן ברור יותר את ההשפעות האפיגנטיות של התזונה על הפנוטיפ. דבורי הדבש מתפתחות ונעשות מלכות או פועלות, באופן התלוי אך ורק בתזונתן. אם מאכילים אותן בדבש מלכות או לחם במעבדה – הצאצא של הדבורה שונה באופן מהותי ותלוי התזונה שקיבל. הפנוטיפ השונה של דבורת הדבש מתרחש ככל הנראה באמצעות שינויים אפיגנטיים בדפוסי מתילציה של DNA הנגרמים על ידי סוגי הדבש השונים (מזון מלכות או דבש) [מקור]. מחקרים עדכניים יותר מצאו ש-35% מהגנים המוערים בדבורי הדבש צפויים לעבור מתילציה בדינוקלאוטידים של CpG על ידי מערכת מתילציית DNA משוכללת מאוד, מה שמרמז על כך שדבורי הדבש משתמשות במתילציה של DNA כדי לשלוט על רמות הפעילות של הגנים שעשויים להכריע ולכוון את תהליכים הביולוגיים הגורליים [מקור1, מקור2 – Elango N, Hunt BG, Goodisman MA, Yi SV DNA methylation is widespread and associated with differential gene expression in castes of the honeybee, Apis mellifera. Proc Natl Acad Sci USA. 2009;106:11206–11., מקור3].
חומרים ביוכימיים מסוימים המצויים במזון, כגון גניסטאין המצוי בסויה, רסברטול – פיטו אלקסין המצוי בענבים אדומים וביין אדום, או סולפורפאן – איזותיוציאנט המצוי בירקות מצליבים כמו ברוקולי, הם ליגנדים הנקשרים לגורמי שעתוק (שמתבטאים) ובכך משפיעים באופן ישיר על ביטוי של גנים ועל נתיבים במחזור התא.
הם נמצאו כווסתים של ביטוי ופעילות אנזימטית של DNMTs ושל HDACs, אנזימים חשובים המפעילים ומשתיקים גנים ספציפיים המעורבים בתהליכי הזדקנות והתפתחות סרטן [מקור1, מקור2, מקור3, מקור4, מקור5].
הסויה מכילה את האיזופלבונים גניסטאיןודידזאין גניסטאין (Polyphenols: Genistein) המצוי בסויה מעורר דיכוי הביטוי של הקולטן לאנדרוגן (ER-β); עיכוב של DMNT; מפעיל דה-מתילציה של מקדמי RARβ, p16 ו-MGMT; דה–מתילציה של מקדמים של miR-29a ו-miR-1256 [מקור1, מקור2]. כאשר ה-Genistein נקשר לאתר הפעיל של הקולטן לאסטרוגן, נמצא שהוא מעכב את הצמיחה של סרטן שד [מקור – Duffy, C.; Cyr, M. Phytoestrogens: Potential Benefits and Implications for Breast Cancer Survivors. J. Women’s Health2003, 12, 617–631], מצא כי Genistein מבצע דה-מתילציה של מקדמים מתילטים חלקית של miRNA-29a ו-miRNA-1256 בשורות תאים של סרטן הערמונית [מקור – Li, Y.; Kong, D.; Ahmad, A.; Bao, B.; Dyson, G.; Sarkar, F.H. Epigenetic deregulation of miR-29a and miR-1256 by isoflavone contributes to the inhibition of prostate cancer cell growth and invasion. Epigenetics Off. J. DNA Methylation Soc.2012, 7, 940–949.].
Suppress expression of the androgen receptor (ER-β); inhibition of DMNT; demethylation of RARβ, p16 and MGMT promoters; demethylation of promoters of miR-29a and miR-1256
רסברטול – פיטו אלקסין המצוי בענבים אדומים וביין אדום מעכב DNMT 3b; מעורר ירידה במתילציה של RASSF-1α עם הגדלת רזברטרול במחזור על ידי נטילת תוסף מזון כגון גרעיני ענבים מופעל גם דיכוי הביטוי של הקולטן לאנדרוגן.
ההשפעה של חומצה פולית על שינויים אפיגנטיים נחקרו רבות. פולאט מתקבל אך ורק מהתזונה.
וחומצה פולית יכולה לתקן פגיעה בצנרת הכליה כפי שמוכיח מחקר חדש שפורסם בנתור – כאן
- תרד – 1 כוס = 263 מק"ג של פולאט (כמות המהווה 65% מהתצרוכת היומית הנדרשת.)
- עלי קולארד – 1 כוס = 177 מק"ג של פולאט (44%)
- עלי לפת – 1 כוס = 170 מק"ג של פולאט (42%)
- עלי חרדל – 1 כוס = 103 מק"ג של פולאט (26%)
- חסה ערבית – 1 כוס = 76 מק"ג של פולאט (19%
- אספרגוס מבושל – 1 כוס = 262 מק"ג של חומצה פולית (65%)
- אבוקדו – 1 כוס = 90 מק"ג של חומצה פולית לכל כוס, (22%)
- עדשים – 1 כוס = 358 מק"ג של פולאט (90%)
- שעועית מנומרת (פינטו) – 1 כוס = 294 מק"ג של פולאט (74%)
- גרגירי חומוס – 1 כוס = 282 מק"ג של פולאט (71%)
- שעועית שחורה – 1 כוס = 256 מק"ג של פולאט (64%)
- שעועית לבנה – 1 כוס = 254 מק"ג של פולאט (64%)
- שעועית אדומה – 1 כוס = 229 מק"ג של פולאט (57%)
- שעועית לימה – 1 כוס = 156 מק"ג של פולאט (39%)
- אפונה כתושה – 1 כוס = 127 מק"ג של פולאט (32%)
- אפונה ירוקה- 1 כוס = 101 מק"ג של פולאט (25%)
- שעועית ירוקה – 1 כוס = 42 מק"ג של פולאט (10%)
- פפאיה – פפאיה אחת = 115 מק"ג של פולאט (29%)
- תפוזים – תפוז אחד = 40 מק"ג של פולאט (10%)
- אשכוליות – אשכולית אחת = 30 מק"ג של פולאט (8%)
- תותים – 1 כוס = 25 מק"ג של פולאט (6.5%)
- פטל – 1 כוס = 14 מק"ג של פולאט (4%).
והוא הופך ל-5,10-methylenetetrahydrofolate (MTHF). MTHF ופועל כתורם מתיל, הופך הומוציסטאין למתיונין ומעניק מתיל ל-DNA [מקור1, מקור2, מקור3]. קבוצות מתיל מתיונין וכולין משמשות ליצירת S-adenosyl-methionine (SAM), שהוא חומר מתיל חשוב של DNA [מקור1, מקור2, מקור3]. למחסור בחומצה פולית אין את אותה השפעה בכל הרקמות ובכל שלבי ההתפתחות [מקור]. באופן דומה, אלו עם הגנוטיפ MTHFD1 G1958A נמצאו בסיכון גבוה יותר ללדת תינוקות עם פגם בצינור העצבי, שנראה כי נובע מביקוש גדול יותר לכולין (למשל, מביצים) כתורם מתיל [מקור].
מחסור בפולאט הוא הנושא הבעייתי – ונחשב לגורם שמביאה לשילוב שגוי של אורציל (כלומר, גרימת מוטציות של אורציל), עיכוב DNMT1 וקידום מתילציה גלובלית ופרומוטורית חריגה
הקשרים בין חומצה פולית לשינויים אפיגנטיים [עשויים להשתנות בהתאם לצריכה של חומצה פולית – תזונתית בלבד [מקור Kim, Y.I. Folate and colorectal cancer: An evidence-based critical review. Mol. Nutr. Food Res. 2007, 51, 267–292].

פירות אדומים, צנון שחור, רימון, בצל, פירות יער, ואגוזים – נחשפו כמי שמכילים פוליפנולים ומקורות תזונתיים בעלי השפעותיהם על התהליכים התאיים והאפיגנום שהם מעורבים בהם. הנזכרים לעיל הם אנטי אוקסידנטים חזקים, כולם בעלי יכולת אנטי דלקתית מוכחת ובעלי השפעה אנטי–גידולית ונוירו–הגנה מבחינת יכולות האפיגנטיים שלהם הודות לתרכובות פנוליות שהם מכילים (חומצה p-hydroxybenzoic (pHBA), 3,4-dihydroxybenzoic acid (DHB; חומצה פרוטוקטכואית), 3,4,5-trihydroxybenzoic acid (חומצה גאלית),

פלבונולים הם מחלקה של פלבאנואידים בעלי עמוד השדרה 3-hydroxyflavone (שם IUPAC: 3-hydroxy-2-phenylchromen-4-one). השונות של ה- Flavonols (מפלבאנואידים – flavanols) נובעת מהמיקומים השונים של קבוצות ה-OH הפנוליות. הם נבדלים מפלבאנולים (flavanols עם "A") כגון קטצ'ין, סוג אחר של פלבאנואידים. שמם נודע כמי שיכול לחסום את דרכם של חיידקי E. coli בדרכי השתן כשמקורם בחמוציות. צילם ירון מרגולין (ניו יורק 2023)
קטניות (עדשים, שעועית, אפונה), פולי סויה, תלתן אדום מוגדרים כבעלי השפעות כימו-מונעות – מכילים בכמות גבוהה במיוחד פיטואסטרוגנים (Phytoestrogens), מסוג איזופלבונים (Isoflavones) כולל גנישטיין (genistein) ודידזיין (daidzein) [מקור – Kwiatkowska E. Fitoestrogeny w zapobieganiu osteoporozie. Prz Menopauz. 2007;11:306–309, מקור2]. פיטואסטרוגנים הם תרכובות פעילות ביולוגית הממלאות תפקיד חשוב במניעת הפרעות ניווניות, כולל גידולים (ניאופלזמות), מצבים קרדיווסקולריים ואוסטאופורוזיס [מקור1, מקור2, מקור3, מקור4 – Grajeta H. Functional foods in prevention of cardiovascular disease. Adv Clin Exp Med. 2004;13:503–510, מקור5]. הנ"ל בעלי תפקידים אפיגנטיים תלויי מינון להם תפקיד בעיכוב מתיל-טרנספראזות של DNA (DNMTs), ובאצטילציה של היסטון.

החוקרים מאוחדים בתפיסה ששינויים אפיגנטיים מתרחשים במהלך התפתחותם של תאים עובריים, אבל המחקרים החדשים מצביעים גם על הפוטנציאל לשינויים כאלה בהמשך החיים בעקבות תזונה שגוי. השינויים האפיגנטיים שמתרחשים "מאוחר יותר בחיים" בתגובה להתערבות תזונתית הם אחד המוקדים הברורים כיום למחלות כרוניות. (השינויים האפיגנטיים שנחקרו לאחרונה כוללים מתילציה של DNA, שינויים היסטונים והשפעת microRNAs – שנזכרים במאמר זה [מקור]. באמצעות ידע תזונתי אפשר לשנות את גורלה של המחלה ולהביא לתהליכי החלמה.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
For the avoidance of doubt, consult a physician (who knows in detail the general health of each patient or yours) before using any medicine, food, extract or any exercise. The information on Yaron Margolin's website or the "Healing Presses" website (on Facebook or MARGOLINMETHOD.COM), in the above article and in Yaron Margolin's articles are material for thought – philosophy neither recommendation nor public guidance to use or cease to use drugs – no information on this site or anyone You should always consult with a qualified physician or pharmacist regarding pain, bad feeling, or goals and how to use foods, ointments, extracts and even exercises, or other remedies that are mentioned as such
מאמרים אחרונים
- אפיגנטיקה ומזון כתרופה ביולוגית להחלמה ממחלות גנטיות
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- המוח נלחם על חייו. p62, אוטופאגיה והמשמעות החדשה של אלצהיימר
- המיקרוביום הכלייתי (האורוביום Urobiome) נחשף
- תאי T בזמן החלמה: כיצד מערכת החיסון מתכיילת בלילה כדי לרפא ולא רק להילחם בגורמים למחלה
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- התקף לב / אירוע לבבי בעקבות מחלת כליות – מסלול איתות שמגן על הלב בשם "VEGFA" משתבש בגלל מחלת כליות כרונית.
- גלוטתיון – מנוע התיקון המרכזי של הגוף
- מיקרופירין – נזקי האספירין
- בדיקת CrCl – מדד הפינוי האמיתי של הכליות
- ד"ר בינה מלאכותית – AI קובע. מה קורה באמת כשדוקטור AI – כשמכונה נותנת מרשם❓
- Kidney Regeneration: A Rare Case of Natural Healing — And What It Can Teach Us All
- ⭐ התחדשות כלייתית: מקרה נדיר של ריפוי טבעי — ומה שהוא מלמד את כולנו
- על ההחלמה – למה הגוף לא מחלים — וכיצד להחזיר לו את היכולת הטבעית לעשות זאת
- שינה חשובה להחלמה – 🌜זמן הריפוי החשוב מתרחש בלילה
- ניקוי כבד טבעי – הדרך הפשוטה לבריאות מתחדשת
- מלטונין הוכח שהורמון השינה נוגד חמצון רב עוצמה ויעיל כתרופה בקרב חולי כליה
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- תעוקת חזה מיקרו-וסקולרית
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- תחושת מחנק, דיספגיה – נתקע לי בגרון.
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- 8 חסרים תזונתיים שכיחים
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- – אורז מותסס בבית מתכון
- דיוקסינים במזון
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- חלבון בשלב אקוטי
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מרק גרין קארי – מתכון
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- התה הטחון – מאצ'ה Matcha מתכונים
- – אורז מותסס בבית מתכון
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- על ההשפעה האיומה של חלבון מן החי על הכליות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- חרדה
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- למה אני לא מצליח להתמיד – והסוכר
- ניתוק רגשי – על הקורוציונה
- נמאס לי מהחיים מה עושים
- התודעה השלילית
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- התכנית לשיקום הכליות
- אכל נקי
- מהן עיניים אדומות?
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- תזונה תאית
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- איך להיראות צעיר מגילך – כל הסודות
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- קריאת הגוף – מה אומרות פניך
- גלוטתיון כל האמת
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הליקובקטר פילורי – Helicobacter pylori חיידק חתרני שנמצא כמעט אך ורק בבני אדם – טיפול
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- שיראטאקי אטריות קונג`אק – מתכונים
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש
- מחקר חדש דילול השכבה הדמית [כורואיד (Choroidal)] ורשתית העין במחלת כליות כרונית קשור באופן ישיר לירידה ב-eGFR וניתנים לשינוי עם הטיפול התזונתי.
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- אמנות ההחלמה האבודה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- תוסף מזון על האסטקסנטין astaxanthin
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין A?
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- דיוקסינים במזון
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- מהו אימון שלפוחית השתן?
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- חלבון בשלב אקוטי
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו "שומר הגנום" גן p53
- תסמונת היד הסוכרתית – רמות גבוהות של A1c קשורות להתפתחות של נפיחות באצבעות היד שגורמת כאב ומכונה תסמונת התעלה הקרפלית (גם תסמונת מנהרת שורש כף היד).
- הפאסטיון המאהב של אלכסנדר הגדול Hphaestion
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- תוספי סידן – זהירות – סיכון לשבץ מוחי
- למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה.
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- תוסף מזון על האסטקסנטין astaxanthin
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- (תירואיד)
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- קרום התא – הממברנה והדלקת הכרונית
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- חרדה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- חזרה לבסיס – עקרונות צירופי המזון

כתיבת תגובה