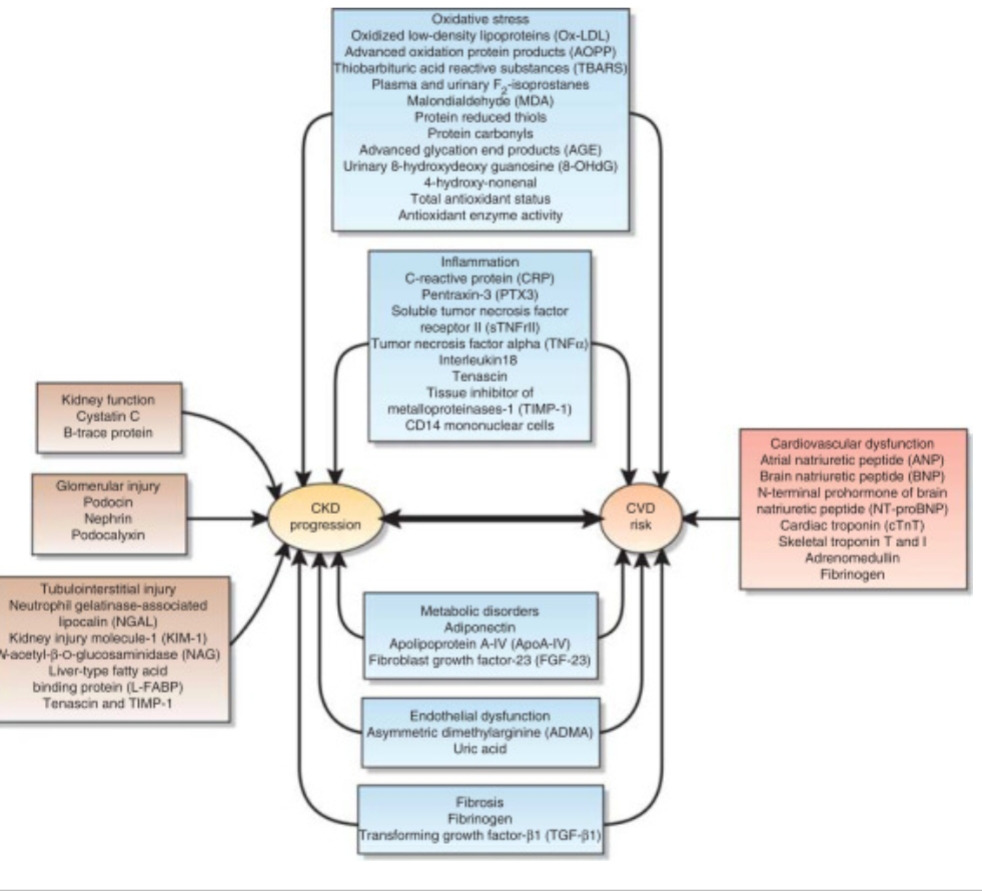
היעדר סמנים ביולוגיים מוקדמים עבור מחלת כליות חריפה AKI או אי ספיקת כליות CKD פוגע ביכולת שלנו להתערב בזמן ובתהליך ההחלמה
פגיעה בכליות חריפה (AKI) היא תופעה שכיחה ומצב רפואי חמור הקשור להידרדרות מהירה בתפקוד הכליות ושיעורי תמותה גבוהים [מקור].
ככל שהגילוי והטיפול מתחילים יותר מוקדם (ללא תרופות ובשיטת "אילוף הכליות הסוררות" היחידה עד כה שהוכיחה את יכולותיה להביא להחלמה – כאן) גובר קצב ההחלמה והצלחת המחלימים לשוב לחיים איכותיים מתבססת.
ההתנגדות לתרופות כלל עולמית וכוללת חוקרים רבים – להצלחת בלימת המחלה נדרשת גישה שונה וחדשנית, ללא תרופות – הסיבה לכך ברעלים אורמיים שתרופות מייצרות בגוף החולה [מקור1, מקור2]. רעלים כאלה קמים על המערכת של האברים ומדרדרים את המצב. רעלים אורמיים פוגעים באברים רחוקים: לב, ריאות, מערכת העיכול, מוח, דופן המעי ומערכת העיכול כך שבהמשך התרופות הן שמחריפות את הפגיעה בכליות – נושא עליו אפשר לקרוא עוד כאן וכאן.
ללא ספק מחלת הכליות החריפה AKI ואי ספיקת כליות CKD תלויה באופן גורלי בתחילת טיפול מוקדם ככל האפשר
המחלה עצמה נמדדת לפי דרגות חומרה [מקור] אלא שברור כיום כי
זמן הטיפול הטוב ביותר ב – AKI מתפספס בקלות בשל העדר מדד למצבי תחילה של מחלת הכליה החריפה (AKI) – מחלה שמוגדרת בירידה פתאומית בתפקוד הכליות הכולל, מה שניכר בעייפות גוברת ומדד GFR או (eGFR) נמוכים ומי שרק הולך ומתרסק כלפי מטה במהירות הוא ה- GFR או שמזהים עליה של הקריאטינין בסרום (SCr) הוא רעל אורמי מסוכן
[מקור] וכן קטגוריית אלבומינוריה לשלבים 1-5 [מקור]. יש לזכור כי בפגיעה חריפה בכליות, קיימת ירידה מהירה בקצב הסינון הגלומרולרי (GFR), מה שמוביל להצטברות של פסולת חנקן כמו קריאטינין וחנקן אוראה בדם – גם היא רעל אורמי מסכן [מקור].
אנו עדים כיום לגוף גדר והולך של ספרות אשר מתפתחת כל הזמן על-מנת לאפשר להגיע לטיפול מהר ככל האפשר.
[מקור].
המחקרים שמתפרסמים מצביעים על כך שלא רק שישנם סמנים ביולוגיים חדשים של מצב הפלזמה (דם) ושל נוזל השתן שיכולים לאבחן AKI ומחלת כליות טרם מתחילה התדרדרות הכליה. החשיפה של קריאטינין בפלזמה, אמנם מאפשרת מדידת GFR מהירה אבל נוכח גילויים חדשים היא נראית כיום בלתי מספיקה ומאוחרת מדי. איחור זה עלול למנוע החלמה.
אין להתעלם מהתופעה שתרופות מחמירות את מחלת הכליות החריפה – AKI
[מקור].
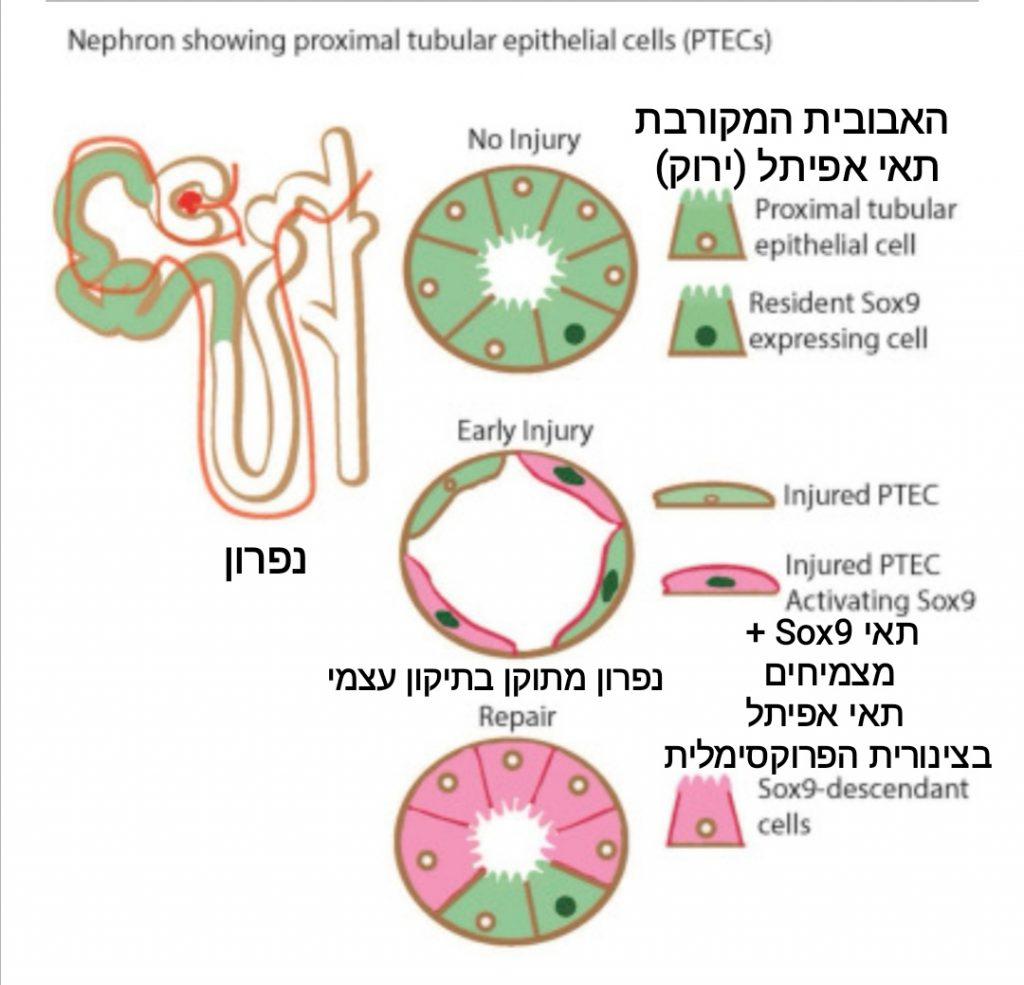
ישנו משבר רפואי שהולך וגובר בנפרולוגיה. רואים מספר גדל והולך של חולים אשר סובלים ממחלות כליות שמגיעות לשיא באי ספיקת איברים [מקור].
There is an escalating medical crisis in nephrology as growing numbers of patients suffer from kidney diseases that culminate in organ failure [מקור].
במהלך 50 השנים האחרונות, שיעורי התמותה של חולים עם מחלת כליות חריפה שהגיעו לטיפול נמרץ נותרו גבוהים, ועמדו על שיעור של כ-50% עד 70% [מקור1, מקור2]. יצויין שאלו שנשארו בחיים לא החלימו אלא עברו לדיאליזה או זכו לאבר חילופי אחר – המחקרים מציינים גם כמה שנים החזיקו מעמד בטיפולי תחזוקה אלה, אבל התמונה מעוררת ייאוש או חרדה. בנוסף לכך ההתערבויות האלו הגם שכשלו בדרך כלל יקרות. הטיפול ב-AKI (מחלת כליות חריפה) בארה"ב יוצר נטל כלכלי עצום על החברה, עם הוצאות רפואיות שנתיות הקשורות ל-AKI שמוערכות באופן שמרני ב-8 מיליארד דולר [מקור] וזאת מבלי להוסיף שההישג בתהליכי החלמה אפסי לכאורה רואים רק מוות של חולי כליה.
מאמר זה קורא להיבדק ולהתחיל בתהליכי החלמה מהר ככל האפשר נושא שהוכיח עצמו כיעיל ביותר.
למאמרי – אפיגנטיקה – על האופן בו אפשר להשתיק גן שמעורר מחלה, בעזרת סיבי תזונה.
- אפיגנטיקה ומזון כתרופה ביולוגית להחלמה ממחלות גנטיות
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- פיקנוגנול – המתכון הסודי – כאן.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית.
- תכנית לשיקום הכליות – פרק א'
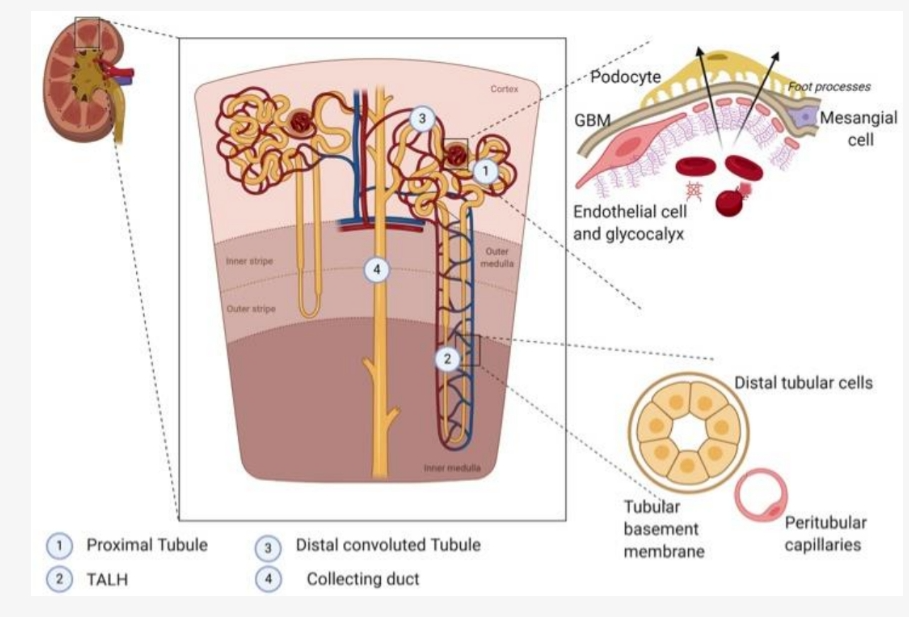
נראה שהיסוד של פגיעת הכליות הקשה קשור במיטוכונדריות. הוא ליקוי אנרגטי שמתרחש במקטעי הנפרון הפעילים ביותר מבחינה מטבולית (כלומר, אזורים בנפרון בשם צינוריות פרוקסימליות ואיבר הנלה העולה העבה) באזור הכליה שמכונה ליבה של הכליה הבנויה ממבנים דמויי פירמידות, [מקור] או המדולה החיצונית הכלייתית, מה שיכול לעורר המרה מהיפוקסיה חולפת [ירידה בלחץ הדם ומצב פתולוגי של חוסר חמצן בתאי הגוף (רקמת הכליה במקרה זה)] לאי ספיקת כליות [מקור].
מתוך Israeli nephrologist at Sheba Medical Center uncovers new findings about reversing kidney disease. – כאן
למאמרי על אובדן גמישות העורקים – אפשר לקרא – כאן.
למאמרי התכנית לשיקום הכליות – כאן
אי ספיקת כליות – טיפול ללא תרופות
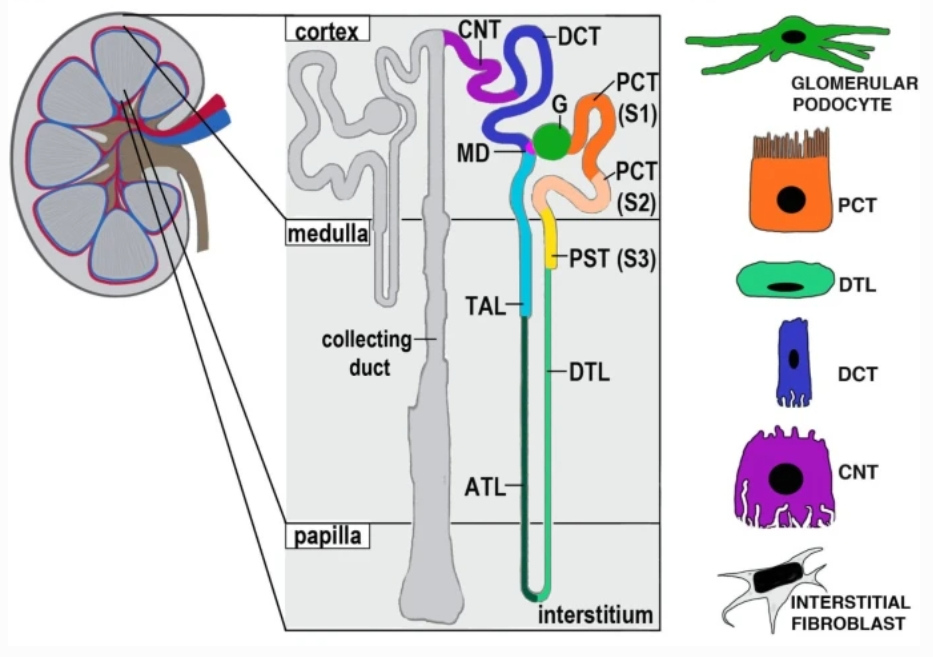
בטיפול מוביל החלמה והבטחה לשינוי איכות הנוזל התוך והחוץ תאי מזהים תיקון רקמות נפרוגניות כנראה באיורים למעלה
לאחר פגיעה חריפה בכליות (AKI), תאי האפיתל גורמים ליצירת מתווכים דלקתיים ואזואקטיביים, אשר יכולים לפעול על כלי הדם ולהחמיר בכך את התכווצות כלי הדם וגם את הדלקת [מקור], כך שהכל מכווץ הזרימה נעשית לא אפשרית ורעלים אורמיים נערמים. כל הסיטואציה הזו מאיצה את המחלה [מקור].
בניגוד למתרחש בעת פגיעה בלב או במוח, הכליה משחזרת ביעילות ובמהירות, בתנאים שמאפשרים לה זאת כמו בשיטת "אילוף הכליות הסוררות" (שמשתמשת בין השאר לשם כך בויטמינים B1, K, , וD, תזונתיים וממקור טבעי (השמש) גם בסיבים תזונתיים, והקפדה על הפחתת רעלים אורמיים בתהליכי ההזנה: תרופות, חלבונים מהחי וטחינה. תאים שאבדו עקב פגיעה איסכמית (הגבלה בזילוח דם לרקמה) או רעיל שגורמת למוות תאים [מקור]. התאים ששרדו בתוך הנפרון מתפשטים ומתקנים את סביבתם [מקור],
נראה כי עיכוב או עיכוב של תיקון רקמות נפרוגניות מוביל להתקדמות המחלה שבסופו של דבר מובילה במהירות למחלת כליות כרונית, אי-ספיקת כליות ומוות, בעוד שתיקון רקמות שמתחיל קרוב לאירוע הפגיעה גם מונע נזק לנפרון וגם מוכיח עצמו שוב ושוב בקליניקה שלי בשיטת "אילוף הכליות הסוררות" כמוביל להחלמה. התוצאה ניכרת בחזרה מהפציעה וסלילת דרך להחלמה [מקור1, מקור2, מקור3].
כיום אנו מזהים את האוסטאוקלצין(חלבון קטן מרקמת עצם, שזוהה לראשונה בשנת 1974 שהכיל 3 שיירי Gla מושרים על ידי וויטמין K- Sox9, כלומר הפעלתו התקינה תלויה בנוכחות מספקת של וויטמין K) שותף לתהליך בנית האבר מחדש [מקור].
חלבון – Sox9 הוא אחד מחלבוני ה-DNA בעל כשרי התחדשות ומי שמשפיע על התחדשות הכליות וחידוש תאי האפיתל בהן. לאחר שזוהתה פגיעה חריפה בכליה (AKI) ה Sox9 משתלט על המצב (אם מאפשרים לו זאת) והוא מתחיל לנהל בדרכו, את הארגון המרחבי של התאים במהלך התפתחותם ומכוון להחלמה. מדובר בחלבון שמעורב הן בהתחלות והן בהתקדמות של בניית תאים ובמקרה השלילי בהתפתחות של גידולים סרטניים [מקור]. בנוסף תפקידו כווסת מאסטר של מורפוגנזה – נושא שנקשר בהתפתחות הצורה והמבנה של כל גוף חי, אחד משלושה אופנים עיקריים של התפתחות ביולוגית (השניים האחרים הם גדילת תאים והתמיינות תאים) הוא שמעניין את המבקש להביא לתהליכי החלמה, כמוני. בעזרתו אפשר וגם משיגים בניה מחדש של צנרת הכליה. בנוסף לכך החלבון הזה האוסטאוקלצין Sox9 בעל שליטה על הסביבה של התא, בידול התא והפצתו. במהלך התפתחות שיקום עצמי של הכליה האוסטאוקלצין – חלבון ה-Sox9 פורץ מהנוזל הבן תאי – המטריקס (המשתית) שבעצמות – תהליך שנובע מתפקידי שליטה על הסביבה התוך-תאית, שהוזכרו לעיל: בידול התא והפצתו. [מקור]. ללא שמירה על איכות הנוזל והרכביו הכימיים – נושא שמטופל על ידי סיבי תזונה נכונים וויטמינים (K – ברוקולי, כרוב, חסה, אבוקדו, ושמן זית ) נקשר באפיגנטיקה – חסרונו עולה ומופיע באוסטאופורוזיס, כשל כליות כרוני, ירידה בתפקודה של בלוטת התריס ומחלה שגורמת לעיוות בעצמות – מחלת פאג'ט [מקור].
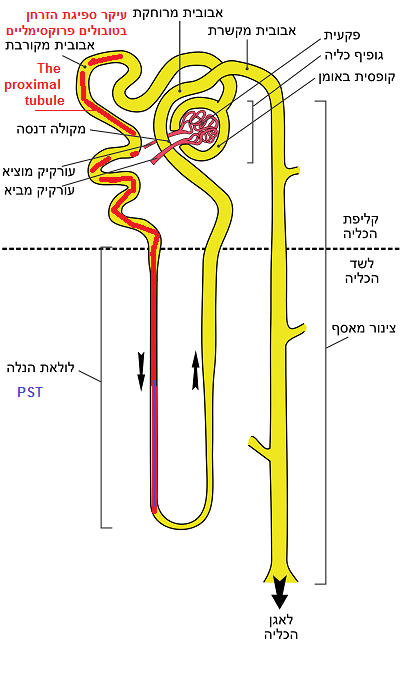
בניסוי שנערך באוניברסיטת שנחאי (2017) נמצא לאחר ניתוח כריתה חלקית של כליה תאי Sox9 הופיעו יום לאחר הניתוח והמשיכו לתפקד והתקיים שם עד 20 יום. לתאי Sox9 + היו יכולת התפשטות מוכרת, ויכולת להצמיח תאי אפיתל של צינורית פרוקסימלית (המקורבת – איור למעלה) בכליה, לולאה של הנלה (PST- באיור למעלה), צינורית דיסטלית, צינור איסוף ושכבת הנפרון הכרות בכליה (לא מופיע באיור) [מקור], האברים המרכזיים עברו שיפוץ והכליה עברה תיקון [מקור], אבל לשם השגת תיקון חובה עלינו לייצר סביבה תומכת ולשנות בעזרת מזון את איכות המבנה הכימי של הנוזל הבן תאי בו חלבון זה פועל. ויטמינים שמאפשרים להעלות את רמת האוסטאוקלצים בדם ביעילות מוכרת למי שהביא כליות להחלמה: ישיבה של רבע שעה בשמש ויצירת ויטמין D עצמית [מקור]. אספקה סבירה של ויטמין K מחייבת כמויות אדירות של עלים ירוקים לשם כך אני משתמש במיץ ירוק.(עלים ירוקים, ברוקולי, כרוב, חסה, אבוקדו וגם בשמנים מסוג קנולה, שמן זית. גם סיבים מפסיליום שמייצר גלוטתיון על-ידי הזנת אוכלוסיית חיידקי המעי הגס.) הפחתה מסיבית של רעלים אורמיים שמקורם במזון הכרחית לצד סילוק רב ככל האפשר של תרופות כאלה שמספקים נפרולוגים רבים לכאורה,.

סמנים ביולוגיים ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
הקריטריונים לאבחון מחלת כליות חריפה AKI השתנו בעקבות המחקרים האחרונים והנאמר למעלה [מקור]. פרסום עקשני של ראיות חוזרות מצביע על כך שאפילו שינויים קטנים ב-GFR יכולים למנוע החלמה. כמו ירידת המדד אל מתחת ל GFR 33 שהיא גורלית. שינויים אלה תלויים בדרך כלל בקריאטינין בדם נושא שמנבא תוצאות גרועות להחלמה [מקור]. אחת הסיבות לראיית תוצאות החלמה כה טובות בקליניקה שלי נובעת מהשיטה שהתפתחה בקליניקה של "לחיצות ההחלמה" לעלות כל הזמן את ה- GFR.
כליות בריאות מרחיקות את האוריאה מן הדם ומעבירות אותה לשתן.
אחד התפקידים החשובים ביותר של הכליה הוא סינון והפרשת פסולת חנקן מהדם. פסולת חנקן משפיעה על איכות והממבנה הכימי של נוזלי הגוף. Uremia – כאשר הכליות מפסיקות לסנן רעלים דרך השתן היא נוטה ליצור אמוניה רעילה, אשר מעלה את ה-pH של נוזלי הגוף. חלק מהפסולת החנקנית בגוף האדם הופך לחומצת שתן, אמוניה ואוריאה ומקדם אורמיה (Uremia – שם נרדף לאי ספיקת כליות מאוד מתקדמת) [מקור] נושא שמשנה את לחץ הדם ותפקוד התאים. נזקיה מחייבים פינוי מהיר מהגוף והפינוי מתבצע בעזרת צינור השתן. המדידות של רמות גבוהות של חנקן אוריאה בדם (BUN) או אוראה, וקריאטינין גם חומצת שתן (Uric Acid) משמשים לאבחון מצבם שך הרעלים שנשארים בגוף ולא מופרשים – מסולקים מהגוף. מדדים אלה מיידעים על חוסר תפקוד הכליות בתחום סילוק הרעלים מהגוף.
במשך שנים (כ -50 שנה) זיהוי כמות הרעלים שמקורם בפסולת חנקן בגוף (אוראה או BUN) שימשו סמן בלעדי לתפקוד הכליות בפועל [מקור]. כל אחד ממדדים אלה מעיד בנוסף על ירידה בפינוי של פסולת חנקן מהדם גם על הפחתות בזרימת הדם הכלייתית ובמסה של האבר עצמו [מקור1, מקור2], כמו גם מדידת ערכי הסינון הפוחתים של הפקעית בכליה – גלומרולוסקלרוזיס, מה שמכונה בדרך כלל מדד הסינון הפקעתי (GFR) כולם משקפים כשל תפקודי וירידה מהירה של יכולת סילוק הרעלים GFR של הכליה. במקביל לירידה זו הכליה שואפת לשמור דווקא על פסולת חנקן (זו גוררת עליית המדדים), בעיקר של קריאטינין BUN ואוראה בדם [מקור] אבל גם בשתן. ההתייחסות לעליה בקריאטינין רחבה ביותר ומעניקה לרופאים הזדמנות להמליץ על נטילת תרופות, נושא זה מאוד בעייתי. תרופות מרחיבות את אוכלוסיית הרעלים האורמיים בדם (UTs): אוראה, קריאטינין, חומצת שתן מוגדרים כיום רעלים אורמיים. ניתן להגדיר רעלנים אורמיים (UT) כשאריים של תרכובות אורגניות שלא ניתן לסלק מהגוף, ולכן הן מצטברות בזרם הדם ומגיעות כרעלים אורמיים לאיברים שונים, כולל הכליות, הריאות, המוח והלב [מקור1, מקור2, מקור3]. ככלל הרעלים האורמיים (UTs) משבשים את תפקודם של אברי הגוף החיוניים ביותר: מוח, לב, כליות, מערכת העיכול [מקור]. נושא זה נחקר כיום ומוצג במאמרי מחקר בספרות המקצועית גם במאמרי: הצלבת אברים (Crosstalk) – אפשר לקרוא אותו כאן. אבל ולרוע המזל, קריאטינין בסרום הוא אינדיקטור מושהה ובלתי אמין ע"פ מחקרים חדשים להתפרצות המחלה החריפה – AKI [מקור] ויש לכך מגוון סיבות [מקור1, מקור2, מקור3, מקור4, מקור5]. אפילו קריאטינין תקין בסרום מושפע ממספר גורמים שאינם בהכרח מחלת כליות כגון תפריט תזונה שגוי (קצב הסינון הלומרולרי (GFR) גדל בצורה חריפה בעקבות ארוחה עתירת חלבון או עירוי מערכתי של חומצות אמינו [מקור1, מקור2]. מזה מאה שנים ידוע לחוקרים כי חלבון מהחי בהבדל מחלבון מהצומח מגביר את מנגנון זרימת הדם בתוך הכליה ומשפיע הן על תפקודה והן על המדדים לרעה [מקור1, מקור2), מין, מסת שריר, חילוף חומרים בשרירים, תרופות, מצב הידרציה – מִִיוּם: מולקולות המים עוטפות את החומר המומס בגוף כך שהן מפנות את הקטבים החיוביים שלהן אל הקטבים השליליים של המומס. וכן את הקטבים השליליים שלהן אל הקטבים החיוביים של המומס.), והפרשת צינוריות הנפרון שבכליה, בנוסף לכך
מספר מצבי כליות חריפים וכרוניים יכולים להתקיים ללא עלייה בקריאטינין בסרום
בשל הרעיון של רזרבה כלייתית (renal reserve (RR) היא היכולת של הכליות להגביר את קצב הסינון הגלומרולרי הבסיסי שלהן (GFR) ב-20% לפחות לאחר עומס חלבון [מקור]. במחלת כליות תת-קלינית, לפני שה-GFR הבסיסי מתחיל לרדת, ניתן לגייס רזרבה תפקודית כלייתית באופן שמשמר את תפקוד הכליות, כך שהמחלה לא ניכרת בפועל בבדיקת ה- GFR הגם שהיא כבר החלה. כלומר אם ככל שהאדם מתחיל מהר יותר לטפל בבעיה בגישה שמביאה להחלמה למשל "אילוף הכליות הסוררות", שלא מכבידה על הגוף ביצירת רעלים אורמיים נוספים שמקורם בתרופות, או בחלבון מהחי, או מזיהום אויר מתאפשרת לו החלמה מהירה יותר. וככל שיאחר הזדמנות זו מוטלת בספק. יוצא מכך שבהצלחת האבחון תלויים למעשה חיי המטופל, לכאורה. אלא שבשיטה הקיימת: שיטת ה- GFR, ברגע שניתן כבר לזהות ירידה ב –GFR הבסיסי, מחלת הכליות כבר מתקדמת ומשגשגת תעשיית שימורם של הרעלים האורמיים כמו גם ירידה בתפקוד אברי הגוף ומערכת החיסון [מקור].) – ההערכה היא כי יש לאבד למעלה מ-50% מתפקוד הכליות לפני עליית קריאטינין בסרום [מקור], ריכוזי הקראטינין בסרום אינם משקפים את הירידה האמיתית ב-GFR במצב החריף, מכיוון שחייבים לחלוף מספר שעות או ימים לפני שנווצר שיווי משקל חדש בין הייצור, ככל הנראה, לירידה בהפרשה של הקריאטינין. הוכח כי מאגרי כליות, רמות הקראטינין בסרום עשויים להישאר ולא לעלות גם רק כאשר כ-50% מתפקוד הכליות אובד [מקור], עלייה בקריאטינין בסרום (בדם) מייצגת אם כן, אינדיקציה מאוחרת ומיושנת לגבי מי שמבקש להביא להחלמה ולא לדיאליזה. שינוי תפקודי לרעה ב-GFR שמתדרדר ויורד לצד שינויים מבניים חשובים המתרחשים בכליה ובהמשך באברים רחוקים הוא שלב הנזק המוקדם של AKI ואבחון מאוחר מסייע בעדו [מקור1, מקור2, מקור3]. מדדים אלה בהחלט מקובלים עדיין אבל הם כשלעצמם לא רק חלק מיושן אלא מעניק במה רחבה לגישה מקוממת שלא הראתה שום תוצאה מכבדת במאה השנים האחרונות במרחב הנפרולוגיה שמכנים אותה החלמה או רפואה. בנוסף לכך ה-GFR פעמים רבות גם לא נמדד מוקדם מספיק על הבמה ההיא – כך שהיוודעות החולה למצב בדרך כלל מתבצעת בשלב מאוחר עוד יותר וגם כך רק מעטים מאבחנים על-פיו נכון את התוצאות ההרסניות הממתינות מעבר לפינה. כאשר eGFR יורד בכ-0.75 מ"ל/דקה/1.73 קצב התקדמות מחלת הכליות מתחיל לזעזע והתקדמות המחלה לא רגילה, קופצנית, ובוודאי היא לא אטית [מקור1, מקור2]. לדעתי
מרגע שהמדד של הGFR יורד את ה- 90 יש להתחיל בטיפולי החלמה – ללא תרופות.
אין להתעלם מהתופעה שתרופות מחמירות את מחלת הכליות החריפה – AKI
[מקור].
יש להימנע מכל הסוכנים הנפרוטוקסיים הפוטנציאליים שניתן להפסיק [מקור] יש לפעול בזריזות לזיהוי המחלה ולמהר להכנס לטיפולי החלמה ללא תרופות. שהרי
ידוע שרעלים אורמיים (UTs) מיוצרים בעיקר על ידי חלבון מהחי שעבר חילוף חומרים על ידי המיקרוביוטה של המעי הגס [מקור], והומר בכבד או על ידי מיטוכונדריה או אנזימים אחרים
התגובה הנורמלית של הכליה למצבים טרום-כליים היא לרכז את השתן בצורה מקסימלית וביתר שאת להביא לספיגה מחדש של נתרן במאמץ לשמור/להגדיל את הנפח התוך-וסקולרי ולנרמל את הזילוף הכלייתי (renal perfusion) פרפוזיה הכלייתית [מקור1, מקור2].
לכן רוב הסמנים הביולוגיים של AKI (The biomarkers of AKI) שנמצאו כמדד יעיל עד כה נמדדים בשתן. לאבחון שתן יש מספר יתרונות, בשל האופי הלא פולשני של איסוף הדגימות, והפוטנציאל לפיתוח ערכות לבדיקה עצמית של המטופל גדול. עם זאת, ריכוז הסמנים הביולוגיים בשתן משתנה ולא מהווה מדד תקין בקרב אלו שנוטלים כדורים משתנים למשל, [מקור]. בדיקת דם או אבחון מבוסס פלזמה (בדיקת דם) חולל מהפכה בהיבטים רבים של האבחון הרפואי, כפי שאנו מכירים בבדיקת טרופונינים לאבחון מוקדם של אוטם שריר-הלב החריף, אבל במקרה של אי ספיקת כליות חריפה המצב שונה כי אלו עלולים להיות מעוותים על ידי מקורות חוץ-כלייתיים ועל-ידי שינויים תת-קליניים שמשפיעים על יכולת הליה לסלק רעלים. לפיכך, במקרה של רצון לקדם טיפול כלייתי ולאבחן AKI תחילי, מחוייבים אנחנו בפתוח זיהוי לסמנים ביולוגיים בשתן וגם בדם (בפלזמה) [מקור1, מקור2, מקור3, מקור4] ויותר מכך להיעזר למען החלמת חולים באלו שנחשפו בפנינו.
קידום החלמה מחייב באופן דחוף שימוש בסמנים ביולוגיים נכונים כדי לאפשר אבחון מהיר יותר של מחלת כליות חריפה – AKI, ועמידה מוקדמת על חומרת הפציעה והערכת בטיחות תפריט ההחלמה במהלך מסלול ההחלמה
[מקור].
דמוי טרופונין
סמן ביולוגי דמוי טרופונין של AKI טרופונין (Troponin) הוא הסמן העיקרי כיום בשימוש בארץ כדי להעיד על התקף לב והוא נמדד בקלות, ולא מושפע ממשתנים ביולוגיים אחרים. דמוי טרופונין מסוגל לסייע למטפלים כמוני לגילוי מוקדם ובניה מהירה של אסטרטגיית טיפול [מקור1,מקור2, מקור3, מקור4, מקור5, מקור6] שיכולה לקדם החלמה במהירות. עד כה הבאתי להחלמה גם בפחות משלושה חודשים. ההחלמה המהירה הוכחה אפשרית, אבל על המטופל להגיע לטיפול מהר. מדידת טרופונין מוכרת כסמנים לבביים אחרים כמו CPK-MB או מיוגלובין, אלא שבחינתו יעילה גם כאן יותר בשל סגוליותו הרבה של טרופונין לתאי שריר הלב באופן שמציאות רמה מוגברת שלו בנסיוב, הסמן הזה בעל רגישות וסגוליות גבוהות ביותר לזיהוי נזק בלב. סיבה נוספת לביצוע מדידת טרופונין בתהליך האבחון והעיבוד של מטופלים המגיעים לחדר מיון עם כאבים בחזה, היא למטרת שלילה או אישוש של אירוע כלילי חד (ACS), וכן לאבחנה מבדלת בין תעוקת חזה בלתי יציבה לבין אוטם שריר הלב. השימוש בדמוי טרופונין משמש דוגמא לאבחון החדש הנדרש גם במחלת כליות.
סמנים ביולוגיים יכולים לשרת מספר מטרות נוספות באבחון מחלת כליות חריפה-AKI [מקור1,מקור2, מקור3, מקור4, מקור5, מקור6]:
אדנין פוגע במיטוכונדריה
אדנין (Adenine) הוא בסיס חנקני, נגזרת של פורין
כל מולקולת DNA (תוכנת ההפעלה שלנו) מורכבת מארבע יחידות של בסיסים חנקניים (נוקלאוטידים): אדנין (A), גואנין (G), תימין (T) וציטוזין (C).
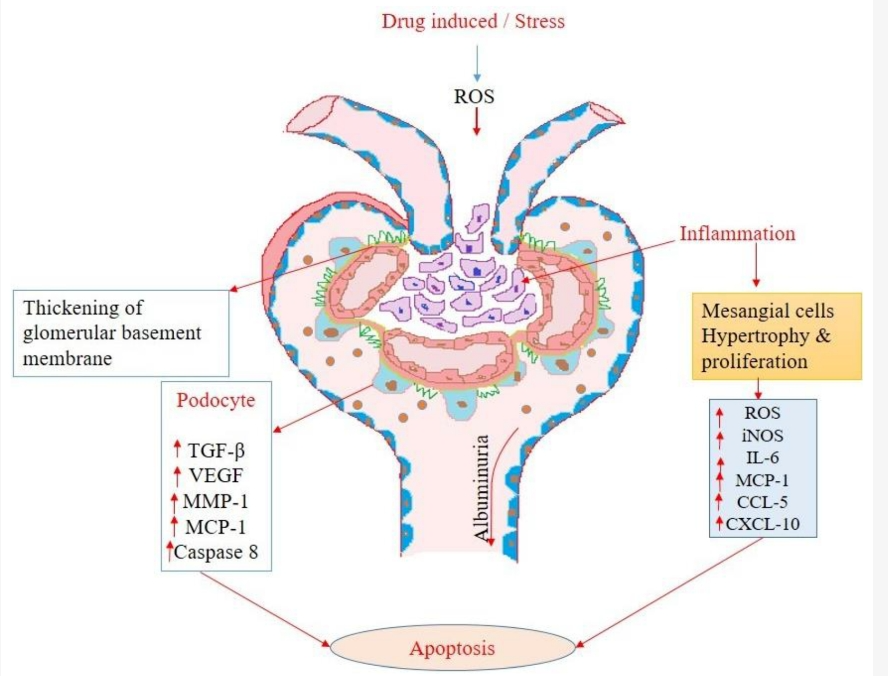
מסיסותו הירודה של האדנין ונגזרות אדנין בשתן עלולה להביא להצטברות חומרים עם בסיס ונקני בצינורית הקטנה – אבוביות שבכליות או וגם ברקמות הביניים. נושא שעלול להתפתח ולהוביל לפגיעה כלייתית [מקור]. אדנין פועל גם על צינוריות הכליה כמולקולת איתות, וגורם לסוכרת נפרוגנית עם הפרשת יתר של מלחים ונוזלים בכליות [מקור1, מקור2]. בניסוי שהתבסס על יתר אדנין בתזונה התפתחה תחלואה כלייתית ואי ספיקת כליות עם פיברוזיס נרחב, ניוון צינורי, והיווצרות גבישים לצד הסתיידות כלי דם חמורה [מקור]. ידוע שהעדר מרכיבים אנטי חימצוניים, מול מתח חמצוני ואפופטוזיס של תאי שריר חלק בכלי הדם הם המפתח להסתיידות כלי דם בחולים עם CKD והתקדמות ל-ESRD [מקור]. יתרה מכך, אי ספיקת כליות יכולה להיות מלווה ברמות מוגברות של קריאטינין בסרום, חנקן אוריאה בדם, חלבון בשתן, ציטוקינים דלקתיים, כולם גורמים פרופיברוטיים, חמצון שומנים וחוסר תפקוד מיטוכונדריאלי בתזונה עשירה אדנין [מקור], 5/6Nx [מקור] ו-UUO דגמים [מקור1, מקור2].
נקבוביות המעבר בחדירת המיטוכונדריה (mPTP) הוא קומפלקס חלבוני שקיים בין הממברנה המיטוכונדריאלית הפנימית (IMM) לבין הממברנה (דופן) המיטוכונדריאלית החיצונית (OMM). ה-mPTP מורכב מתעלת אניון תלוית מתח (VDAC) וחלבון אדנין נוקלאוזיד טרנסלוקטור (ANT) אשר פועלים לוויסות MMP עבור הומאוסטזיס מיטוכונדריה. בתנאים פתופיזיולוגיים, עודף Ca2+ ו-ROS גורמים לפתיחה מוגזמת של ה- mPTP וגורמים לאפופטוזיס הקשורים למיטוכונדריה. כך עוברת המיטוכונדרה מאברון חוסך אנרגיה למכשיר פיזור ובזבוז אנרגיה אשר תורם להתפתחותה של הפתופיזיולוגיה התאית, ובהמשך לאי ספיקת כליות [מקור]. המבקשים החלמת כליות מכוונים אל מקום זה ומשתמשים בחומרים שמבטלים את המתח החימצוני או את עודף הCa2+. במיטוכונדריה מבודדות במעבדה מזהים השפעות על פתיחת ה-PTP שמגיעות ממגוון גדול של תרכובות הפועלות או כגורמים מעוררים (כמו חימצוני תיול) או מעכבים (כמו Mg2+, נוקלאוטידים אדנין ו-pH מטריקס חומצי; לרשימה ממצה – כאן) [מקור]. מקור האיור בצילום מסך מהמאמר: "Oxidative Stress and Mitochondrial Dysfunction in Chronic Kidney Disease " – כאן
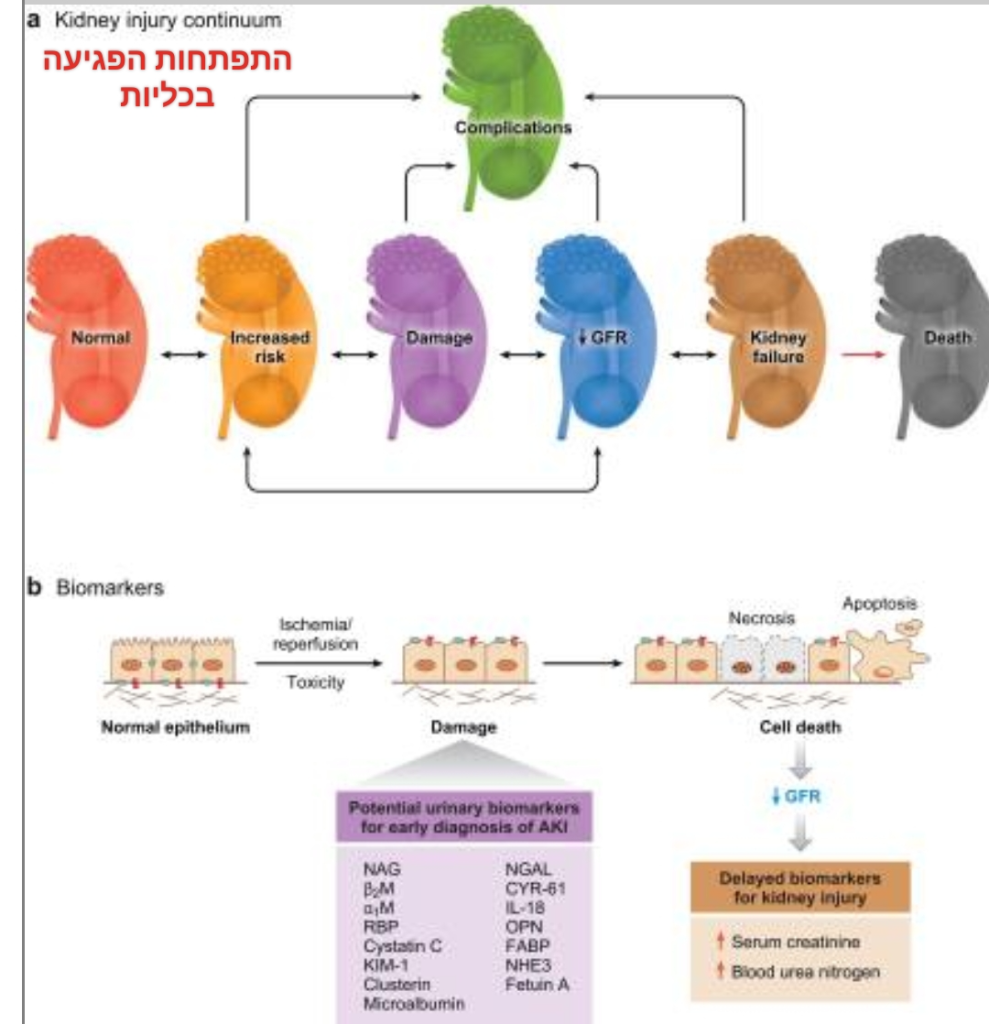
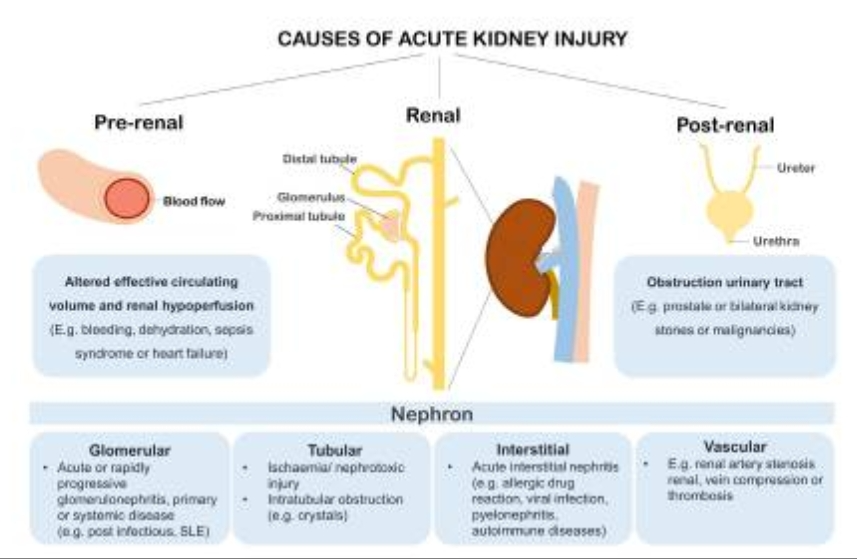
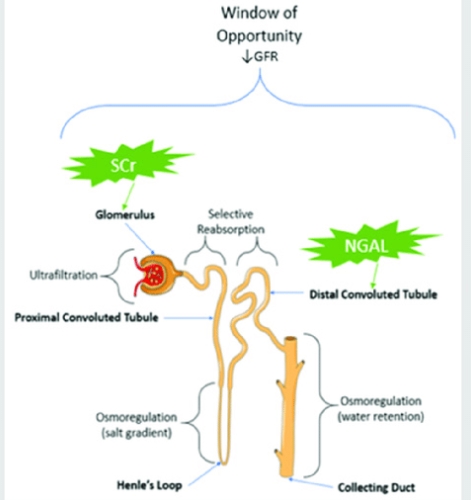
התפתחות מחלת הכליות וירידה של ה- GFR ניכרת בשלב מאוחר מדי (באיור למעלה בכליה הכחולה) סמנים ביולוגים כעמדת איבחון עדכנית של AKI יכולים להיות מרכיבים של סרום בשתן גם מחקרי הדמיה או כל פרמטר שניתן לכמת למטרה גורלית ומכריע חיי אדם לזכות. עד כה ללא ספק נוזל השתן הניב את הסמנים הטובים ביותר לגילוי מוקדם של AKI, זיהוי מנגנון הפציעה והערכת מקום וחומרת הפציעה (איור למעלה).
ניתן לחלק את תהליך הפגיעה הכלייתית החריפה לשלבים הפיכים שונים בהתאם לחומרת הפגיעה,
החל מסיכון מוגבר לנזק ואחריו ירידה בקצב הסינון הגלומרולרי (GFR) המתקדם עוד יותר לאי ספיקת כליות ומוות. מניסיוני השלב הראשון מאפשר החלמה בין 22 ימים ל 3 חודשים. זלוף כליות מופחת עלול לגרום לירידה ב-GFR בהיעדר נזק פנימי, מצב הנקרא אזוטמיה פרה-כליתית מופיע כשלבי מחלה ראשונים. (ב) סמנים ביולוגיים של AKI: סמנים בשימוש מסורתי, כגון חנקן אוריאה בדם (BUN) וקריאטינין (CR), אינם רגישים, ספציפיים והם לא מבדילים בצורה מספקת בין השלבים השונים של AKI מה שמקשה על אסטרטגית הטיפול. עיכוב באבחון מונע החלטות ניהול בזמן הגורלי והמכריע ביותר לשמירה על איכות חיי המטופל, והמשכם כולל מתן חומרים טיפוליים משוערים וחלקם הוזכרו לעיל. מקור הצילום בצילום מסך מתוך המאמר: "Biomarkers of Acute Kidney Injury" – כאן.
סמנים ביולוגיים של פגיעה חריפה בכליות
Biomarkers of acute kidney injury
TIMP2 ו-IGFBP7
TIMP2 ו-IGFBP7, הידוע בשם NephroCheck אלו הם הסמנים הביולוגיים הראשונין של מחלת הכליות החריפה AKI שקיבלו אישור על ידי ה-FDA (בספטמבר 2014.15). [מקור1, מקור2, מקור3, מקור4, מקור5, מקור6]. כאשר הסמנים הביולוגיים של IGFBP-7 ו-TIMP-2 נוספו למודל קליני בעל תשעה גורמים [מקור], הוכח (במחקר Sapphire) שנמצא בידנו אמצעי זיהוי מיטבי למצב סיכון ל-AKI כ-0.3 [ng/mL ]2/1,000, מדד אשר אושר מחדש במחקר נוסף שמכונה מחקר אופל Opal. מחקר שנמשך בין 2012 ל-2013 ונועד לאמת את ערכי החתך של הסמן הביולוגי (0.3 ו-2.0 [ng/mL]2/1,000) ליתר רגישות באבר הכליות, ומי שפתח בפני המטפלים אפשרות חדשה לחיזוי מדוייק של התפתחות מחלת כליות בינונית חמורה AKI או חמור מכך (KDIGO שלבים 2 או 3) תוך 12 שעות מקבלת תוצאות הבדיקה. [מקור1, מקור2, מקור3]. נושא זה פורץ דרך ומאפשר התחלה מוקדמת בטיפול לא תרופתי.
TIMP2 and IGFBP7, which is known as NephroCheck is the first FDA-approved biomarker of AKI.
אובאין אנדוגני (Endogenous ouabain) – הורמון קליפת יותרת הכליה שהתגלה לאחרונה, כמי שממלא תפקיד בוויסות Na+ של התא ובאיזון מלח ומים בגוף כולו. אואבאין אנדוגני הוא הורמון לחץ מיותרת הכליה הקשור לתוצאות קרדיווסקולריות שליליות [מקור] וכוכב עולה בהבנה של הפרעה כלייתית של נתרן, שהוזכרה לעיל. בה הנתרן מהווה הגורם העיקרי בפתוגנזה של יתר לחץ דם. לאחרונה אובאין אנדוגני (Endogenous ouabain) נמצא כסמן ביולוגיים שמנבא פגיעה חריפה בכליות [מקור].
אובאין אנדוגני טרום ניתוחי נמדד ב-407 חולים שאושפזו לניתוחי לב אלקטיביים ובאוכלוסיית אימות של 219 חולים אחרים. כאשר נחקרה ההשפעה של עליות ממושכות של אובאין אקסוגני גם במחזור על פרמטרים כלייתיים בחיות מעבדה או ההשפעה של אובאין על חלבוני פודוציטים (תא כליה, חלק ממחסום הסינון בפקעית של הכליה [מקור].), גם "in vivo" כלומר במציאות, לא רק במעבדה נחשפה תמונה חדשה: האובאין האנדוגני עולה במחזור הדם לפני הניתוח ונמצא כמי שמנבא באופן הבולט ביותר פגיעה חריפה בכליות [מקור].
הערה לסקרנים: אובאין אנדוגני (Endogenous ouabain) – אחד הגליקוזידים הלבביים האנדוגניים שמסתובבים בפלסמת הדם הוא הורמון קליפת יותרת הכליה. לאחרונה אובאין אנדוגני נמצא כמי שמעכב את משאבת Na+ ומעלה את ה- Na+ התוך תאי. לאחר מכן, וכתוצאה מחילופי Na/Ca, Ca2+ הציטוסוליים (שנמצאים בנוזל הציטופלזמתי שנמצא בתוך התאים), וחשוב יותר, מאגרים תוך תאיים של מיוציט עורקי (בשריר) Ca2+, [ouabain מגביר את מנגנוני איתות של מיוציט עורקי Ca(2+) המעודדים כיווץ כלי דם, ובו זמנית מוריד מנגנוני הרחבת כלי דם אנדותל] גדלים בשריר חלק בכלי הדם (VSM), בנוירונים vasomotor, ובתאי אנדותל, כמו גם בסוגים רבים אחרים של תאים. כתוצאה מכך, תאים אלה הופכים לבעלי יכולת להגיב בתגובת יתר הדבר נובע מכך ששיפוע Na+ מגדיל מעט את ריכוז Ca2+ החופשי שנמצא בנוזל התוך תאי ([Ca2+]cyt). +Ca2+ אלה מושרים על ידי הפעלת התא ובעקבות זאת הם משתפרים ביכולת תפקודם. הסינרגיה (שיתוף הפעולה) שבין שחרור מוגבר של משדר נוירון סימפטי (ההורמון אובאין אנדוגני מופרש גם על ידי כמה נוירונים של מערכת העצבים המרכזית וכן על ידי סוגים אחרים של תאים [מקור].), ותגובתיות מוגברת של תאי השרירים החלקים vascular smooth muscle (VSM) מגבירה את הטונוס העורקי ובהמשך את התנגודת של כלי הדם ההיקפיים שהם סימן ההיכר של יתר לחץ דם [מקור1, מקור2, מקור3, מקור4].
אקטודומיינים
Ectodomain – לאקטודומיינים יש חלק מכריע בנתיבי האיתות של וירוסים. מדובר בחלק הפעיל בחלבון דופן – והתחום של חלבון ממברנה (דופן התא) אשר ממשיך ומשתרע לתוך החלל החוץ-תאי (החלל שמחוץ לתא – המטריקס). דוגמה בולטת לאקטודומיין היא חלבון S, הידוע בדרך כלל כחלבון הספייק, של החלקיק הנגיפי האחראי למגפת COVID-19. אזור האקטודומיין של חלבון הספייק (S) חיוני להתקשרות ולכניסה של החלבון הנגיפי לתוך התא המארח ולייצירת המחלה [מקור] במהלכה של המגפה כונה קולטן חלבון הספייק (רצפטור) שזוהה על וירוס הקורונה. חלבון הספייק חופשי, ועד לשלב שמייצר את כניסת הוירוס לתא הוא ככל הנראה עלול לגרור את החולה למצבי אלרגיה קשים הם סיבת המוות לכאורה מהמחלה לדברי Dr Shankar's Chetty [מקור]. סמן ביולוגי זה נשפך אל הנוזל הבן-תאי בעקבות פגיעה חריפה בכליות ובהחלט ניתן למדוד אותו בשתן [מקור1, מקור2, מקור3.] נוכחותו בשתן מעידה על התקדמות המחלה.
מולקולת פגיעת כליות בשתן-1 (Kim-1)
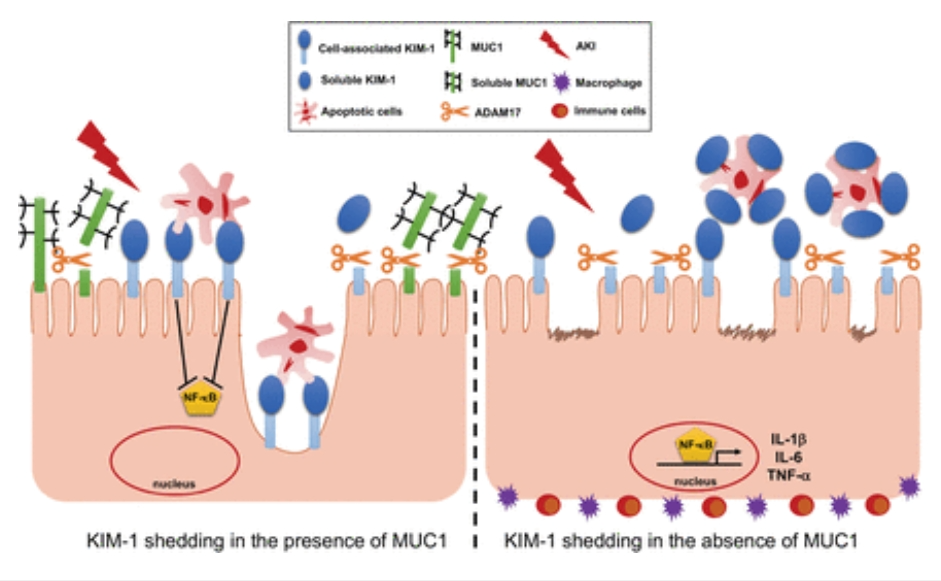
(שמאל) אינדוקציה של MUC1 ב-PT בעקבות פגיעה בכליות מפחיתה את נשירת KIM-1 על ידי תחרות על ADAM17. (מימין) בהיעדר MUC1, המחשוף של KIM-1 מואץ ונשפך לתוך חלל הצנרת – הלומן, שם הוא פועל כקולטן פיתוי, ובהמשך מעכב efferocytosis. החוקרים משערים כיום שייצוב של KIM-1 הקשור לתא על ידי אינדוקציה של MUC1 במהלך IRI יכול להגן על הכליה על ידי שמירה על איתות תאים בתיווך KIM-1 ואפרוציטוזיס שמפחית דלקת ומקדם התאוששות. מקור האיור בצילום מסך מתוך המאמר: " KIM-1-mediated anti-inflammatory activity is preserved by MUC1 induction in the proximal tubule during ischemia-reperfusion injury" – כאן
Kim-1 הוכיח את עצמו כאינדיקטור יוצא דופן לפגיעה בכליות [מקור]
Kidney Injury Molecule-1 (KIM-1) מכונה גם חלבון טרנסממברני מסוג 1 הוא חלבון נוסף שפועל מחוץ לתא חוצה דופן (ממברנה) ומכאן גם שמו: גליקופרוטאין ממברנת תא מסוג 1 – KIM-1 (Type-1 cell membrane glycoprotein) [מקור1, מקור2, מקור3] אשר פועל בממברנה האפיקאלית של הצינורית הפרוקסימלית הקרובה לאזור הפקעית שבנפרון proximal tubules). בעת פגיעה – הKim-1 הוא למעשה ווסת בתאי אפיתל פרוקסימליים שבצנרת הכליה וכמעט שלא בא לידי ביטוי בתאי אפיתל של כליות בריאות [מקור1, מקור2]. גם ה- Kim-1 מופיע בנוזל השתן עם פרוץ מחלת הכליות CKD ובתחילת דרכה לכן הוא הפך (לאחרונה) סמן ביולוגי רגיש שמאפשר דיווח על מהיר מאוד פגיעה בצינורית המקורבת במחלות כליות [מקור1, מקור2] הוא אחד המדדים שעשויים לסייע מאוד בזיהוי מוקדם ולקדם טיפולי החלמה.
המקטע החוץ-תאי של KIM–1 מופיע בשתן זמן קצר לאחר ההתרחשותו של נזק לנפרון, ניתן לגלותו באופן איכותי ובברור בבדיקת שתן פשוטה על ידי טבילת מקלון (dipstick) מתאים לבחינת השתן, מה שהופך את KIM-1 לסמן נוח וניתן לגילוי ולהערכה איכותית של נזק כלייתי חריף (AKI) במהירות שעשויה להוביל לתהליכי החלמה מוצלחים [מקור].
למאמרי – אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
טרנספרין – Transferrin בשתן
טרנספרין הוא גליקופרוטאין (חומר המורכב מסוכר וחלבון) שנוצר בכבד, זורם בסרום (בדם). ידוע כנשא, מעביר ברזל דרך הדם [מקור]. הטרנספרין מאוד דומה במשקל המולקולרי שלו לאלבומין, 76.5 kDa ו-65 kDa בהתאמה, הטרנספרין שונה מהאלבומין בכך שהוא פחות אניוני, וככל הנראה מסונן בקלות רבה יותר בגלומרולוס (פקעית הכליה) [מקור]. נזק גלומרולי (פקעתי) גורם להופעה בשתן של עודף חלבוני סרום שאינם מסוננים באופן חופשי דרך הגלומרולוס, כולל מקרומולקולות כגון אלבומין וטרנספרין וכן חלבוני מטריקס חוץ-תאיים [מקור]. נמצא כי חולים שכבר חולים במחלת כליות (אלבומינוריה), להפרשת טרנספרין בשתן יש קשר ליניארי עם הפרשת אלבומין בשתן, וטרנספרינוריה מוגברת נמצאה ב-95% מהחולים במיקרואלבומינוריים וב-100% מהמטופלים במקרואלבומינוריים [מקור1, מקור2], לפיכך, טרנספרין בשתן עשוי להיות סמן רגיש יותר לנזק גלומרולרי המתחיל להתחולל, למשל בקרב חולי סוכרת [מקור]. כידוע נפרופתיה סוכרתית (DN) נחשבת לאחד מהסיבוכים המיקרו-וסקולריים העיקריים של סוכרת וללא ספק ההרסני ביותר, בהתחשב בכך מחלת כליות אחראית בחולי סוכרת היו סיבת המוות המרכזית בקרב חולי סוכרת [מקור]. זאת גם הסיבה לעניין העצום בקרב חולי הסוכרת בביו מרקר נוסף זה אנשים שמבקשים להחלים ממחלת כליות מגלים עניין בטרנספרין בשנים האחרונות משום רעילות נפרוטוקסית של תרופה. כידוע רעילות נפרוטית היא תולדה משימוש קליני בתרופות ובחומרי ניגוד רבים. השימוש העצום ברפואת יתר מציבה צורך דחוף גם בקרב חוגי רפואת הממסד לייעל טיפולים תרופתיים והליכים התערבותיים הכוללים מוצרים נפרוטוקסיים באופן מונע ומותאם אישית [מקור]. הפרשת טרנספרין בשתן,משרתת גם אותם ומעניקה להם אות להפחית תרופות אלה. למעשה, טרנספרין בשתן מתריע מראש על גודל הנזק הכלייתי נושא שהוכח במחקרים ובמודלים של בעלי חיים שבהם הסיכון נוצר על ידי תרופות ורעלים המשפיעים על האבובות הכליות (כלומר ציספלטין, גנטמיצין ואורניל ניטראט i.e. cisplatin, gentamicin and uranyl nitrate); טרנספרין כביו מרקר נחשך בניסויים שמראים גם שטרנספרין עולה בשתן במצב הסיכון (כלומר לפני הופעתו של הנזק) בדיוק כתוצאה מהפחתת ספיגה חוזרת בצינורית הכלייתית [מקור1, מקור2]. יש להוסיף אם כן את הטרנספרין בשתן כגורם מזהה מוקדם פגיעה ושינויים לרעה שמתפתחים בצינורות הכלייתיים [מקור].
איור נזק לפקעית – מקור האיור בצילום מסך מהמאמר "Proficient Novel Biomarkers Guide Early Detection of Acute Kidney Injury: A Review" –כאן
חלבון NGAL (נקרא גם ליפוקלין 2 או 24p3) Neutrophil gelatinase‐associated lipocalin
(NGAL): A new marker of kidney disease
למרבה המזל, היישום של טכנולוגיות חדשניות לחקר מחלת כליות כרוניות חשף מועמדים מבטיחים לסמנים ביולוגיים מוקדמים של AKI ו-CKD. אלו מנבאים בדיוק רב נזק לכליות, ביניהם NGAL ו-Kidney Injury Marker או KIM-1. הוא חלבון טרנס-ממברנלי עם מקטעים של אימונוגלובולין ושל mucin שהוזכר למעלה עומד כיום כסמן ביולוגי מצוין לבחינת מצב הכליות עם מקל בכוס שתן. סמן ביולוגי מעולה נוסף, גם הוא חדש, אבל מבטיחים ביותר הוא: ליפוקלין הקשור לנויטרופילים ג'לטינאז (Ngal, הידוע גם כ-lcn2, ונקרא גם ליפוקלין 2 או 24p3)מקור1, מקור2,[ מקור3, מקור4, מקור5, מקור6].
NGAL ליפוקלין (NGAL) הקשור לנויטרופילים ג'לטינאז נחשב לסמן הביולוגי המבטיח ביותר לעומדם פגיעה בכליות והפניהנלטיפולי החלמה. (AKI).
ליפוקלין הקשור לנויטרופילים ג'לטינאז אנושי (NGAL), הידוע גם בשם ליפוקאלין הקשור לנויטרופילים גלוקוסמינידאז, 24p3, אונקוגן 24p3, p25, מעכב גורם מגרה נדידה (MSFI), ליפוקלין נויטרופילים אנושי (HNL), חלבון או חלבון הקשור למיקרוגלובולין α1, אוטרוקלין, סידרוקלין, הוא גליקופרוטאין בעל 198 חומצות אמינו המופרש לאורך זמן ומקודד באדם על ידי הגן LCN2 אשר ממוקם בכרומוזום 3p11 [מקור1, מקור2, מקור1]. חלבון זה קשור למערכת ההגנה הטבעית של הגוף (innate immunity) ובקשירתו של ברזל. יצויין כי NGAL יוצר אינטראקציה ספציפית עם חלבונים חיידקיים המכונים סידרופורים (siderophore – המונח "סידרופור" מגיע מיוונית שמשמעו "חלבון נושא ברזל") הנקשרים לברזל חופשי במחזור ובתוך תאי [מקור]. סידרופורים חיוניים להישרדותם של מיקרואורגניזמים רבים בגוף האדם שכן הם חשופים למצבים של מחסור חמור בברזל in vivo, בעיקר בשל רמות נמוכות במיוחד של ברזל חופשי[מקור]. סידרופורים יכולים בשל הזיקה הגבוהה מאוד שלהם לברזל, לשפוך ברזל חופשי מהסביבה הסובבת אותם ולהפוך אותו לזמין למיקרואורגניזם [מקור]. חלבון NGAL גם משמש במניעה מחיידקים מעוללי נזקים בגוף, על-ידי כך שהוא מגביל את שגשוגם [מקור] (ע"י מניעת פעילותם של סידרופורים המכילים ברזל שחיוני לחיידקים.).
2 קולטנים נחשפו עד כה של חלבון NGAL, האחד הוא –24p3R שנמצא בעיקר בטחול, ואילו השני מגלין הוא גליקופרוטאין ענק שמשקלו המולקולרי 600 קילו-דלטון, המגלין שייך למשפחתה חלבונים המשמשים קולטן ל-low-density lipoprotein בהבדל מ –24p3R שנמצא בעיקר בטחול המגלין נמצא בעיקר באבוביות המקורבת (proximal) בכליה [מקור] הוא נמצא גם בריאות ובתירואיד [מקור1, מקור2], באפנדידימיס, בבלוטות החלב, ובשלפוחית השתן [מקור]. בכליה, megalin בעל תפקיד מרכזי בתהליך התיווך בו יש קליטה מחדש של מולקולות שעברו פילטרציה ברמת האבובית הקריבנית [מקור]. תאי האפיתל שבצינורית הפרוקסימלית שבנפרון הכלייתי מבטאים את החלבונים מגלין שהוזכר וכן את הקובילין (cubilin), אשר קושרים את ויטמין D [מקור1, מקור2, מקור3]. מחסור בוויטמין D הוא למעשה פגיעה בכליות. מחסור במגלין אחד מ2 הקולטנים של חלבון NGAL אומר מחסור בויטמין D הפעיל לכליות בשל ירידה בקליטה תאית של 25(OH)D3-DBP וחוסר היכולת ליצור 1,25(OH)2D3 בגוף [מקור1, מקור2, מקור3].
ה– NGAL מתבטא בנויטרופילים (פגוציטים – קבוצת התאים הגדולה ביותר מבין תאי הדם הלבנים, שבמערכת החיסון. תפקידם העיקרי בליעה וחיסול חיידקים או פטריות ומניעת הזיהום שנגרם מהם), וברמות נמוכות הוא מתבטא בכליות, בבלוטת הלבלב, ובאפיתל של מערכות הנשימה והעיכול. NGAL משמש כיום מדד חשוב לפגיעה כלייתית [מקור]. מדידה של NGAL בפלזמה (Triage® NGAL Device; Biosite Incorporated) ובשתן (ARCHITECT® Analyzer; Abbott Diagnostics) נמצאת כיום בקו הראשון של הדרישה הזאת. מדידות ריכוז NGAL בדגימות קליניות שבות ומתקפות הנחה זאת [מקור1, מקור2, מקור3]. והדברים מגיעים לידי כך שישנם חוקרים המצביעים על כך שרק נויטרופילי ג'לטינאז הקשורים ליפוקלין או ליפוקלין Neutrophil Gelatinase Associated Lipocalin (NGAL) הקשור לנויטרופילים ג'לטינאז, מעכב רקמות של מטאלופרוטאינז 2 (TIMP-2), וחלבון 7 קושר גורם גדילה דמוי אינסולין (IGFBP7) נוכחים מתאימים לקביעה קלינית מוקדמת של מחלת כליות חריפה תת-קלינית [מקור1, מקור2, מקור3, מקור4, מקור5, מקור6, מקור7].
נמצא שרמת החלבון NGAL (בשתן) הייתה במתאם הופכי לרמת ה- GFR, כאשר תפקוד הכליות ירד מתחת ל 33 GFR (מתחת ל-30 מ"ל/דקה) רמות NGAL (שתן) נמצאו עדיפות על מדידת cystatin C מרקר ביולוגי נוסף בו ידובר בהמשך, (בסרום) בחשיפת נמצא שמדידת cystatin C בדם יותר מדויקת [מקור].
בנוסף לכך רמות NGAL נמצאו בהתאמה עם רמת קראטינין בנסיוב (r=0.588, p=0.02), ובהתאמה עם חישוב GFR (קצב הסינון הפקעתי) (r=0.528, p=0.04) ובהתאמה עם חומרת פרוטאינוריה (r=0.294, p=0.04) [מקור].
מחקר נוסף של Bolignano וחב' משנת 2007 ב-Am J Nephrol, הראה שעלייה ברמת NGAL בפלזמה וגם בשתן מייצגת גם את החומרה במטופלים עם מחלת כליות רב כיסתיות (polycystic kidney disease), ככל שמספר הכיסתיות (עולה על 10) וערכי GFR יורדים. גם בחולים הסובלים מנזק טובולארי אינטרסטיציאלי כרוני או מ-IgA nephropathy, נמצאו רמות עולות באופן משמעותי של NGAL וזאת במחקר של Ding וחב' משנת 2007 ב-Clin Immunol. גם מחקר של Brunner וחב' משנת 2006 שהתפרסמה ב-Arthritis Rheum על נזק כלייתי שהתבסס על התבוננות ב- 35 ילדים חולי זאבת (SLE), מצאה רמות מוגברות שלנ NGAL, עם מתאם הדוק לנזק הכלייתי הנלווה למחלה [מקור].
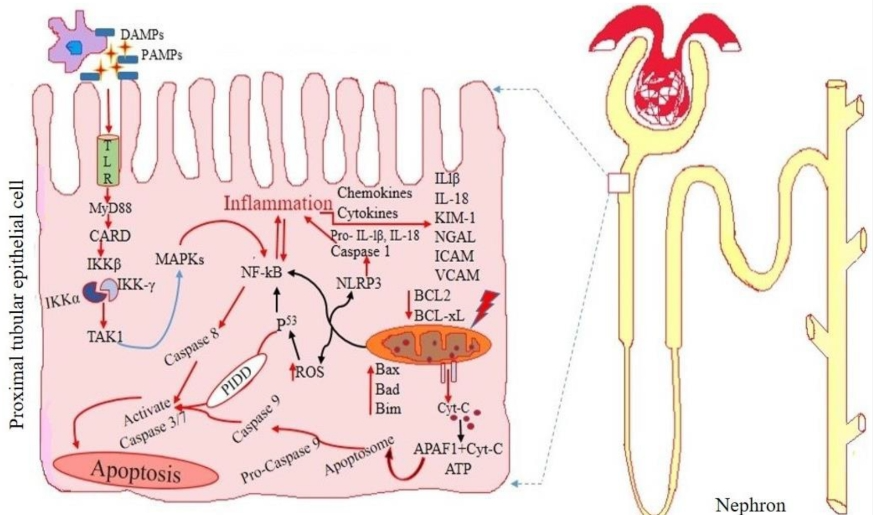
כמו במקרים רבים נוספים גם כאן התרופות עלולות להרוס את עבודת המטפל ואת תהליך ההחלמה, כאן את המדד של חלבון NGAL– המאפשר איבחון מצב כלייתי: מס' סוגי אנטיביוטיקה, אינסולין או ב-IGF-1 הם מעלים רמת NGAL ללא קשר עם מצב המחלה, ואפילו את קראטינין שעלול לעלות גם בשל נטילת כדורים להורדת לחץ דם, והקריאטינין, בהיותו מוגבר, בהחלט עלול להגביר רמות NGAL, כך גם האסטרוגן הלא-סטרואידלי diethylstilbesterol, NGAL, תכשיר קושר ברזל דוגמת deferoxamine, והתכשיר הגורם לדה-מתילציה 5-aza-cytidine [מקור].
ניתן כיום למדוד NGAL בבדיקת עכירות טורבידימטרית, המאפשרת קבלת תשובה במכשירים אוטומטיים בזמן אמת.
רמת NGAL בשתן הגבוהה מ-104 מיקרוגרם לליטר מציגה נזק כלייתי חד, בעוד שרמת NGAL בשתן הנמוכה מ-47 מיקרוגרם לליטר, מציגה מטופלים עם "כשל קדם כלייתי" [מקור1, מקור2, מקור3, מקור4].
סמנים ביולוגיים של עצירת מחזור התא ו-Neutrophil Gelatinase Associated Lipocalin (NGAL) כדי להעריך AKI בקרב חולים מאושפזים
ציסטטין – Cystatin – C
סמן ביולוגי חדש נוסף עבור זיהוי מוקדם של מחלת הכליות ומחליף למדד המיושן – GFR, הוא cystatin C [מקור], הוכח כי Cystatin C עדיף על קריאטינין כאינדיקטור לעירידה של מדד ה-GFR והתבוננות בו מעניקה כיום גם מרחב רב חשיבות להבנת הפגיעה החריפה בכליות. יצוין כי בהבדל ממדדי מחלת הכליות הישנים המושפעים ממצב הדלקת בגוף ה- ציסטטין C אינו מושפע ממנה. מחקרי השוואה של ציסטטין C וקריאטינין ממשיכים לתקף את היותו מדד מיטבי לצד חלבון NGAL שמתאר שינויים אמיתיים ב-GFR [מקור]. משפחת-על של ציסטטין, מקיפה 12 חלבונים המכילים רצפים אחדים הזהים לאלה של ציסטטין C. ציסטטין C הוא חלבון חד-שרשרתי נטול סוכר, המקודד על ידי הגן CST3 הממוקם בזרוע הקצרה של כרומוזום 20, בעמדה P.11.2, ומשמש כמדד לתפקוד כליות [מקור]. כל התאים המגורענים בגופנו מייצרים ציסטטין C, לכן ניתן למצוא ציסטטין C בכל רקמות הגוף ובנוזלי גוף שונים. ציסטטין C הוא מעכב יעיל של אנזימים פרוטאוליטיים ליזוזומאליים, וכנראה אחד המעכבים החוץ-תאיים החשובים של ציסטאין-פרוטאזות. המשקל המולקולארי של ציסטטין C נמוך והוא מורחק מהדם על ידי סינון פקעתי בכליות דרף נוזל השתן.
הגוף זקוק לציאסטין סי ולאחר שהדם עובר ניקוי וסינון חלקיו הנחוצים מוחזרים וציסטטין C עובר ספיגה מחדש באבוביות הכליה הקריבניות (המקורבת).
כאשר ה-GFR יורד עולה רמת ציסטטין C בדם.
יצויין כי רמות ציסטטין C אינן תלויות בגיל (אם הנבדק הוא מעל גיל שנה), במין, במוצא האתני ובמסת השרירים בהשוואה לקראטינין ומדידת GFR על-ידי מחשבון. מדידת ציסטטין C גם אינה מושפעת ממצבי דלקת.
כבר בשנת 1995 היו Newman וחב' במאמרם ב-Kidney Int, שהסיקו שבנוסף להיותו מעריך טוב יותר את ה-GFR, ציסטטין C הוא גם מדד רגיש יותר לשינויים קלים ב-GFR [מקור]. מאז, מחקרים רבים שווים ומשווים בין מדידת Cystatin C לבין זו של מדדים אחרים, ורובם מגיעים למסקנה שמדד זה, או הערך ההופכי שלו (reciprocal), עדיפים או לפחות שווים למדידת קראטינין בנסיוב לגילוי ירידה ב-GFR [מקור].
מכיוון שציסטטין C מיוצר בכל תאי הגוף המגורענים בקצב קבוע ומתפנה בכליות, רמתו בדם נותרת קבועה כל זמן שהכליות מתפקדות היטב וה-GFR תקין. מחקרים עדכניים מצביעים על כך שרמות מוגברות של ציסטטין C יכולות להצביע על מחלת לב, אי-ספיקת לב או שבץ-מוחי. מחקר משותף של VA ו-UCSF בסן פרנסיסקו, מצא שציסטטין C מדד מדויק יותר מקראטינין בהערכת מחלות כליה. בין נבדקים שזוהו עם מחלת כליות על בסיס רמות גבוהות של קראטינין, נמצא שרק אלה בהם רמת ציסטטין C הייתה מוגברת היו בסיכון גבוה למות, למחלה קרדיו-וסקולארית, לאי-ספיקת לב או לאי-ספיקת כליות. נבדקים עם רמת קראטינין גבוהה אך עם רמת ציסטטין C תקינה, היו בעלי סיכון לאלה של אלה עם רמות קראטינין תקינים. החוקרים אתרו מקטע קטן אך משמעותי בין הנבדקים בהם רמת קראטינין הייתה תקינה אך רמת ציסטטין C הייתה מוגברת, ונבדקים אלה נמצאו בסיכון מוגבר לסיבוכים חמורים.
interleukin-18 אינטרלויקין (IL-18)
סמנים ביולוגיים שונים נחשפו כמדווחים על דלקת (למשל, MCP-1, OPN ו-IL-18), פיברוזיס ( דלקת ברקמות למשל, TGF-β ו-PIINP) ותיקון (למשל: EGF, YKL-40 ו-OPN) [מקור1, מקור2, מקור3] כולם יכולים לסייע בזיהוי מוקדם של מחלת הכליות ולסמן למטפלים הנחיות ומידע על תהליכי החלמה ומהירותה. אתמקד באינטרלויקין 18.
רמות IL-18 בשתן של מעל 100 pg/ml קשורות לסיכויים מוגברים של AKI
אינטרלויקין 18 Interleukin-18 (IL-18), הידוע גם כגורם מעורר אינטרפרון-גמא הוא חלבון אשר נמצא בבני אדם בדומה לציסטטין C שהוזכר למעלה, כמעט בכל התאים (גם בחיות).
בבריאות מלאה ה18 אינטרלויקין בעל השפעות עמוקות על הפעלת תאי T (לימפוציטים) ותאי הרג (NK)
[מקור1, מקור2, מקור]. תאי T הם בין הגורמים החשובים ביותר במערכת החיסון. הם יכולים לפעול ישירות על פולש מסכן או לגייס חברים אחרים ממערכת החיסון, ולפעול הן נגד זיהומים חיצונים והן נגד תאים לא תקינים של הגוף עצמו. כך למשל נגד תאי סרטן שמתפתחים בגוף האדם. כישלונם של תאי T לבקר כראוי את פעילות מערכת החיסון הרה אסון [מקור]. IL-18 מסוגל לגרום לתגובות דלקתיות קשות, מה שמרמז ומוביל אל תפקידו בהפרעות דלקתיות כגון הדלקת הכרונית שהוזכרה וקידומה של מחלת הכליות .[מקור1, מקור2, מקור3]. הוא גם מככב בההפרעות האוטואימוניות
אינטרלויקין 18 מקודד על ידי הגן IL18 [מקור1, מקור2]. IL-18 מווסת על ידי אינטרפרון-גמא [מקור]. אינטרלויקין 18 (IL-18) נמצא גם כמגביר את ייצור העמילואיד-בטא הקשור למחלת אלצהיימר [מקור1, מקור2, מקור3]. אינטרלויקין 18 מככב בקידומה של מחלת הכליות –
פרוטאינוריה ו IL-18
IL-18 קשור גם להפרשת חלבון בשתן מה שאומר שהוא יכול להיות גם סמן ביולוגי מרכזי להערכת התקדמות של נפרופתיה סוכרתית [מקור1, מקור2, מקור3] ופרוטאינוריה. מבחינת המבנה, IL-18 חולקים רצפים של חומצות אמינו ראשוניות שמורות ומה שמכונה "signature sequence" ("רצף חתימה") וחלבונים מקופלים באופן דומה. החלבון המקודד על ידי גן זה הוא ציטוקין פרו-דלקתי (ציטוקינים מדכאי דלקת) זוהה בתחילת המחקר נוכח בתאי קופפר, מקרופאגים ותאי כבד. נמצא כי ה IL-18 מתבטא ביתר שאת בתאים שאינם תאי גזע או המטופואטיים, כגון תאי אפיתל במעיים, קרטינוציטים ותאי אנדותל בלב, בכליות [מקור].
IL-18 ובדיקת שתן
מחקרים קודמים הראו ש-IL-18 מופיע בנוזל השתן באופן משמעותי או מוגבר ב-AKI אנושי. לפיכך, שב ונבחן במחקר אם בדיקת שתן ונוכחותו של IL-18 בה יכול לשמש גם סמן אבחון מוקדם של מחלת כליות מתקדמת.
רמות IL-18 בשתן של מעל 100 pg/ml קשורות לדעת החוקרים כיום בודאות לסיכויים מוגברים של AKI [מקור]. רמות IL-18 בשתן מנבאות לצערנו גם את התמותה של חולים שסובלים מתסמונת מצוקה נשימתית חריפה (ARDS) שמוכרת כמחלה נגררת למחלת כליות ונקשרת בציר כליות-ריאה עליו אפשר לקרוא עוד כאן [מקור]. Discovery היה מחקר חקרני לבחירת הסמנים הביולוגיים המבטיחים ביותר לסיכון AKI מתוך 340 סמנים ביולוגיים פוטנציאליים שזוהו לראשונה באמצעות חיפוש ספרותי אחר סמנים ביולוגיים של פגיעה בכליות. הניסוי נערך בשלושה אתרים קליניים באוסטריה ובארה"ב, וכלל 522 חולים. הסמנים הביולוגיים דורגו הן בנפרד והן בשילוב על פי יכולתם לחזות AKI בינוני או חמור (RIFLE שלבים I או F) תוך 12 עד 36 שעות. שני הסמנים הביולוגיים המובילים לסיכון AKI היו IGFBP-7 ו-TIMP-2, עם תוצאות מעט טובות יותר כאשר שני הסמנים הביולוגיים שולבו: אזור מתחת לעקומת המאפיין המאפיין של המקלט (AUC) של 0.80 (רווח סמך 95% (CI), 0.75 עד 0.84).[מקור]
סמנים ביולוגיים אחרים הנבדקים לשימוש כסמנים ביולוגיים עבור מחלת כליות כוללים חלבון קושר חומצות שומן בכבד (L-FABP) [מקור]. ואובאין (Ouabain), הורמון לחץ, שעולה בדם ומנבא גם את הסיכון ל-AKI [מקור1, מקור2, מקור3 –
Simonini M, Lanzani C, Bignami E, Casamassima N, Frati E, Meroni R, et al. A new clinical multivariable model that predicts postoperative acute kidney injury: impact of endogenous ouabain. Nephrol Dial Transplant.2014 Sep;29(9):1696-701].
אובאין אנדוגני [Endogenous ouabain (EO)] הוא הורמון לחץ יותרת הכליה נמצא כמסונתז בקליפת יותרת הכליה [מקור1, מקור2, מקור3, מקור4, מקור5] וקשור לתוצאות קרדיווסקולריות שליליות. מאחר שפגיעה חריפה בכליות היא סיבוך תכוף ומוכר של ניתוחי לב ותמותה זיהוי מוקדם של אובאין אנדוגני טרום ניתוח יכול להציל חיי אדם ולמנוע שימוש בניתוח כמקדם אי ספיקת כליות ומוות. המחקר מלמד כי אובאין מוגבר במחזור הדם עשוי לגרום נזק ישיר לפודוציטים [מקור1, מקור2]. הוא מעלה את הקריאטינין – (-18%, p <0.05), מגביר את כמות החלבון בשתן (+ 54%, p <0.05), והפחית הביטוי של נפרין פודוציט (-29%, p < 0.01) [מקור]. אובאין אנדוגני (EO) מווסת את הפעילות של ה-Na,K-ATPase וגורם להעברת אותות באמצעות חילופי נתרן-סידן והמסלול התלוי ב-Src [מקור]. EO מפעיל השפעה דו-פאזית על Na,K-ATPase, מעורר או מעכב את פעילותו בריכוז נמוך (סאב-ננומולר) או גבוה (ננומולר), בהתאמה [מקור1, מקור2]..
MCP – חלבון כימו-מושך מונוציטים-1 (MCP1)
Urinary monocyte chemoattractant protein 1
Monocyte chemoattractant protein-1 (MCP-1 – פפטיד 1) הוא כימוקין ספציפי לגיוס והפעלת מונוציטים ממחזור הדם לאתר הדלקתי. מונוציט chemoattractant protein-1 (MCP-1/CCL2) בעל תפקיד קריטי בהתפתחות של מחלות כליה שונות ולא רק שמשמש מדד לתחילת המחלה בשתן גם מקדם אותה [מקור]. הסתננות והפעלה של מונוציטים/מקרופאגים בגלומרולוס הכלייתי (פקעית) מוכר מדובר בגורמים שמעורבים בהתפתחות מחלת הכליות וליתר דיוק בפגיעה גלומרולרית – פגיעה בפקעית נושא שמוצג באיור שנמצא כמה איורים למעלה ומי שמעודד ירידה חריפה של ה- GFR [מקור]. רמות של פפטיד 1 MCP-1 בנסיוב ובשתן נמצאו במחקר כמוגברות באופן משמעותי בחולים עם מחלות כליה [מקור1, מקור2] ולכן יכולות לשמש כמדד הן בבדיקות שתן והן בבדיקת דם. MCP-1 והקולטן שלו CCR2 פועלים נמרצות לגיוס מונוציטים/מקרופאגים לכליה בחולים עם AKI ו-CKD. מספר ציטוקינים מעוררים הפרשה של פפטיד-1 MCP-1 מתאי אפיתל צינורי שמתפקד בכליה ותאי שנקשרים בפקעית מזנגיה (חלקם נמצאים בין העורקים האפרנטיים והעפרנטיים לכיוון קוטב כלי הדם של הגלומרולוס מכונים תאים מזנגיאליים חוץ-גלומרולריים – וה-extraglomerular mesangial cells התאים המזנגיאליים האקסטראגלומרולריים אשר סמוכים לתאי המזנגיאל האינטרגלומרולרי הממוקמים בתוך הגלומרולוס ובין הנימים [מקור]), ביטוי זה ממשיך וממריץ את ביטוי מי שנחשב כמגביר דלקת = ICAM-1 (מתבטא על ידי אנדותל כלי הדם, מקרופאגים ולימפוציטים.) כדי לקדם שימור לויקוציטים [מקור1, מקור2, מקור3, מקור4, מקור5]. גירוי גלוקוז גבוה ו-AEG גם גורמים לביטוי MCP-1 יחד מביאים לשיגשוג וייצור רב יותר של הגורמים הקשורים לפיברוזיס וזאת באמצעות הפעלה של גורם גרעיני-κB (NF-κB) [מקור1, מקור2, מקור3, מקור4, מקור5]. החשיפה של פודוציטים למדדי גלוקוז גבוהים מפעילה ביטוי MCP-1 תלוי TGF-β, אשר בתורו גורם לאפופטוזיס ומגביר את הפציעה או את החדירות של האבר מה שמאפשר הקלה על מעבר לויקוציטים לאנדותל ומגביר את פגיעותו באבר הכליה [מקור1, מקור2]. MCP-1 נמצא לאחרונה כראוי לשמש סמן ביולוגי למחלת הכליות [מקור] נמצא כי רמות הבסיס של מונוציטים בשתן chemoattractant חלבון-1 (MCP-1) עולות ביחס ישר לחומרת מחלת הכליות. MCP-1 בעל פוטנציאל ניכר של סמן ביולוגי של AKI ומספקים "הוכחה לקונספט" שהערכות היסטונים בשתן מספקות תובנה מכניסטית בקרב חולים עם מחלת כליות [מקור1, מקור2, מקור3, מקור4]. MCP-1 מתבטא ברקמות הכליות, פוגע בהן אבל גם ניתן לזיהוי בשתן של חולים עם מגוון מחלות כליה. מדידת רמות MCP-1 בשתן קלה ובהחלט יכולה לספק אבחון של מחלת כליות פעילה, בנוסף לניטור התגובה לטיפול. יחד עם זאת טיפול יעיל בדיכוי מספר מחלות כליות יכול בהחלט להיות כרוך בחסימת MCP-1 נושא שכבר הוכחה כיעיל ומשפר את מצב החולה במחלות כליות במודלים של בעלי חיים ניסויים.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
מאמרים אחרונים
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- 8 חסרים תזונתיים שכיחים
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- תוסף מזון על האסטקסנטין astaxanthin
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין A?
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- דיוקסינים במזון
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- רוצה להחלים מאי ספיקת כליות – יש להגיע לטיפול מחלים כליות מהר ככל האפשר
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- צרבת כרונית – רוצה להחלים ללא תרופות?
- מהי תסמונת מטבולית (MetS)?
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- ממצאים חדשניים למקור הגאוט
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- צרבת כרונית – רוצה להחלים ללא תרופות?
- יתר שומנים בדם היפרליפידמיה – חשש לצורך בצנתור
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ’יינג’
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- התרופות והרע – לחץ דם
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מזון למוח – המזון הבריא למוח תומך בגמישות מערכת העצבים שלו וביכולת הלמידה, שומר על הזכרון, ומונע מחלות כגון אלצהיימר.
- מרחבי חיים מאריכי חיים – האזורי הכחולים
- קשר הגלוטן – אלרגיה לגלוטן והאם הימנעות מגלוטן מוצדקת?
- מהן עיניים אדומות?
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- הדמימה – מה היא דמימה
- אורפאוס – דמימה בניהול קרירה שמשתקפת ככיווץ שרירים בבית החזה ובשורש כף היד
- כואבות לי הידיים נורא – היכולת לנצח, להתגאות או לשמור על מקומך בפסגה משתקפת באמות הידיים שלך
- כאבי אוזניים – מסתוריות האוזניים הכואבות
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- טיפול טבעי בכליות – מה אתם יודעים על קורדיספס מיליטריס
- מהי תסמונת מטבולית (MetS)?
- גלוטתיון כל האמת
- כיווץ שרירים כרוני וטיפול
- מקצועי יצרו דרך לזהות את סרטן הלבלב (PC) וגם את ההתפתחות של סרטן הערמונית באמצעות בדיקת שתן, בדיקה שיכולה לעזור בגילוי מוקדם.
- סוכר פירות – האם פרוקטוז יכול לתרום להתפתחות אלצהיימר?
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- איך להוריד את רמת האינסולין בגוף באופן טבעי ופשוט
- חזרה לבסיס – עקרונות צירופי המזון
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- גודש נוזלים בריאות – בקרב חולי כליה
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- על ההשפעה האיומה של חלבון מן החי על הכליות
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- ריפוי פצעים וצמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית לצורך תרומה או טיפול
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מרק גרין קארי – מתכון
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- התה הטחון – מאצ'ה Matcha מתכונים
- – אורז מותסס בבית מתכון
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- אגוז מרפא ביבהיטקי
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- על ההשפעה האיומה של חלבון מן החי על הכליות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- התרופות והרע – ומי הורס לך את ה-Q10
- מחסור בויטמין בי-1 מייצר סיוטי לילה וחלומות זוועה B1
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הפאסטיון המאהב של אלכסנדר הגדול Hphaestion
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- חרדה
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- למה אני לא מצליח להתמיד – והסוכר
- ניתוק רגשי – על הקורוציונה
- נמאס לי מהחיים מה עושים
- התודעה השלילית
- מגיע לי – העדר הכרה במאמץ של השועט קדימה, יכולה להרוס אותך
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- דיוקסינים במזון
- אכל נקי
- הקורטיזול וכאבים בבית החזה וביד שמאל
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- התרופות והרע – ויטמין D3
- התרופות הטובות והרע – אבץ
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- תזונה תאית
- אף סתום או גודש באף – תוסיפו מלח
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- איך להיראות צעיר מגילך – כל הסודות
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- תוסף מזון על האסטקסנטין astaxanthin
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- קריאת הגוף – מה אומרות פניך
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- מחסור בברזל
- מהו אימון שלפוחית השתן?
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- חלבון בשלב אקוטי
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- גלוטתיון Glutathione ו-N-אצטיל-ציסטאין (NAC)
- תסמונת היד הסוכרתית – רמות גבוהות של A1c קשורות להתפתחות של נפיחות באצבעות היד שגורמת כאב ומכונה תסמונת התעלה הקרפלית (גם תסמונת מנהרת שורש כף היד).
- אריתרופויטין (EPO) Erythropoietin
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- סודה של דיאטה מצליחה תמיד
- סבל מהרגלים רעים – רוצה להתפתח? !
- תוספי סידן – זהירות – סיכון לשבץ מוחי
- למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה.
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- (תירואיד)
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- קרום התא – הממברנה והדלקת הכרונית
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מפרקינסון
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- שחיקת סחוס, למה לסבול? – ללא ניתוח ללא תרופות – טיפול להחלמה
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מיתר לחץ דם?
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- טריגר – הסיוט שאינו נגמר
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- תעוקת חזה מיקרו-וסקולרית
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- ירידה בתפקוד הכליות
- פיטר דה הוך – גאון ומוביל דרך
- מזרקת האריות – מורוסיני Morosini Lions Fountain – Eleftheriou Venizelou Square
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות

כתיבת תגובה