
הקשר בין עקה חמצונית ועמידות לאינסולין או חימצון אינסולין משך את תשומת הלב של מחלימי כליות, כבר מעל ל 15 שנים, מחקרים חדשים בתחום זה גילו כי קיים מתאם חזק בין מצב הלחץ החמצוני בגוף לבין שכיחות תנגודת לאינסולין ואף מקרי סוכרת בשלב מאוחר, השמנה ביטנית ועליה לא מוסברת של חומצת השתן Uric acid ודלקת חריפה. ככל שהראיות הגיעו, וקישרו בין השניים גברה ההבנה של המתאם הזה הגם שהייתה רחוקה מהישג יד ולעתים חסרה [מקור]. יש והגיע מחקר שהאיר תובנה בהתנקדותו בפרט בודד של מסלול הפוגע בכליה, או פתוגנזהספציפית, שמעודדת ייצור בלתי סביר של חומצת שתן. נושא זה יכול להכריע טיפולי החלמה כליות – על הדרך להחלים את הכליות אפשר לקרוא במאמרי – אילוף הכליות הסוררות – כאן. ככל שבחנו את נושא הפורינים מהמזון, שמככב במחלת הגאוט ויתר חומצת שתן שימוש בצום פורינים, סיבי החלמה שהוכיחו עצמם במקרים דומים, חומצת השתן לא ירדה במקרים אחדים. נושא זה עומד במרכז מאמרי (ירון מרגולין, מאסטר בהחלמת הכליות והפחתת כאב)
מכתב תודה ממחלימת כליות בתוך ארבעה חודשים.
מה לאכול במצבי אי ספיקת כליות – מתכונים לדיאטה מאוזנת – טעימה להשתגע – מתכונים ותפריט כללי
המשותף לכל המקרים בהם חומצת השתן לא ירדה גם נוכח צום פורינים עליו אפשר לקרוא כאן. חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי מדד ההתנגדות להשפעת הורמון האינסולין על הגוף. מכונה תנגודת לאינסולין כשהקו העליון של טווח הנורמה הוא 2, ובמקרים שבהם עלתה חומצת השתן ללא סיבה כביכול מדד זה היה מעל ל 4-6.
כיום אפשר להבהיר את המסלול המולקולרי מאחורי הפתוגנזה של תנגודת לאינסולין, לחקור את הקשר בין חומצת שתן היא תוצר לוואי טבעי של חילוף החומרים בגוף. כאשר רמתה גבוהה מדי, היא עלולה להצטבר במפרקים ולגרום לדלקת מפרקים כרונית, הידועה בתור מחלת גאוט. מחקרים חדשים מצביעים על כך שרמות גבוהות של חומצת שתן קשורות גם לסיכון מוגבר למחלות כליות, מחלות כלי דם ולב, וסוכרת מסוג 2 גם לשבץ מוחי, פרפור פרוזדורים, ועליה בטריגליצרידים ובכולסטרול LDL. יודגש שכל אחת מהמחלות הנ"ל דורשת טיפול שונה, אבל לכולן בסיס משותף שנושק להפחתת תנגודת לאינסולין.
תנגודת לאינסולין והקשר הישיר שלה לתחלואה כרונית קשה מחייב לדון בנוגדי חמצון כטיפולים פוטנציאליים לחולי כליה, לב, פרפור פרוזדורים, עליה בטריגליצרידים ובכולסטרול LDL. סוכרת, טרום סוכרת ויתר חומצת שתן גם דלקת כרונית.
התמקדות בפעילות המיטוכונדריאלית הולכת ומתגבשת כגישה טיפולית חדשה לשיפור מחלות לב, אי-ספיקת כליות, יתר חומצת שתן בלתי מובנת, סרטן וסוכרת במצבים כרוניים קשים וגם בהקשר להשמנת יתר, דלקת – מסתבר שלכל המחלות האלו מכנה משותף אחד הרגישות לאינסולין והצורך בנוגדי חימצון חזקים.
מהתגובות שהגיעו באימייל
I've been browsing online more than 2 hours today,
yet I never found any interesting article like yours.
It's pretty worth enough for me. In my view, if all webmasters and bloggers made good content as you did, the web
will be much more useful than ever before.
בדיקות: I've been browsing online more than 2 hours today, yet I never found any interesting article like yours.
It's pretty worth enough for me. In my view, if all webmasters
and bloggers made good content as you did, the web will be much more useful than ever before.
יתר גלוקוז הוא לא רק מדד שניכר בבדיקת דם מעל ל 100. – מיטוכונדריה שנחשפות לסביבה תזונתית גרועה להן (יתר גלוקוז שאינו בהכרח מגיע מאכילת פחמימות או סוכר, שומן עודף) – תורמת למהלך של חמצון ובמקרה שלנו לחמצון יתר בתא. הצפה של נוגדי חימצון – הרס, יש ואספקה מוגברת של גלוקוז בתזונה עתירת פחמימות, וסוכר מגיעה דרך הדם למיטוכונדריה, היא גורם מוכר שמנכיח יתר מצע ויתר זמינות במיטוכונדריון לייצור ATP.
במצב כזה נוצרת פעילות יתר במיטוכונדריון, שנעשה היפראקטיבי. אנו רואים היפראקטיביות מיטוכונדריאלית שמגרה ייצור מוגבר של ROS. במקרה כזה ROS שהוא אחד מתוצרי הלוואי הטבעיים שהכרחיים להגנה על המיטוכונדריה קם נגדה [מקור].
הגוף שלנו מפרק את האוכל לגלוקוז (סוכר). הסוכר הזה נכנס לתאים מטופל בתוכם על ידי תעשיית האנרגיה המקומית (שהיא היא המיטוכונדריה או במיטוכונדריון) הוא מקור האנרגיה העיקרי לה ולתאים ולמכלול הפעולות של הגוף [מקור]. ברגע שהסוכרים נכנסים לתאים, הם יכולים מיד להפוך לאנרגיה לשימוש מיידי או שהם מאוחסן בתאים אלה לשימוש בעתיד כדי לתדלק רבים מתפקודי הגוף שלנו בהמשך.
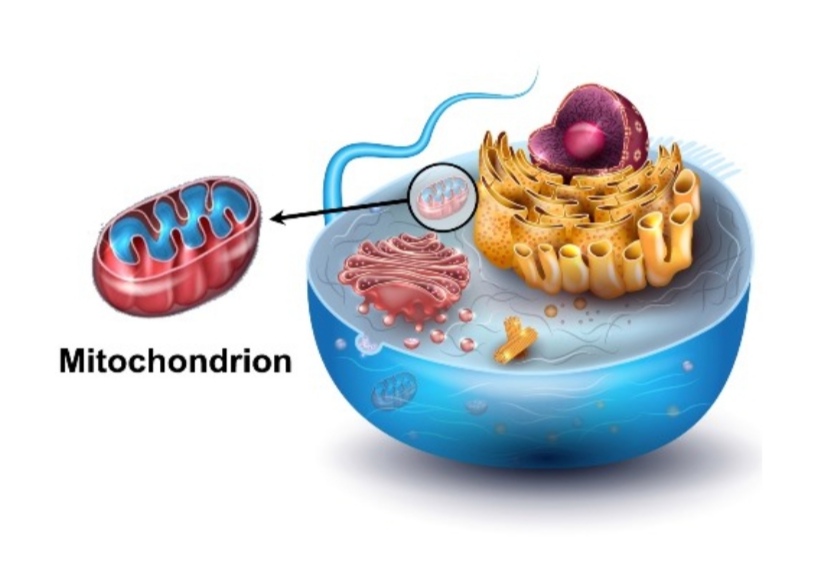
גלוקוז עובר ממערכת העיכול אל מחזור הדם, סוכר בדם מעורר את הגוף לאותת ללבלב לשחרר אינסולין [מקור1, מקור2]. גם הורמונים שונים, כמו מלטונין [מקור], אסטרוגן [מקור], לפטין [מקור1, מקור2], הורמון גדילה וגלוקגון כמו פפטיד-1 [מקור], מווסתים או יכולים לשחרר או לעודד את הפרשת האינסולין. בנוסף לגלוקוז, גם כמה חומצות אמינו [מקור1, מקור2, למשל – חומצות אמינו חופשיות, כמו אלנין וגלוטמין, משתחררות לדם ומשמשות כמפרקי גלוקגון חזקים. ומהלך זה גורם לעלייה ברמות הגלוקוז בדם, אשר לאחר מכן מעוררת הפרשת אינסולין.] וחומצות שומן מווסתות גם את הפרשת האינסולין [מקור1, מקור2, מקור3, מקור4] לכן, מדד זה "תנגודת לאינסולין" יכול להיות גבוה גם כאשר מדד הגלוקוז בדם תקין. כלומר יש סוכרת אבל אין הגלוקוז נראה כגבוה בעמוד בדיקות הדם. ולכן רופאים רבים מפספסים את המחלה. במצב של תנגודת לאינסולין שמעל 2 [המדד מושג בעזרת חשבון חילוק קצר שמאפשר לנו להבין את היחס שנוצר בגוף בין רמת הטריגליצרידים לכולסטרול הטוב (HDL) גדול מ-2, הוא שמראה לנו ע"פ מחקרים את תנגודת האינסולין המדויקת בגופך] גם אם יסורב להאמין שכנראה מתחילה אצלך סכרת מתרחשת כבר זה זמן מה בגופך התקפה על מיטוכונדריון שבתא. העדר ניצול מוסדר של שומנים על ידי המיטוכונדריה מזהים בשיטת "לחיצות ההחלמה" בצד ימין, בגו העליון. במיטוכונדריה הגוף מפיק ומייצר את האנרגיה מהשומנים והאנרגיה הנוצרת מאוד טובה וחזקה. אנו מבינים שהמיטוכונדריה מתפקדות בעיקר כתחנות הכוח של התא. המיטוכונדריה מוקפות בשתי ממברנות ובעלות גנום משלהן. למיטוכונדריה יכולת חלוקה עצמאית ללא תלות במחזור חלקות התא המאחסן, נושא שיועלה במהמשך המאמר. שכפול מיטוכונדריאלי אינו צמוד לחלוקת תאים והיות וקיימים במיטוכונדריה אנזימים הקשורים למטבוליזם אירובי קיימת תיאוריה מיתולוגית על מקורותיה בקרב חוקרים ואנשי מדע. מקור האיור בצילום מסך מהמאמר מיטוכונדריה / מיטוכונדריון – Mitocondria / Mitochondrion כאן.
המיטוכונדריה היא מפעל האנרגיה של התא, בגוף שלנו, בכל תא מתאי גופנו היא נמצאת. בעזרת חומרי ההזנה – נוטריאנטים (יסודות הזנה) שמגיעים דרך זרם הדם ונכנסים לתא ע"י אינסולין שגם הוא נמצא בדם, הן הופכות אותם בתהליך מדהים של תנועת אלקטרונים ל ATP – מצבור של כוח – אנרגיה נושא אשר אפשר לקרוא עליו בהרחבה במאמרי מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות. למעשה כל המחלות ללא יוצא מן הכלל מתחילות בחוסר תפקוד של המיטוכונדריה. החל מיתר לחץ דם גבוה, דלקתיות חריפה, נפרופתיה (מחלה של הכליה ומערכת החיסון), וכלי דם אי-ספיקת כליות, מחלות כלי דם ולב בכלל זה איברים ורקמות בכל הגוף, כולל העצבים והעיניים, כולם פגיעים וכמובן גם נושא מחלות הסרטן ויתר חומצת שתן [מקור1, מקור2].
מחקרים שחקרו סוכרת מסוג 2 התמקדו בעבר בתפקוד לקוי של תאי בטא בלבלב ובתנגודת לאינסולין [(Insulin resistance או IR) היא אדישות הגוף למאמצים לסלק יתר סוכר מהדם על ידי אינסולין], ובפיתוח דרכים לתיקון הפרעות בתפקודים האלו. נושא זה נקשר בגישה המסורתית והקלאסית בתזונה מוכרת של יתר פחמימות וסוכר.
בשנים האחרונות, מתעורר עניין רציני ועמוק בתפקידו של מתח חמצוני ברקמות ההיקפיות כמו באבר הכליות, ואפילו בלב כמי שממלא, בהשראת תנגודת לאינסולין קרקע ותפקיד הרסני שמכריע את תפקוד האבר ומוביל אל מרחב של חולי כרוני
[מקור]. מנגנון של יצירת מינים חמצוניים ובמתאם הישיר שלו לתנגודת לאינסולין, וביטול בפועל של יכולותיו המדהימות של האינסולין לסייע מתחלף עם הפוטנציאל של נוגדי חמצון שמקורם במזון כתרופה, תוספי מזון וסיבי תזונה, שינויים באורח החיים, בניית תפריט החלמה ייחודי מתעוררים בקליניקות בנות זמננו ומושיעים חולים כטיפולים בתפקוד המטבולי הלקוי הזה שנוצר, במיוחד בנתיבי איתות שנחסמו [מקור], חימצון אינסולין ובן השאר נוכח ייצור היתר של גלוקוז שמקורותיו נחקרים [מקור].

הפרה מתמדת של האיזון בין רדיקלים חופשיים לנוגדי החמצון
הפרה מתמדת של האיזון בין רדיקלים חופשיים לנוגדי החמצון ויכולתה של המערכת הביולוגית לנקות בקלות את תוצרי הביניים התגובתיים שיוצרים נזקים או לתקן את הנזק שנוצר, מובילה ל
מתח חמצוני (Oxidative stress) שהוכר לאחרונה כמנגנון מפתח בתנגודת לאינסולין.
לצורך זה העקה החמצונית כלומר המתח החמצוני מוגדרים על ידי עודף של מינים חמצוניים אנדוגניים, פנימיים, אשר גם פוגעים בתאים וגם מתמרנים את מסלול האות לפעולה שנשלחים על-ידי הגנים. מדובר בהפרעות במצב החיזור התקין של התאים שעלול לגרור את הגוף להצפה רעלנית עקב השפעות רעילות באמצעות ייצור של פרוקסידים ורדיקלים חופשיים הפוגעים בכל מרכיבי התא, כולל חלבונים, שומנים ואפילו ב – DNA. כך למשל, במצבי אנמיה ברזל שניתן כתוסף מזון יכול להיות הרסני (טוקסי) עד כדי כך שהברזל עלול לפגוע ברקמות על ידי זרז ההמרה של מי חמצן ליונים רדיקליים חופשיים שתוקפים ממברנות תא, חלבונים ו-DNA [מקור]. השינוי הכימי הישיר שעובר ה-DNA הוא מקור למחלות כרוניות קשות. במצבי אנמיה, אי ספיקת כליות, סרטן יש ל-DNA הוביל במצב זה לקראת תהליך הנקרא מתילציה [מקור1, מקור2]. במאמר: "אנמיה – רוצה להחלים ממחלה כרונית קשה. זרקור אל הטרנספרין הנמוך" בפרק מזון כתרופה – תזונה מותאמת אישית היא דרך טובה לייעל את בריאותנו שהוכחה אני (ירון מרגולין, הכותב מאמר זה) מסביר מה אפשר לעשות לתקן את המצב – כאן [מקור]. סטרס חמצוני כתוצאה מחילוף חומרים חמצוני גורם לנזק אדיר הן לבסיסי הפעילות, כמו גם לשבירה לגדיל ב-DNA – שמעביר אותו כבר הלאה לדורות הבאים. נזק הבסיס הוא לרוב עקיף ונגרם על ידי מיני החמצן התגובתי שנוצר, למשל, O−2 (superoxide radical) רדיקל סופראוקסיד), OH (רדיקל הידרוקסיל) ו-H2O2 (מי חמצן) [מקור1, מקור2,]
[3מקור – Sies H. The concept of oxidative stress after 30 years. In: Gelpi R., Boveris A., Poderoso J., editors. Advances in biochemistry in health and disease. Springer; New York: 2016. pp. 3–11.].
מינים תגובתיים, במיוחד מיני חמצן תגובתיים (ROS) כמו סופראוקסיד, מי חמצן ויוני רדיקלי הידרוקסיל [מקור], הם הגורמים ללחץ חמצוני ומיוצרים ברמות פיזיולוגיות נמוכות בעיקר במיטוכונדריה ובפרוקסיזומים.
רדיקלים חופשיים שמקורם בחמצן, ומכונים מיני חמצן תגובתיים (ROS), ממלאים תפקידים חשובים בחסינות, בצמיחה של תאים ובשליחת אותות של התאים [מקור]. בעודף ROS קטלני לתאים, וייצור יתר של מולקולות אלו (ROS) מוביל למספר עצום של מחלות הרסניות. יצרני המפתח בתאי הגוף שלנו של ROS מסוגים רבים הם משפחת ה-NOX של NADPH אוקסידאזות.
הערה – תשעים אחוז מה-ROS נוצר כאשר אלקטרונים בורחים משרשרת ההובלה האלקטרונית במהלך יצירת האנרגיה במיטוכונדריון (ETC) [מקור]. מיני חמצן תגובתיים (ROS) הם סוגים של רדיקליים או מולקולריים שמיוצרותם מחמצן מולקולרי, במהלך 4 השלבים העוקבים של הפחתת 1-אלקטרון (תגובה (1)). התגובה מתרחשת במיוחד בשרשרת הנשימה המיטוכונדריאלית, שבה 85% מה-O2 עובר חילוף חומרים ושם נוצרים תוצרי ביניים מופחתים חלקית של O2 בכמות נמוכה [1]. O2−→+e−O∙−2−→−−−−−−+e−(+2H+)H2O2−→+e−HO∙(+HO−)−→−−−−−+e−(+2H+ )2H2O
שלושת המינים העיקריים, הם אלו שהוזכרו למעלה, כלומר אניון הסופראוקסיד (O2•‒), מי חמצן (H2O2) ורדיקל ההידרוקסיל (HO•), נקראים מיני חמצן תגובתיים השם נובע מכך שאלו הן תרכובות המכילות חמצן והן בעלות תכונות תגובתיות. O2•‒ ו-HO• מכונים בדרך כלל "רדיקלים חופשיים". הם יכולים להגיב עם מצעים אורגניים ולהוביל למיני ביניים המסוגלים להמשיך לייצר ROS אחרים. לדוגמה, הפשטה של אטומי H על ידי רדיקלים חופשיים HO על קשר C-H מובילה לרדיקל במרכז פחמן, המגיב במהירות נוספת עם O2 כדי לתת רדיקל פרוקסיל RO2• [ – Haber F., Weiss J. The catalytic decomposition of hydrogen peroxide by iron salts. Proc. R. Soc. Lond. 1934;147:332–351.מקור]
הערה2– אנזימי ה- NADPH אוקסידאזים קשורים לממברנה בתא אשר פונה לחלל החוץ תאי. האנזימים האלו (NADPH אוקסידאז) מזרזים את הייצור של הרדיקלה חופשי סופראוקסיד על ידי העברת אלקטרון אחד לחמצן מ- ADPH [מקור].

משפחת ה-NOX או האנזים – NADPH Oxidases (NOX)
תשעים אחוז מה-ROS נוצר כאשר אלקטרונים בורחים משרשרת ההובלה האלקטרונית במהלך יצירת האנרגיה במיטוכונדריון (ETC) [מקור]. מספר אנזימים אחראים לייצור ROS. והחשוב ביותר, בהם הוא NADPH אוקסידאז (NOX), הוא האנזים שמזרז את התהליך הנקרא התפרצות נשימתית (respiratory burst (או פרץ חמצוני). היא שחרור מהיר של מיני החמצן התגובתי (ROS), אניון סופראוקסיד (O−2) ומי חמצן hydrogen peroxide (H2O2), יודגש כי פרץ חימצוני טבעי – הוא משמש במצב התקין להגנה אימונולוגית של בעלי חיים יונקים בכללם האדם, אך גם ממלא תפקיד באיתות תאים. פרץ נשימתי מעורב גם בביצית של בעלי חיים לאחר ההפריה. והוא עשוי להתרחש גם בתאי צמחים [מקור] [מקור].
שבעה בני משפחת NOX מוכרים לנו כיום: NOX 1-5 ואוקסידאזים כפולים 1 ו-2 (DUOX 1 ו-2); עם ההפעלה, הם מפחיתים דיאוקסגן לאניון סופראוקסיד באמצעות NADPH או NADH כתורם אלקטרונים. למרות העובדה שלחברי NOX יש מבנה ופעילות אנזימטית דומים, הם שונים במנגנון ההפעלה שלהם. לדוגמה, NOX 1-4 דורשים p22phox לפעילותם, NOX 1 ו-3 זקוקים כבר ל-לNOXO1, ותת-יחידת המשנה הקטנה של GTPase Rac משויכת ל-NOX 1 ו-2. בנוסף, NOX5 ו-DUOX 1-2 מופעלים על ידי סידן [מקור]. לאנזימי DUOX יש תפקיד כפול; הם אנזימים המייצרים ROS והם כבר משתמשים ב-בH2O2 כדי לבצע חמצון של מצעים וזאת באמצעות תחום הפראוקסידאז שלהם [מקור]. בנויטרופילים, פעילות NOX מענינת והיא גם גורמת לשחרור סופראוקסיד וגם מגינה מפני פולשים מכיוון שהסופראוקסיד ממלא תפקיד של קוטל חיידקים. בתאים לא-אימוניים, פעילות NOX ממלאת תפקיד בשגשוג, נדידה, היצמדות וגדילה של תאים, ובגרעין היא ממלאת תפקיד בביטוי גנים [מקור1, מקור2, מקור3, מקור4, מקור5, מקור6]. למהלך הזה מתגייסים כאן,הגלוטתיון – מדובר בגלוטתיון מופחת (Reduced glutathione) GSH שהוא נוגד חמצון לא אנזימטי אשר תורם אטום מימן מחמצן מים GSSG. ויטמין C המוכר לנו גם ממנות כגון פלפלים, ברוקולי, קייל ותרד גם בעגבניות ופרי הדר מדובר כמובן בחומצה אסקורבית (ויטמין C). למאמרי גלוטתיון כל האמת.
גלוטתיון Glutathione ו-N-אצטיל-ציסטאין (NAC)
הערה – גלוטתיון מופחת (Reduced glutathione GSH) הוא נוגד חמצון לא אנזימטי חיוני שנוצר באופן טבעי בגוף האדם, ויעד מרכזי לתהליכי החלמה. בתאי יונקים. GSH יכול לפעול ישירות כנוגד חמצון להגנה על תאים מפני רדיקלים חופשיים ופרו-אוקסידנטים, וכקופקטור לאנזימי נוגדי חמצון ומשמש גם לניקוי רעלים כגון גלוטתיון פרוקסידאזות, גלוטתיון S–טרנספראזות וגליוקסאלזות. גלוטתיון פרוקסידאזים משחררים רעלים מפרוקסידים על ידי תגובה המקושרת לחמצון GSH לגלוטתיון דיסולפיד (GSSG). GSSG מומר בהמשך הדרך חזרה ל-GSH על ידי גלוטתיון רדוקטאז (GSH) וקו-פקטור NADPH. GSH יכול לחדש ויטמין E בעקבות תגובות ניקוי רעלים של ויטמין E עם רדיקלים ליפידים פרוקסיל (LOO). GSH הוא קו-פקטור ל-GST במהלך ניקוי רעלים של חומרים אלקטרופיליים וקסנוביוטיקה. מתח דיקרבוניל המושרה על ידי מתילגליוקסל וגליוקסל מוקל על ידי אנזימי גליאוקסאלז ו-GSH. GSH מווסת איתות חיזור באמצעות חמצון הפיך של שאריות ציסטאין שהוא חלבון מכריע וקריטי על ידי S-גלוטתיונילציה. GSH גם מעורב בתהליכים תאיים אחרים כגון קיפול חלבון, הגנה על תיאולים חלבונים מפני חמצון והצלבה, פירוק חלבונים עם קשרי דיסולפיד, ויסות וריבוי מחזור התא, חילוף חומרים של אסקורבט, אפופטוזיס ופרופטוזה [מקור1, מקור2].
התברר שמוות של תאים בגופנו יכול להתרחש באמצעות מנגנונים שונים המובילים לסיווגים של סוגים שונים של מוות תאי כגון אפופטוזיס, פרופטוזיס ונקרופטוזיס. ROS ממלא תפקידים חשוב ומועיל בכל צורות המוות של תאים שיש לסלקם, אבל רק לאחרונה נכנס למוקד ש-ROS שולט וקובע את סוג המוות של התא המתרחש בכל תא נתון.
כל עוד מדובר בשליטה על כמות המחמצן רב הכוח הוא בהחלט פועל להגנה ולטובה,
כאשר מדובר
בעודף, נוכח תזונה שגויה, שהוזכרה, מוות תאי בתיווך ברזל, ל-ROS עשויות להיות השפעות מזיקות על איתות ונזק סלולרי המוביל למוות של תאים לא רצויים
תאי בלען או פגוציטים מייצרים באופן טבעי רמות גבוהות של מיני חמצן תגובתיים (ROS) תוך שימוש במשפחת האנזימים-NADPH (NOX) כחלק מכוחות או כלי ההגנה שלהם או של המנגנונים המיקרובידיים שלהם [מקור]. הפגוציט (תא בלען) אוקסידאז מרובה רכיבים (Phox), שאופיין היטב בשלושת העשורים האחרונים, כולל את תת-היחידה הקטליטית gp91phox. רמות נמוכות יותר של ROS נראות בתאים לא-פגוציטים, אך בדרך כלל נחשבות לתוצרי לוואי מקריים של חילוף חומרים אירוביים. הגילוי החדש של משפחה של הומולוגים יוצרי סופראוקסיד של gp91phox הוביל לתפיסה ש-ROS נוצר על-ידי התא בכוונה. במיוחד בתאים אלה שרכשו פונקציות תאיות ייחודיות הקשורות לחסינות מולדת, המרת אותות ושינוי של המטריצה החוץ-תאית – כלומר שינוי הרכבו הכימי של הנוזל הבן תאי [מקור1, מקור2].
ההשפעות ההרסניות של שינוי הנוזל הכימי הבן תאי נקשרות באפיגנטיקה – אנחנו מטפלים בהן כיום על-ידי הכנת תפריטי החלמה אישיים –
עוד בנושא זה במאמרי "אפיגנטיקה ומזון כתרופה ביולוגית להחלמה ממחלות גנטיות"- כאן.
במשפחה זו מזהים כיום שבעה חברים, עם הפצות רקמות ומנגנוני הפעלה שונים. NADPH אוקסידאז הוא אנזים רב תת-יחידות הכולל רכיבים של ממברנה ורכיבים ציטוסוליים, המתקשרים באופן פעיל במהלך תגובות המארח למגוון רחב של גירויים, כולל זיהומים ויראליים וחיידקיים. קומפלקס אנזימטי זה מעורב בתפקודים רבים, החל מהגנה על תא המארח ועד איתות סלולרי וויסות ביטוי של גנים. מחסור ב-NOX עלול להוביל לדיכוי חיסוני, בעוד שהצטברות תוך תאית של ROS גורמת לעיכוב של התפשטות ויראלית ואפופטוזיס. אבל, ייצור העודף של ROS גורם ללחץ תאי, המוביל למחלות קטלניות שונות, כולל מחלות אוטואימוניות, אי-ספיקת כליות, סוכרת 2, וסרטן [מקור1, מקור2].
בשלבים המתקדמים יותר של הפציעה, NOX (enzyme NOX פועל לתיקון רקמות באמצעות אינדוקציה (השראה) של אנגיוגנזה (היא היווצרות של כלי דם חדשים.) ושגשוג תאים.
הפעילות הזו דורשת הבנה מלאה והתעמקות רצינית ביכולת של NOX לקדם תהליכי החלמה של הגוף. ככל שנבין את תפקידו של האנזים NOX בהגנה ותיקון רקמות נוכל להפחית דלקת כרונית ולחץ חימצוני שמקדם מחלות כרוניות קשות ומוות [מקור].
ROS מיוצרים באופן אנדוגני ויש להם משמעות פיזיולוגית ברמות נמוכות, במיוחד בנתיבי איתות [מקור], אם כי מנגנונים אלו אינם ברורים עדיין בגלל התפקיד הכפול של ROS כמגן מהתפשטות ויראלית, איתות סלולרי, מגן על התא וגם כגורם מזיק [מקור]. בין תפקידי האיתות החשובים של ROS ניתן למנות בקרת תמלול [מקור] וויסות מחזור התא [מקור]. כשישנה הצלבה ברורה למדי בין ROS מיטוכונדריאלי אנדוגני (שפועל בתוך המיטוכונדריון) ואנזימי חיזור וזאת החל מ-NADPH אוקסידאזים (NADPH oxidases) ועד לקולטנים לאנגיוטנסין I/II [מקור1, מקור2].
למאמרי
- רוצה להחלים בצורה מלאה מסוכרת
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- ממצאים חדשניים למקור הגאוט
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- אי ספיקת כליות – הגורמים השכיחים ביותר ל-CKD הם סוכרת שנשלטת על ידי תרופות = שליטה גרועה בסוכרת ויתר לחץ דם שמטופל לכאורה על-ידי תרופות
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- גלוטתיון Glutathione ו-N-אצטיל-ציסטאין (NAC)
לסיכום יתר גלוקוז תזוני הוא ROS מוגבר במיטוכונדריון ומה שפוגע בתשתית התא, ומעורר תגובות מתח שהמיטוכונדריה עצמה אחראיות עליהן [מקור]. בנוסף לנאמר עד כאן ה – ROS מעורר באופן ישיר את ה- NF-kB [מקור], JNK [מקור], וכן את ה-p38 MAPK [מקור] אשר מעלים בתורם את תגובות הסטרס שנגרמות על ידי המיטוכונדריה.
רמות ROS מוגברות אלה כבר מעוררות ביקוע מיטוכונדריאלי ומכאן מתקבלת פעילות הן על מסלול קולטן האינסולין והן על חלבוני הלחץ [מקור]. וביקוע מיטוכונדריאלי (Mitochondrial fission) נקשר ישירות לתנגודת לאינסולין בשרירי השלד [מקור] (בזרם הדם, אינסולין פועל לאחסון אנרגיה במגוון רחב של תאים, כשהחשובים ביניהם הם תאי הכבד, השריר והשומן.).
מסלולי הלחץ והחלבונים הנגרמים כתוצאה מתפקוד לקוי של המיטוכונדריה מוכרים למדע, בימים אלה מתחילים להבין ש [מקור].
ניתן למנוע תנגודת לאינסולין (עמידות לאינסולין) על ידי הגבלת הפעלת יתר של המיטוכונדריה
[מקור].
הערה– אנזימי ה- NADPH אוקסידאזים קשורים לממברנה בתא אשר פונה לחלל החוץ תאי. האנזימים האלו (NADPH אוקסידאז) מזרזים את הייצור של הרדיקל החופשי סופראוקסיד על ידי העברת אלקטרון אחד לחמצן מ- ADPH [מקור]. NADPH oxidase 4 (NOX4) הוא אנזים מחמצן רב עוצמה שמייצר ROS. מעל רמה מסויימת של ריכוזי אינסולין אופטימליים, חל שינוי במסלול האיתות שמתרחש ב-PI3-kinase נושא שאפשר לעקוב אחריו באיור למעלה [מקור].הפעילות של האנזים הזה (NOX4) הולכת ומתגברת ככל ש- PI3-kinase מזרחן את Rac במקום PIP2, [מקור]. רמות ROS עולות. ה-ROS המוגבר מפעיל קזאין קינאז-2 (CK2) אשר בתורו מפעיל את הרטרומר (retromer) [מקור]. לאחר מכן, הרטרומר מאותת לרשת הטרנס-גולגי במורד הזרם, ו-GLUT4 מועבר לליזוזומים לפירוק במקום לממברנת הפלזמה. כך אנו מוצאים רמות גלוקוז תוך-וסקולרי גבוהות והן נשארות גבוהות בסביבה החמצונית [מקור].
הערה – רטרומר הוא קומפלקס של חלבונים חשוב שמשתתף במיחזור של קולטנים טרנסממברניים מאנדוזומים לרשת הטרנס-גולגי (TGN) ובחזרה ממנה לממברנת הפלזמה. מוטציות ברטרומר והחלבונים הקשורים אליו נקשרו למחלות אלצהיימר ופרקינסון [מקור].
מתח חמצוני שנגרם בתא על ידי עודף מינים חמצוניים אנדוגניים, הוכר לאחרונה כמנגנון מפתח בתנגודת לאינסולין.
[מקור].
מיטוכונדריה תורמת גם לחמצון בתא עקב סביבות תזונתיות שגויות. למשל אספקה מוגברת של גלוקוז בתזונה- במקרים בהם הגוף מגיב רע לתפריט זה כמו במקרה של תזונה עתירת סוכר, למיטוכונדריה יש יותר מצע זמין לייצור ATP. לפיכך המיטוכונדריה היפראקטיביות ומייצרות יותר מתוצר הלוואי הטבעי שנדרש לשלמותן, ROS [מקור]. ROS מוגבר מתפתח ופוגע בתשתית התא, משבש ומעורר תגובות מתח שהמיטוכונדריה אחראיות עליהן. ROS ממריץ ישירות את NF-kB [מקור – Cooper G. 7th ed. Sinauer; Massachusetts: 2013. The cell: a molecular approach], JNK [מקור] ו-p38 MAPK [מקור] וכתוצאה מכך מתרחבות תגובות מתח שנגרמות על ידי מיטוכונדריה.
רמות ROS מוגברות שנוצרות נוכח יתר גלוקוז שמגיע אל המיטוכונדריה הן שגורמות לביקוע מיטוכונדריאלי וכתוצאה מכך לפעולות הן של מסלול קולטן האינסולין והן של חלבוני הלחץ (stress proteins) ובהמשך להגברה של התנגודת לאינסולין!!!
ניתן למנוע עמידות לאינסולין על ידי הגבלת הפעלת יתר של המיטוכונדריה
יתר גלוקוז
מיטוכונדריה שנחשפת לסביבה תזונתית גרועה לה (יתר גלוקוז) – תורמת גם היא למהלך של חמצון יתר בתא.
אספקה מוגברת של גלוקוז בתזונה עתירת פחמימות, וסוכר, מנכיחה יתר מצע ויתר זמינות במיטוכונדריון לייצור ATP. במצב כזה נוצרת פעילות יתר במיטוכונדריון. אנו רואים היפראקטיביות מיטוכונדריאלית והמיטוכונדריה בהמשך מייצרות יותר ROS הוא כאמור אחד מתוצרי הלוואי הטבעיים וההכרחיים להגנה שלהן על עצמן [מקור].
לאפשר לקצרולומר ש
יתר גלוקוז תזוני הוא ROS מוגבר במיטוכונדריון ומה שפוגע בתשתית התא,
ומעורר תגובות מתח שהמיטוכונדריה עצמה אחראיות עליהן [מקור]. רמות ROS מוגברות אלה כבר מעוררות ביקוע מיטוכונדריאלי ומכאן מתקבלת פעילות הן על מסלול קולטן האינסולין והן על חלבוני הלחץ [מקור]. כשביקוע מיטוכונדריאלי (Mitochondrial fission) מהדהד נוכח התנגודת לאינסולין [מקור].
מסלולי הלחץ והחלבונים הנגרמים כתוצאה מתפקוד לקוי של המיטוכונדריה מתחיל אבל
ניתן כאמור למנוע זאת (עמידות לאינסולין) על ידי הגבלת הפעלת יתר של המיטוכונדריה
[מקור]. לשם כך נחוץ לכל הפחות להשתמש בתוסף מזון קו אנזים Q10 במינון גבוה.
הערה – ביקוע מיטוכונדריאלי הוא התהליך שבו המיטוכונדריה מתחלקת או נפרדת לשני אברונים מיטוכונדריים נפרדים. בניגוד לביקוע מיטוכונדריאלי מתרחש תהליך היתוך מיטוכונדריאלי, בו שתי מיטוכונדריה נפרדות יכולות להתמזג ליצירת מיטוכונדריון אחד גדול [מקור].
H2O2 נחקר במיוחד במחקרים אלה כאחד מ"מתגי החיזור" הללו שיכולים להוביל למעגלים קסמים של גירוי חיזור. מקובל זה זמן מה ש-ROS הופך לפגיעה בתאים מעבר לרמות פיזיולוגיות נמוכות. מחקרים אחרונים הגיעו למסקנה שלנזק ROS יש תפקידים ישירים בהתפתחות והתקדמות של מחלות כרוניות רבות, כולל הפתוגנזה של תנגודת לאינסולין וסוכרת מסוג 2
איתות אינסולין שולט בגישה לגלוקוז בדם בתאי הגוף.
קולטן לאינסולין הוא קולטן טרנסממברנלי שמופעל על ידי אינסולין. הקולטן לאינסולין הוא חלק ממשפחה גדולה של קולטנים המכונים: רצפטור טירוזין קינאז (RTK) . קולטנים אלו נמצאים על גבי ממברנת התאים והם מתווכים מעבר של מסרים שמגיעים מחוץ לתא אל תוכו. יכולתם זו נבנתה הודות למבנה שלהם המורכב מחלק חוץ-תאי, חלק שחוצה את דופן התא (ממברנה) וחלק נוסף שנמצא בתוך התא. החלק התוך-תאי הוא בעל פעילות של טירוזין קינאז (אנזים שמוסיף לחלבוני-המטרה קבוצת פוספט אל שמו מוסיפים סיומת: "קינאז". כך למשל, אנזים שמוסיף את הפוספט לחומצת אמינו טירוזין בחלבון המטרה נקרא טירוזין-קינאז Tyrosine kinase). הקישור של האינסולין לחלק החוץ-תאי גורם להפעלה של הקינאז, מה שמעורר שרשרת תגובות תוך תאיות. דוגמה לחלבון מטרה כזה הוא ה "insulin receptor substrate 1"-"IRS-1". כאשר מדובר בקולטן לאינסולין לתגובה התוך-תאית יש שני מסלולים עיקריים: מסלול אחד אחראי על רוב הפעילות המטבולית של אינסולין ומוביל, בין היתר, למעבר נשאים של גלוקוז מהציטופלזמה אל ממברנת התא. כתוצאה מכך גדלה כניסת הגלוקוז לתאים. המסלול השני אחראי על גדילה והתמיינות של תאים באמצעות בקרת הביטוי של גנים מסוימים.
כאשר נוכחותו של האינסולין נופלת, במיוחד בקרב אלה שחווים רגישות לאינסולין גבוהה מ 4 ואפילו מ 5,
תאי הגוף בקרבם מתחילים לקבל גישה לשומנים בלבד ואין שימוש בגלוקוז.
גלוקוז היא מולקולה פולרית, והעברתה דרך הממברנה (דופן התא) דורשת חלבוני העברה ספציפיים [מקור]. נשאי גלוקוז (חלבון GLUT או משפחת SLC2A) הם חלבונים ממברנליים הנמצאים ברוב תאי היונקים, הם שמעבירים את הקסזות (hexose), שהן קבוצה של פחמימות בעלות 6 פחמנים, שהגלוקוז ופרוקטוז מהמוכרות ביותר בהן, תהליך ההעברה מתרחש בין צידי הממברנה הביולוגית – התהליך עצמו מכונה דיפוזיה קלה [מקור1, מקור2, מקור3]. השימוש במצב של תנגודת גבוהה לאינסולין (4 ומעלה) היא רק בשומנים והכוונה לשומנים שאינם דורשים הובלה על פני הממברנה [מקור]. האינסולין שהוא גם הרגולטור המרכזי של חילוף החומרים של השומנים. מבחינה ביוכימית, הקולטן לאינסולין מקודד על ידי גן INSR יחיד, שממנו שחבור חלופי במהלך שעתוק גורם לאיזופורמים IR-A או IR-B.[מקור] אירועים פוסט-טרנסלציוניים במורד הזרם של כל אחד מהאיזופורמים הוא שמביא ליצירת תת-יחידת α ו-β מפוצלת פרוטאוליטית, אשר בשילוב מסוגלות בסופו של דבר לבצע הומו או הטרו-דימריזציה לייצר את קולטן האינסולין הטרנסממברני של ≈320 kDa דיסולפיד מקושר.[מקור]
בבואנו להבין ולדון בתנגודת לאינסולין ויותר מכך נוכח הרצון להפחית את השפעותיה ההרסניות למטרות החלמה מיתר חומצת שתן, אי-ספיקת כליות ומחלות כרוניות נוספות, חשוב להכיר בהקשר זה גם את מסלול האותות של הקולטן לאינסולין [The insulin receptor (IR)] קולטן לאינסולין הוא קולטן טרנסממברנלי שמופעל על ידי אינסולין (IGF-I, IGF-II, האחרון מתבטא במיוחד במוח) הקולטן לאינסולין שייך למשפחה גדולה של קולטנים מעבירי אותות, פרוטאין קינאזות, ולתת משפחה הספיציפיות לזרחון טירוזין – טירוזין קינאז (אנ'), שיוזכר בהמשך [מקור].
מבחינה מטבולית, קליטת חומרי ההזנה החיוניים, מעבר החומרים אל תוך התאים וביניהם והשימוש בהם לצרכי תפקודו, הקולטן לאינסולין ממלא תפקיד מפתח בוויסות של הומאוסטזיס של גלוקוז [מקור1, מקור2] במצבים קליניים קשים כולל אי-ספיקת כליות, יתר חומצת שתן, אי ספיקת לב, סוכרת וסרטן שמוגדרים מצבים מנוונים יש לבחון את הקולטן לאינסולין ולבדוק ביסודיות אם הוא ממלא את תפקיד המפתח בוויסות של הומאוסטזיס של גלוקוז [מקור1, מקור2].
קולטני האיסולין משתייכים לקבוצה של העברת אותות מהקולטן לאינסולין והיא כוללת חלבונים רבים שפועלים ומעבירים את השדרים בכמה מסלולים. במאמר תורת הסיבות (האטיולוגיה) של עקה חמצונית בתנגודת לאינסולין "The etiology of oxidative stress in insulin resistance" מציגים החוקרים סמנתה הורל ווולטר ה. הסו Samantha Hurrle and Walter H. Hsu סכימה של מסלול זה יחד עם מסלול החמצון הפתוגני, היא יכולה לסייע להבנת המהלך ולהבהיר את הנרשם כאן הסכימה מופיעה למטה ומקורה – כאן.

גלוקוז טרנספורטר 4 (GLUT4) הוא מעביר הגלוקוז העיקרי ברקמות הרגישות לאינסולין ההיקפי, כלומר שריר השלד ורקמת השומן [מקור], והוא שמהווה מוקד של מחקר הקשור לתנגודת לאינסולין.
התא מגיב לאינסולין על ידי הגברת ביטוי GLUT4 בממברנת הפלזמה,
ובכך הוא, בהמשך הדרך, מגביר את הספיגה התאית של הגלוקוז מזרם הדם. עם זאת,
רמות גבוהות של איתות אינסולין מייצרות השפעה שלילית על נוכחותו של גלוקוז טרנספורטר 4 GLUT4 בממברנה
[מקור]. עד לריכוז אינסולין אופטימלי, התא ברגיל, מגביר את הניצול שלו במסלול העברת האינסולין הרגיל. מעבר לריכוזים אופטימליים, התא מראה שינוי כלפי מטה בביטוי GLUT4. ומתקבלות כתוצאה מכך רמות בדם של גלוקוז גבוהות והלבלב בתגובה מפריש יותר אינסולין, מה שמוביל ללולאת משוב שמרחיבה את המחלה – היא מעלה את הרמות התוך-וסקולריות של אינסולין ומביאה לחוסר רגישות של הרקמות ההיקפיות לאינסולין. האינסולין מדומם. הוא כבר לא משפיע יותר. ההשלכה הביו-מולקולרית של מחזור זה היא הביטוי המתמשך של GLUT4 המווסת למטה בקרום התא, מה שמחמיר את הבעיה [מקור]. התוצאה המערכתית של חוסר תפקוד זה היא היפרגליקמיה, היפראינסולינמיה ולחץ חמצוני מוגבר ברקמות
המנגנון מאחורי ויסות זה כולל חלבונים שונים בהמרה מאשר המסלול הרגיל. NADPH oxidase 4 (NOX4) הוא אנזים מחמצן רב עוצמה ומי שמייצר את ה- ROS. מעל ריכוזי אינסולין אופטימליים, שינוי במסלול האיתות מתרחש ב-PI3-kinase. PI3-kinase מזרחן את Rac במקום PIP2, מה שמגביר את הפעילות של NOX4 [מקור]. רמות ROS עולות כתוצאה מכך. ה-ROS המוגבר מפעיל קזאין קינאז-2 (CK2) אשר בתורו מפעיל את הרטרומר[מקור] שמתואר באיור למעלה – למטה מימין. לאחר מכן, הרטרומר מאותת לרשת הטרנס-גולגי במורד הזרם, ו-GLUT4 מועבר לליזוזומים לפירוק במקום לממברנת הפלזמה. כתוצאה מכך רמות הגלוקוז התוך-וסקולרי נשארות גבוהות והסביבה בה הן נמצאות היא סביבה חמצונית.
ביקוע מיטוכונדריאלי והשמנה ביטנית
השמנה – חומצות שומן חופשיות (FFA) נמצאות בשפע במצבי השמנת יתר ובמקרה שלנו במצבי השמנה בטנית [מקור]. חומצות שומן חופשיות (FFA) הן גורם נוסף שגורם לחוסר תפקוד תאי, במיוחד הן מכשילות את תפקודה של המיטוכונדריה [מקור]. מחקר שנעשה באדיפוציטים הראה רמות מוגברות של ביקוע מיטוכונדריאלי הנושא הוסבר למעלה וניכר באיור – נוסיף ונזכיר שהמיטוכונדריה היפראקטיביות ומייצרות יותר מתוצר הלוואי הטבעי שלהן ROS נוכח יתר גלוקוז תזוני [מקור]. המחקר מצביע על כך שגם חשיפה של התא לרמות גבוהות של חומצות שומן חופשיות FFA מעוררת שחרור המחמצן רב הכוח – ROS אנדוגני שמוביל לביקוע מיטוכונדריאלי [מקור]. ביקוע מיטוכונדריאלי מגביר כנזכר לעיל את ביטוי p38 MAPK ומוריד ויסות של IRS-1 ופונקציית Akt [מקור1, מקור2, מקור3, מקור4],
ככל שרקמת השומן עולה, רמות התעתוק המיטוכונדריות ברקמת השומן יורדות, וכתוצאה מכך ניצול הגלוקוז לקוי ברקמה זו התנגודת לאינסולין מתגברת ובהמשך הדרך עולה חומצת השתן בדם.
מחקר נוסף שנעשה באופן עצמאי הראה מנגנון נוסף שבאמצעותו רקמת שומן עודפת מפעילה את החמצון המערכתי, כמתואר למעלה. המחקר מצביע על כך שנושא זה מושג באמצעות תגובה דלקתית [מקור].
רקמת שומן עודפת מפרישה קבוצה מיוחדת של ציטוקינים, בשם המתאים אדיפוקינים [28]. מולקולות פרו-דלקתיות אלו גורמות לדלקת כרונית [איור. 2]. ציטוקינים מעודדי דלקת גורמים לפלישה כימוקטית לרקמת המטרה על ידי תאי חיסון אשר מפיצים עוד יותר את הבעיה [24]. מערכת החיסון תוקפת בשל כך רקמת שומן מצטברת וגורמת למצב קבוע של דלקת. דלקת כרונית ידועה כגורם למחלות ניווניות רבות, כולל מחלות ניווניות ומחלות לב [29]. אדיפוקינים אלה גם מעוררים ייצור ציטוקינים פרו-דלקתיים במקרופאגים, ומעודדים דלקת מערכתית.

אדיפונקטין – Adiponectin
הורמון שמופרש מרקמת השומן בשם אדיפונקטין (Adiponectin), עובר לזרם הדם ופועל לתיקון מצבי חמצון
[מקור].
אדיפונקטין (APN) הוא הורמון שנמצא בגופנו ומופרש על ידי רקמת שומן או מתאי השומן שנקראים אדיפוציטים [מקור1, מקור2, מקור3]. הוא מעורב בוויסות רמות הגלוקוז ופירוק חומצות השומן [מקור1, מקור2]. מחקרים שונים ואחרונים מוכיחים שאדיפונקטין (APN) מתבטא ו
פועל כמגן גם בתאים הפודוציטים (תאי הרגליים שהם חלק ממחסום הסינון שבכליה) של הכליה
[מקור1, מקור2, מקור3], וכן בתאי המזנגיה
[מקור-Tan M, Tang G and Rui H: Adiponectin attenuates Ang II- induced TGFβ1 production in human mesangial cells via an AMPK-dependent pathway. Biotechnol Appl Biochem. 62:848–854. 2015. 1, מקור2]
עוד נמצא שהאדיפונקטין (APN) מתבטא גם בתאי אפיתל צינוריים, במיוחד באלו שמקורבים לפקעית הסינון שבכליה ומסייע לתהליכי ההחלמה מהדלקת [מקור1, מקור2].
שלושה מרכיבים במערכת הסינון הכלייתית – הגלומרולוס תורמים למחסום הסינון הגלומרולרי, ומונעים בריחת חלבונים לחלל השתן: תאי אנדותל (E), רקמת החיבור של הפקעית – אשר מורכבת מהתאים המזנגיים שהוזכרו המזנגיום (Mesangial cells, M) וכן הפודוציטים שהוזכרו לעיל,. שני האחרונים ניצלים בעזרת הרמת מדדי האדיפונקטין.
בניגוד לפעולה של אדיפוקינים מסוגים אחרים, רמות האדיפונקטין שבה דיוננו יורדות ככל שרקמת השומן מצטברת [מקור]. לאדיפונקטין (APN) השפעות מגוננות מפני דלקת והוא בעל יכול לווסת באופן חיובי את המערכת האנדוקרינית, על ידי הגברת הרגישות לאינסולין כפי שנמצא במחקר בבעלי חיים שמנים כמו גם בבני האדם [מקור1, מקור2, מקור3]. רגישות גדולה יותר לאינסולין, משמעותה שגלוקוז שמסתובב בזרם הדם יכול לחדור בקלות רבה יותר לרקמות בתגובה לאינסולין. כאשר אדיפונקטין נקשר לקולטן AdipoR1 שלו, הוא מגרה בעקיפין את הקולטן לאינסולין, ומגביר את תפקודו של האינסולין בגוף האדם, מה שמאפשר ליותר גלוקוז להיכנס לתאים. בבני-האדם האדיפונקטין מקודד על ידי הגן ADIPOQ ומיוצר כאמור ברקמת שומן, אך חלק ממנו מיוצר גם בשרירים ואפילו במוח [מקור1, מקור2]. האדיפונקטין משפר קטבוליזם (פרוק של מולקולות גדולות) של חומצות שומן ומווסת באופן פעיל ביותר גם את רמת הסוכר בדם [מקור1, מקור2]. אדיפונקטין (APN) במדדי טווח הנורמה ממריץ את חמצון חומצות השומן בשריר השלד, ובהמשך הוא מפחית את הצטברות הטריגליצרידים (TG) [מקור1, מקור2]. והטריגליצרידים מככבים במשוואה לחישוב תנגודת לאינסולין כשירידה בכמות הטריגליצרידים בדם היא ירידה ישירה של ההתנגדות להשפעותיו המבורכות של הורמון זה. נמצא כי ריכוזו עולה על-ידי תרגול ופעילות גופנית כמו ריקוד, הליכה, שחיה, מתיחות וריצה. פעילות גופנית בהחלט יכול לשמש כאן תרופה ולהחזיר רמות ירודות של הורמון אדיפונקטין (APN) למדדיו הטבעיים טרם השמנה (למשל השמנה בטנית). במדדי טווח הנורמה האדיפונקטין יכולים להמריץ ולהגביר את ספיגת הגלוקוז ואת חמצון חומצות השומן באמצעות הפעלת 5'-אדנוזין מונופוספט (AMP) קינאז (AMPK) [מקור1, מקור2].
מנקודת מבט מולקולרית, האדיפונקטין (APN) קיים בשלוש צורות בעלות משקל מולקולרי שונה כל אחת: משקל מולקולרי נמוך (LMW), משקל מולקולרי בינוני (MMW) וצורה של משקל מולקולרי גבוה (HMW). לכל צורה כזו של אדיפונקטין (APN) פעילויות משלה שהיא ייחודית רק לו [מקור1, מקור2]. לדוגמה, HMW מיוחד בכך שפועל בנושא ספיגת הגלוקוז בהשפעת השמנה למשל השמנה בטנית (גברים והשמנת האגס (נשים) [מקור1, מקור2, מקור3]. הרמות של האדיפונקטין יורדות, אבל הן נמוכות באופן שונה בכל אחת מהמחלות למשל בהשמנת יתר, סוכרת, הפרעות לב וכלי דם או ביתר חומצת שתן, אי-ספיקת כליות וצורות שונות של סרטן, בנוסף אפשר להתעמק בו ולהכיר גם את המפל המולקולרי והתאים שלו באיברים שונים ואת תגובותיו ביחס לתזונה רעה או מיטבית [מקור]. תעלומת האדיפונקטין (APN) קשורה בנושא רמתו. בניגוד לפעולתם של אדיפוקינים אחרים, רמות האדיפונקטין יורדות ככל שרקמת השומן הולכת ומצטברת בגוף [מקור]. החוקרים לא מצליחים להסביר זאת, אך ניתן לווסת אותו בשיטות פוסט-תרגום. ידוע כי אדיפונקטין (APN) נוגד תנגודת לאינסולין על ידי הגברת ביטוי IRS-2 בכבד [מקור], המתווך על ידי FGF-21 [מקור]. רקמת שומן עודפת היא אפוא איבר דינמי שיכול לשפר או לרפא את ההשפעות של עקה חמצונית בגוף והנמכתה [מקור] יכולה גם היא להעלות את רמתו של האדיפונקטין [מקור].
לסיכום לירידה בשומן שבגוף יתרונות משמעותיים על חילוף החומרים. היא מפחיתה את הסבירות להתנגדות לאינסולין ומשפיעה לטובה על עמידות לאינסולין ארוכת שנים כמו גם לפעילות גופנית. שני יסודות תרופתיים אלו מעלים את האדיפונקטין (APN) והוא מפחית את הצטברות הטריגליצרידים (TG) [מקור1, מקור2]. והטריגליצרידים מככבים במשוואה לחישוב תנגודת לאינסולין. ללא ספק השילוב של השניים הוא תרופה.
אדיפונקטין (Adiponectin) ויתר חומצת שתן
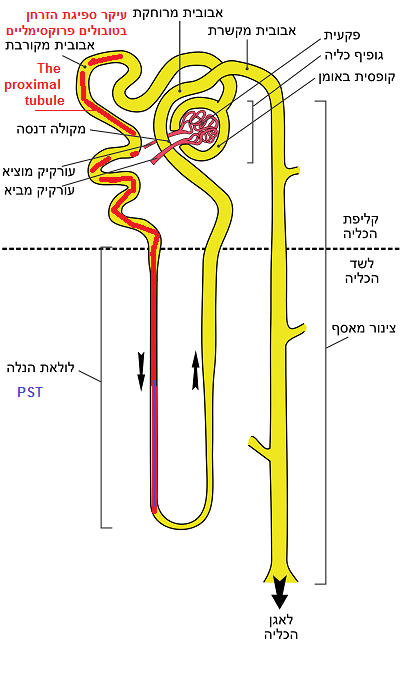
אדיפונקטין (APN) מגן מפני תגובות דלקתיות הנגרמות על ידי חומצת שתן באמצעות מסלול האיתות AdipoR1/AMPK [מקור].
אדיפונקטין (APN) מפעיל השפעות אנטי דלקתיות בתאים שונים. כאשר חומצת שתן (UA) גורמת לדלקת בתאי האפיתל הצינורי של הכליות – הכוונה לחלקים הפרוקסימליים שבנפרון (PTECs) שנראים באיור למעלה. מחקרים עדכניים וחלקם מתרחשים עדיין לעינינו ממש בימים אלו בוחנים כיצד האדיפונקטין (APN) מגן מפני דלקת הנגרמת על ידי יתר חומצת שתן UA בתאי האפיתל שבכליות ומסייע בכך להחלמתם של חולי הכליה [מקור] יודגש שאין ספק בהשפעה המיטיבה של ההורמון שנמצא בגופנו ומופרש על ידי רקמת שומן – האדיפונקטין ואין ספק שמדדיו עולים ומסייעים נוכח הפחתת שומן ופעילות גופנית. נושא זה מסביר מדוע ספורטאים, בכלל זה רץ מרתון, שחקן כדור סל מקצועי, רקדן באלט שנכנסו לתהליכי החלמת הכליות, בניגוד להמלצת הרופאים המשיכו להתאמן באופן מלא והשיגו החלמה, בלימת המחלה והתקדמות משאלות של ליבם.
במאמר יחסים זמניים ודו-כיווניים בין חומצת שתן לאינסולין מתארים החוקרים – מחברי המאמר – את השפעתם המשותפת על תחלואה [מקור]. חומצת השתן (UA) היא כידוע תוצר סופי של חילוף החומרים של פורין בבני אדם [מקור]. הקשר החזק בין חומצת השתן (UA) לאינסולין מצביע על כך שהיפר-אוריצמיה ותנגודת לאינסולין משפיעים זה על זה בהתבסס על מנגנונים פתופיזיולוגיים [מקור]. החוקרים לא מצליחים להסביר זאת, אבל ניכר כי ריכוזי אינסולין מוגזמים מגבירים את הספיגה החוזרת של חומצת השתן בכליה, וכתוצאה מכך מדדיה בדם עולים ויוצרים את ההיפראוריצמיה [מקור1, מקור2]. בהמשך הרמות (UA) הגבוהות של חומצת השתן בדם פוגעות בגמישות העורקים בכך שהןצl מפחיתות את הזמינות הביולוגית של תחמוצת החנקן (NO) ומקדמות את התנגודת או העמידות לאינסולין [מקור1, מקור2 ]. למאמרי על תחמוצת החנקן והדרכים שלנו להגביר את השפעותיה המבורכות על גמישות העורקים – "תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות" – כאן. הפחתה של תנגודת לאינסולין (הפחתת שומן בטני, אגסי, פעילות גופנית, הגברה של ייצור גלוטתיון בגוף [מקור], שימוש בויטמינים, כמו ויטמין E, C. בשנים האחרונות הוכח שמתן מלטונין משפר תנגודת לאינסולין ואת פעולת האינסולין המדוממת – מכונה היפראינסולינמיה in vivo [מקור1, מקור2, מקור3]. ופעילות גופנית כמחול ושחיה והליכה) לצד הגברה של גמישות העורקים, שימוש בקמח קליפות אננס (ברומליין) שמשמש מזון כתרופה למטרה זו – נושא עליו אפשר לקרוא עוד כאן, וכאן משמשים אותנו כיום להפחתת חומצת שתן שמקורה במערכת יחסים בין חומצת השתן (UA) לאינסולין [מקור] ומחסור בתחמוצת החנקן (NO) בגוף האדם [מקור1, מקור2 ]
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
For the avoidance of doubt, consult a physician (who knows in detail the general health of each patient or yours) before using any medicine, food, extract or any exercise. The information on Yaron Margolin's website or the "Healing Presses" website (on Facebook or MARGOLINMETHOD.COM), in the above article and in Yaron Margolin's articles are material for thought – philosophy neither recommendation nor public guidance to use or cease to use drugs – no information on this site or anyone You should always consult with a qualified physician or pharmacist regarding pain, bad feeling, or goals and how to use foods, ointments, extracts and even exercises, or other remedies that are mentioned as such
מאמרים אחרונים
- חימצון האינסולין והגברה של חומצת שתן בדם, גאוט, אי ספיקת כליות, שבץ לב וסוכרת
- ירידה בתפקוד הכליות – מה לעשות?
- התכנית לשיקום הכליות – כאן.
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים.
- לחץ דם גבוהה מסיבות נפשיות ויתר סטרס בחיי האדם
- דלדול עצם – אוסטאופורוזיס (Osteoporosis) מה אפשר לעשות כדי לחזק את העצמות ללא תרופות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- ממצאים חדשניים למקור הגאוט
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- צרבת כרונית – רוצה להחלים ללא תרופות?
- יתר שומנים בדם היפרליפידמיה – חשש לצורך בצנתור
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- רוצה להחלים מאי ספיקת כליות – יש להגיע לטיפול מחלים כליות מהר ככל האפשר
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- בילירובין – Bilirubin – מדד גבוה מה לעשות
- ירידה בתפקוד הכליות – מה לעשות?
- חקר המשמעות של 20 חומצות האמינו בסינתזת חלבון
- אנמיה – רוצה להחלים ממחלה כרונית קשה. זרקור אל הטרנספרין הנמוך מלח שולחן ויתר לחץ דם
- אנמיה – רוצה להחלים ממחלה כרונית קשה. זרקור אל הטרנספרין הנמוך
- ירידה בתפקוד הכליות – מה לעשות?
- התכנית לשיקום הכליות – כאן.
- מלח שולחן ויתר לחץ דם
- דנרבציה כלייתית Renal denervation (RDN)
- שקט נפשי נמצא חשוב בבריאותם של האנשים ויותר מכך בקרב גימלאים
- בריאות הנפש ואריכות ימים – מאמר על הטלומרים והשפעת הרגשות עליהם
- ברומלין או קמח קליפות אננס
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם
- לחץ דם גבוהה מסיבות נפשיות ויתר סטרס בחיי האדם –
- איך לא להגיע לדיאליזה
- זיהום סביבתי מקדם את מחלת הכליות
- הבדידות – חזית חדשה ומקור רב משמעות למחלות כרוניות – מגפת הבדידות
- שיגאקי הינוהרה הרופה שהמליץ ליהנות מהחיים, להיות צנוע מול צלחת האוכל ולצאת לגמלאות מאוחר ככל האפשר
- הליקובקטר פילורי – Helicobacter pylori חיידק חתרני שנמצא כמעט אך ורק בבני אדם – טיפול
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- מזון למוח – המזון הבריא למוח תומך בגמישות מערכת העצבים שלו וביכולת הלמידה, שומר על הזכרון, ומונע מחלות כגון אלצהיימר.
- למה אני לא מצליח להתמיד – והסוכר
- Lecithin לציטין – מזון כתרופה ומולקולה שומנית, שמגינה על המוח, הכבד, הלב, ועל דופן המעי
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה.
- סטרס יכול לעתים גם לרפא – מחקר חדש על תאי המוח
- שעועית הקטיפה הקסומה – המקונה פרריינס או קִטְנִיּוֹת ההצלה והתשוקה – מזון החלמה שיכול להציל חולי פרקינסון – Mucuna pruriens
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- מרחבי חיים מאריכי חיים – האזורי הכחולים
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- תוספי סידן – זהירות – סיכון לשבץ מוחי
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- ניתוק רגשי – על הקורוציונה
- די לכאב
- ראיית המעמקים – כניסה לטרקלין או על החיים האמתיים.
- התודעה השלילית
- ביקורת מבזה
- איך לצאת ממצבי תקיעות בחיים – שיטת שלוש השאלות בגובה העיניים
- נמאס לי מהחיים מה עושים
- על היכולת להשתקם, לקום מאבק הדרך ומכאב הפרידה
- לחץ דם גבוהה מסיבות נפשיות ויתר סטרס בחיי האדם
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה.
- התרופות והרע – נזקי התרופות ללחץ דם
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- מגיע לי – העדר הכרה במאמץ של השועט קדימה, יכולה להרוס אותך
- דיוקסינים במזון
- דלדול עצם – אוסטאופורוזיס (Osteoporosis) מה אפשר לעשות כדי לחזק את העצמות ללא תרופות?
- שקט נפשי נמצא חשוב בבריאותם של האנשים ויותר מכך בקרב גימלאים
- בריאות הנפש ואריכות ימים – מאמר על הטלומרים והשפעת הרגשות עליהם
- ברומלין או קמח קליפות אננס
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם
- איך לא להגיע לדיאליזה
- זיהום סביבתי מקדם את מחלת הכליות
- הבדידות – חזית חדשה ומקור רב משמעות למחלות כרוניות – מגפת הבדידות
- שיגאקי הינוהרה הרופה שהמליץ ליהנות מהחיים, להיות צנוע מול צלחת האוכל ולצאת לגמלאות מאוחר ככל האפשר
- הליקובקטר פילורי – Helicobacter pylori חיידק חתרני שנמצא כמעט אך ורק בבני אדם – טיפול
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- להחלים מסוכרת ואי ספיקת כליות
- הקשר של כבד שומני, ומחלת כליות כרונית מחקר חדש
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש.
- למה חסר לי ברזל – כאן
- דלדול עצם – אוסטאופורוזיס (Osteoporosis) מה אפשר לעשות כדי לחזק את העצמות ללא תרופות?
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- להחלים מסוכרת ואי ספיקת כליות
- הקשר של כבד שומני, ומחלת כליות כרונית מחקר חדש
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש.
- רזון – ירידה בלתי רצונית במשקל – Unintentional weight loss
- להחלים מאלצהיימר – Alzheimer's disease מחלה קשה, שאפשר להשתקם ממנה
- מכתב תודה ממחלימת כליות בתוך ארבעה חודשים
- שיראטאקי אטריות קונג`אק – מתכונים
- זיהום סביבתי מקדם את מחלת הכליות
- הבדידות – חזית חדשה ומקור רב משמעות למחלות כרוניות – מגפת הבדידות.
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם.
- שיגאקי הינוהרה הרופה שהמליץ ליהנות מהחיים, להיות צנוע מול צלחת האוכל ולצאת לגמלאות מאוחר ככל האפשר
- תנגודת לאינסולין (insulin resistance) מאת ירון מרגולין
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ’יינג’
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- הליקובקטר פילורי – Helicobacter pylori חיידק חתרני שנמצא כמעט אך ורק בבני אדם – טיפול
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מזון למוח – המזון הבריא למוח תומך בגמישות מערכת העצבים שלו וביכולת הלמידה, שומר על הזכרון, ומונע מחלות כגון אלצהיימר.
- שיראטאקי אטריות קונג`אק – מתכונים
- דילול השכבה הדמית [כורואיד (Choroidal)] ורשתית העין במחלת כליות כרונית קשור באופן ישיר לירידה ב-eGFR וניתנים לשינוי עם הטיפול התזונתי.
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- Lecithin לציטין – מזון כתרופה ומולקולה שומנית, שמגינה על המוח, הכבד, הלב, ועל דופן המעי
- שעועית הקטיפה הקסומה – המקונה פרריינס או קִטְנִיּוֹת ההצלה והתשוקה – מזון החלמה שיכול להציל חולי פרקינסון – Mucuna pruriens
- דלדול עצם – אוסטאופורוזיס (Osteoporosis) מה אפשר לעשות כדי לחזק את העצמות
- מפגשי עם נער שהחלים מאספרגר להתגבר על אוטיזם – ימי הסנאל שלי
- נתקע לי בגרון, תחושת מחנק, דיספגיה.
- תפליט פריקרדילי הצטברות של מים סביב הלב
- שבטבט וסודות התימינאז
- תנגודת לאינסולין (insulin resistance) מאת ירון מרגולין
- תסמונת קרדיווסקולרית-כלייתית-מטבולית (CKM).
- מזון כתרופה – השמן של לורנצו
- ברומלין או קמח קליפות אננס
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם
- לחץ דם גבוהה מסיבות נפשיות ויתר סטרס בחיי האדם –
- איך לא להגיע לדיאליזה
- זיהום סביבתי מקדם את מחלת הכליות
- הליקובקטר פילורי – Helicobacter pylori חיידק חתרני שנמצא כמעט אך ורק בבני אדם – טיפול
- מחלת כליות – נתנת להחלמה – לשם כך יש לזהות אותה מוקדם ככל האפשר – הקסטסרופה!
- סיבי תזונה
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות
- סמנים ביולוגיים מוקדמים ככל האפשר לנפגעי הכליה בבדיקות דם עבור מחלת כליות חריפה AKI או אי ספיקת כליות CKD יכולה להציל את חייהם של אלפי אנשים.
- הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה.
- האם כדורים נגד לחץ דם הצילו אנשים ממוות?
- אמנות ההחלמה האבודה
- Lecithin לציטין – מזון כתרופה ומולקולה שומנית, שמגינה על המוח, הכבד, הלב, ועל דופן המעי
- שעועית הקטיפה הקסומה – המקונה פרריינס או קִטְנִיּוֹת ההצלה והתשוקה – מזון החלמה שיכול להציל חולי פרקינסון – Mucuna pruriens
- דלדול עצם – אוסטאופורוזיס (Osteoporosis) מה אפשר לעשות כדי לחזק את העצמות ללא תרופות?
- התערבויות בניהול רגשות, מחשבות ואורח חיים כדי להתמודד עם מגיפה של מחלות כליתיות
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- 8 חסרים תזונתיים שכיחים
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להתסיס שיבולת שועל – מתכון וכל הסודות
- שלושת המיצים
- תנגודת לאינסולין וקמח מפרי עץ החרוב
- קמח קליפות בצל ותה קליפות בצל – מתכון
- אבחון מוקדם למחלת הכליות יכול להציל חיי אדם
- פורינים חוץ תאיים ותחזוקת הכליות
- פחד גבהים – מהו פחד גבהים וטיפול
- חומצת שתן נמוכה, או היפואוריצמיה (Hypouricemia)
- התערבויות בניהול רגשות, מחשבות ואורח חיים כדי להתמודד עם מגיפה של מחלות כליתיות
- פחות מתים – טכניקת דיאליזה חדשה שבולמת את קצב המתים ומגבירה את ההישרדות בכשל כליות.
- נאטו (פולי סויה מותססים יפניים) מתכון
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- התקף לב / אירוע לבבי בעקבות מחלת כליות – מסלול איתות שמגן על הלב בשם "VEGFA" משתבש בגלל מחלת כליות כרונית.
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- טאורין: חומצה אמינית מסתורית ומסקרנת
- מלטונין הוכח שהורמון השינה נוגד חמצון רב עוצמה ויעיל כתרופה בקרב חולי כליה
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- חרדה
- מעגל המוזר – התפתחות ה"אני" בשנה התשיעית לחייו
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- למה אני לא מצליח להתמיד – והסוכר
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- חזרה לבסיס – עקרונות צירופי המזון
- על ההזנחה
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- מגילת רות האלמנה שיצאה ממרחב הנוחות
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- מזון כתרופה
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- תזונה תאית
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- להתסיס שיבולת שועל – מתכון וכל הסודות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – על השעורה (דגן) ופעולות נוגדות דלקת כולל עיכוב גורם נמק גידול אלפא – Tumor necrosis factor alpha (TNF-α).
- על הנקמה ודמימותיה
- גודש נוזלים בריאות – בקרב חולי כליה
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
- קטואנאלוג ketoanalogue
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- עשרת המזונות הבריאים ביותר לחולי כלייה – שיבולת השועל וה β- גלוקנים חלק – 6.
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- עשרת המזונות הבריאים ביותר לחולי כלייה – קסמי הכוסמת – המטפלת של דפנותה העורקים –
- עשרת המזונות הבריאים ביותר לחולי כלייה – צרור נבטי הברוקולי והסולפורפאן חלק – 5.
- עשרת המזונות הבריאים ביותר לחולי כלייה – קסמי הכוסמת – המטפלת של דפנותה העורקים – 4
- עשרת המזונות הבריאים ביותר לחולי כלייה – תפוח האדמה והבוטיראט. 3.
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- עשרת המזונות הבריאים ביותר לחולי כלייה. 1
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- מחסור בברזל
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- תרגולי נשימות סרעפתיות כדרך לשליטה והרגעת כאבים תוך כדי קידום פוקוס ורוגע
- קמח קליפות בצל ותה קליפות בצל – מתכון
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- צרבת כרונית – רוצה להחלים ללא תרופות?
- מהי תסמונת מטבולית (MetS)?
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- כיווץ שרירים כרוני וטיפול
- מקצועי יצרו דרך לזהות את סרטן הלבלב (PC) וגם את ההתפתחות של סרטן הערמונית באמצעות בדיקת שתן, בדיקה שיכולה לעזור בגילוי מוקדם.
- סוכר פירות – האם פרוקטוז יכול לתרום להתפתחות אלצהיימר?
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- איך להוריד את רמת האינסולין בגוף באופן טבעי ופשוט
- חזרה לבסיס – עקרונות צירופי המזון
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- הדמימה – מה היא דמימה
- אורפאוס – דמימה בניהול קרירה שמשתקפת ככיווץ שרירים בבית החזה ובשורש כף היד
- כואבות לי הידיים נורא – היכולת לנצח, להתגאות או לשמור על מקומך בפסגה משתקפת באמות הידיים שלך
- כאבי אוזניים – מסתוריות האוזניים הכואבות
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- טיפול טבעי בכליות – מה אתם יודעים על קורדיספס מיליטריס
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- גודש נוזלים בריאות – בקרב חולי כליה
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- על ההשפעה האיומה של חלבון מן החי על הכליות
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- שיראטאקי אטריות קונג`אק – מתכונים
- אנמיה – מחסור בברזל, כשל טיפול והיבטים ביולוגיים חשובים של מחסור בברזל ודרכי החלמה חדשות – מחקר חדש






