
דלקרואה הוא דוגמא לצייר גאון. הוא התעקש על המשמעות של הצבע זעם נוכח קווים מתארים וציירים שהשתמשו בקווי מתאר – הקו החיצוני של סרטוט המונח בהיגיון ומתוך מחשבה שיתכן והוא נמצא במציאות, אבל במציאות אין קווי מתאר רק אור וצללים. האמנות שלו ביקשה לראות את הנמצא באמת ולהתבונן בו גם לחוות אותו. הוא היווה השראה גדולה וזכה להערצה מהמשורר הצרפתי הגדול שארל בודלר שכתב כי דלקרואה הוא המאסטר העליון של הביטוי המעורר של תשוקה ושירה בציור. ללא ספק 'עבודתו "'מותו של סרדנאפאלוס Death of Sardanapalus 1827 מוכיחה זאת.
הוא העמיד ציורי היסטוריה דרמטיים למשל הציור המצמרר אותו סיים כשהיה בן 26 "מראות הטבח בכיוס" (Scènes des massacres de Scio), שעסק במלחמת העצמאות היוונית, או "החירות מובילה את העם" (La liberté guidant le peuple). הציור שמתאר את מהפכת יולי 1830. הוא העלה סצנות מחיי אנשי המזרח, ציורי חיות וגם מעט פורטרטים מרהיבי עין בעלי ביטוי רגשי חזק.
למעלה פורטרט רב עוצמה של הסופרת הצרפתיה ג'ורג' סאנד (הייתה מראשונה הופמיניסטיות) שמה של סאנד נקשר ליחסים רומנטיים עם הסופר אלפרד דה מיסה ועם המלחינים פרנץ ליסט ופרדריק שופן. הציור לא גמור, אבל ללא ספק ניכרת בו חושניות עזה וכבוד עצמי של הגברת מדובר בתפיסה רומנטית. גופה של ג'ורג' סאנד בולט בנוכחות זוהרת שפורצת מהרקע האפל והבלתי מוגדר כשהיא עצמה מתבוננת פנימה אל תוך עצמה, אך הכוח המיני פורץ החוצה אל קדמת הבמה. לאחר שסבל מכאבי גרון, והוא בן שישים וחמש נפטר דלקרואה (1863) ממחלת השחפת.
אנשים שנחשפו בילדותם לביקורת רבה מדי סובלים לרוב מתסמינים מיוחדים שמאפיינים אנשים שאנשים שספגו אלימות והם מפתחים לרוב תכונות אישיות מסוימות שחלקן מדהימות
הדי העבר מבצבים ועולים במהלך החיים, חלקם בקול רם יותר מאחרים. יש והילדות נמשכת לאורך סדרה של מילים קשות וביקורת בלתי פוסקת, שהרי "שום דבר איננו מספיק טוב"… מצד גורמים שונים וההשפעה של ביקורת מתמדת במהלך הילדות דומה בהשפעותיה השליליות לאלימות פיזית [מקור]. מה שפחות ידוע בציבור הוא שחוויות שליליות כמו חשיפה לאלימות מילולית עלולות להוביל לשינויים פיזיים נסתרים בגוף הילד [מקור1, מקור2], שינויים שעלולים להשפיע לרעה על הבריאות לכל החיים נושא שידובר בו בהמשך המאמר [מקור1, מקור2]. תופעה כזו לאורך זמן משתרשת ויכולה בהחלט להיות מעין עמוד שדרה עליו נשענת הנפש השורדת. עמוד שדרה כזה יכול להרחיק לכת, ולעצב את האדם ולכוון את חייו גם בכיוון חיובי שנראה למתבונן מבחוץ כגאונות [מקור].
תוצאה בלתי נמנעת של ביקורת חוזרת ונשנית בילדות מתפרשת כאלימות בנפשם של ילדים [מקור1, מקור2]. אנשים שספגו ביקורת מתמשכת רבה מדי בילדותם נעים במשא הישרדותם בחיפוש אחר משענת יציבה, בטוחה והעיקר שאינה מאכזבת או מבקרת אותם – האמת. התפתחות של כישורי חיים יוצאי דופן מתחילה בניסיון לדלות אמת בכל תחום שראשיתו קריאה והאזנה לדברי חוכמה ולאנשים בעלי ידע רב. מנגד בולט השקר, היתפסות לפרטים לא רלוונטיים שמעלים את הסעיף ומאבדים את שוויון הנפש או את יכולת הדיבור.
נושא זה יכול להוביל להערכה עצמית נמוכה. ילדים כאלה יכולים לאבד שליטה, לעתים עולה צורך עז להלשין, להטיח אשמה בזולת. והאשמה הזאת בהחלט אשמה בדוקה, וגם אם אינה במקומה נחשפת עד מהרה כחומר חברתי רעיל שהופך מלשינים, בכל חברה ואפילו בתא המשפחה, לדמות בלתי רצויה וההמשך קשה יותר כשילדים כאלה עלולים לפקפק בערכם שלהם, ופותחים בתהליך של נידוי עצמו ומתבודדים כנזירים. רק האמת ופיתוח יכולות להגיע ולחשוף אותה נשארת להם ומשמשת להם משענת. גם הגעה לאמת דורשת חברת אנשים – העולם של ילדים כאלה, שבצורך שלהם להציל עצמם מכאב, מתפתחים לעמדה של הגאונים והוא בהחלט יכול מעתה רק להסתבך.
האמת לא נתנת לפשרות ובמקרה שלפנינו היא מאפשאת להם לראות את עצמם בצורה חיובית ולהתגבר על הביקורת המכאיבה, לה הם זוכים מרגע ילדותם.
1. כיווצי שרירים כרוניים
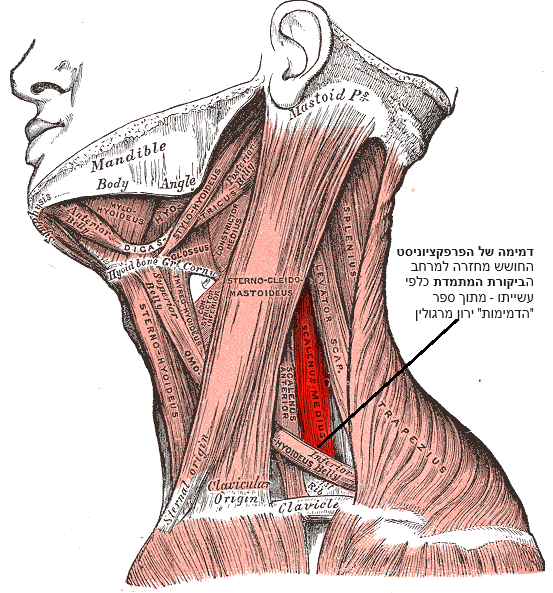
כאשר האמת דוחפת קדימה נושא שעלול להתקבע כדמימה, חלק משרירי גופם מתחילים להתכווץ בכיווץ שרירים כרוניים נושא שעלול להוות מקור לכאב והגבלת תנועה. הדמימה של הסובלים מכישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם – מופיעה אצל הבוגר בדרך כלל בשריר המעלות הקידמי שבצוואר הקדמי – בצד ימין Scalenus anterior, כמו כן יש והיא מופיעה גם או בחלקו התחתון של שריר החזה הגדול Pectoralis major– סמוך לתחל של הראש החזי (Sternal head) כסנטימטר מסחוסי הצלעות 6-7, כנראה באיור למטה.
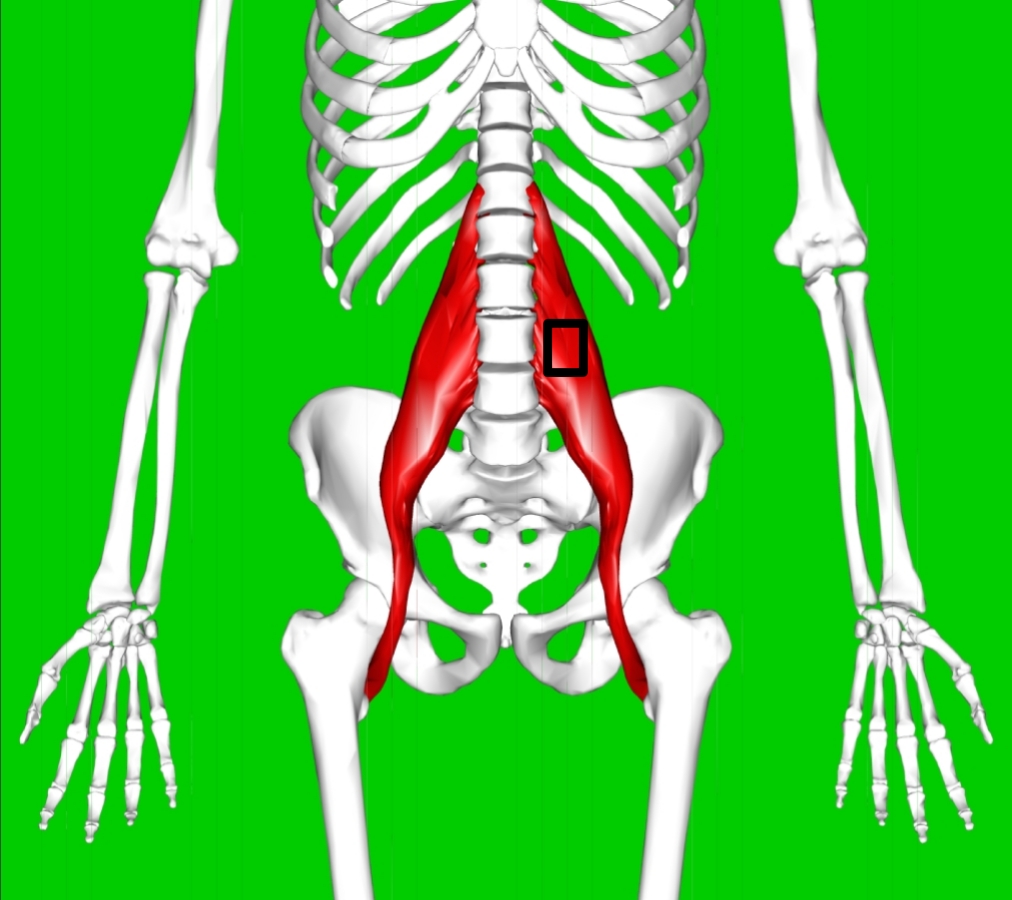
זו דמימת הפרפקציוניסט או החושש לחזור אל חוויות הביקורת הבלתי פוסקת. הדמימה הזו נובעת מצורך עמוק להגיע למרחב ה"בסדר" ויכולה להופיע גם או בשריר המותן הגדול – בחלקו העליון של שריר המותן הגדול Psoas major, שנראה באיור למעלה.
בשריר רחב הגב Latissimus dorsi (הימני) – סמוך לקרן התחתונה של השכמה הימנית (נמצאת דמימה שנקשרת בסקרנות ובשאיפה לדעת) הדמימה הזו יכולה לעורר כאב עז ביד ימין ולחבל בתנועת הזרוע כלפי מעלה ולאחור.
בזרועות הידיים בעיקר בימנית במרכז השריר הדו-ראשי של הזרוע הימנית Biceps brachii והגב העליון) ברך שמאל פנימית ב Musculus sartorius שריר החייטים sartorius סמוך לאחז שמתחת לגבלית התיכונה 4 הראשים. וכן פגיעה בתפקודן של המיטוכונדריה (טלו קו אנזים Q10 במינון גבוה) בנוסף לאלה נמצאו לחץ דם גבוה מסיבות פסיכולוגיות – נושא עליו פרסמתי – כאן (תגובות דלקתיות, שחיקת טלומרים, מתילציה אפיגנטית וביטוי שלילי של גנים [מקור1, מקור2, מקור3, מקור4, מקור5]). הדמימה שולטת ומוביל את חייהם כמי שמשוכנעים שחיפוש הצדק והאמת הם חלק מאישיותם האמיתית. בפועל מתפתח אדם סקרן מאוד, מדוייק מאוד, מעמיק בחקר הדברים אלה אנשים גברים ונשים גם נערים ונערות ש
לא יעצרו מרגע שפגשו באמת ועד שהאמת או השקר יחשפו במלואם וזאת גם ואם המחיר האישי יהיה גבוהה.
נראה שכוח האמת מושיע עד כדי כך במקרה שלהם עד כי מחיר אישי לא מעניין אותם כלל וכלל. נושא המחיר אמנם אינו מדוייק. הוא עולה בתוכם כאפשרות לדיון בינם לבין עצמם, אך לא עד לרמה של קונפליקט. באופן כללי אין למחיר הזה, כאמור לעיל, השפעה ממשית על נחישותם לספק את סקרנותם ולחשוף את האמת.
2. מנגד דמימה זו פוגעת ב"סטארטר". מנגנון ההתלהבות שמתחיל את פעולת העשייה מתקלקל ובא לידי ביטוי בחיי ילדים כאלה משבגרו. נראה שהדי הביקורת שחוו בתחילת דרכם על בסיס יומיומי, מבצבים, עולים ממעמקי נפשם ונועצים ב"סטארטר" של נפשם את צפרניהם. נעיצה מלאה כאב שמשתקת ומעכבת כל יוזמה אישית ומקצועית למעט חיפוש אחר האמת. ילדים כאלה משבגרו מהססים לרוב לקחת על עצמם אתגרים חדשים.
הם נוטים להערים ספק פנימי על יכולתם נראה שהביטחון העצמי שלהם ביכולתם לעמוד בעוד משימה נמוך ותוקע אותם במקום, אבל האמת מורכבת יותר.
הם לוקחים כל משימה כמסע הישרדות וכמלחמת קיום כך שעוד מטלה יכולה, מבחינתם, לגזול את שארית כוחם. הם לא חשים אי אמון ביכולתם להתקדם בעשייה חדשה, אבל הם משוכנעים שהם עלולים לקרוס בה וכשנחשף שהמיטוכונדריה בתאי האברים החשובים בגופם (לב, כליות, כבד) נפגעת מסתבר שתחושת הבטן יוצאת הדופן שלהם באמת מדהימה. בפועל הם לעתים קרובות בוחרים ללכת על שמירת כוחות נפשם וללכת על בטוח בבוחרם לא לנסות ולא להסתכן בעמידה באתגר חדש [מקור]. מאמר קצר שפרסמתי על מצבי תקיעות יכול לעזור ולחשוף בפני כמה ממהם סודות חשובים, אחד לאחד, על היציאה ממרחב חוסר היעילות, אל מרחב העשייה, בה מתפתחים כישורי החיים הנדרשים – כאן.
המבקרים החברתיים גם המלשנים של אתמול מהססים לעסוק בהרפתקאות חדשות כולל הרשמה ללימודים מחשש שכוחם לא יעמוד בכך [מקור]. מכל מקום בפועל אנו פוגשים באנשים שנמנעים ליזום, גם בתחום החברתי ובוודאי שבמרחב החיזור. העדר כישורים חברתיים מונע ומעכב את ההתפתחות האישית ומעט כישורים חברתיים לא מספיקים והם נותרים יותר צמודים לבני המשפחה ולמרחב המאיים של הביקורת המתמדת. ככלל חיי החברה נראים להם פעמים רבות, כבזבוז זמן או חסרי עניין – נושא משעמם שבא לאאפשר להם להיתקע במצב שנוצר [מקור].

כמו ברוב המיתוסים מהסוג הזה, קיימות גרסאות מרובות של האירוע. המלך הליקי איובטס (Lycian king Iobates) שולח את בלרופון להרוג את הכימרה, חיה מיתית עם ראש של אריה, גוף של עז וזנב של נחש. למעשה מקווה המלך למותו של בלרופון. בדרכו למצוא את הכימרה, בלרופון פוגש אדם, רואה שמנחה אותו לישון במקדש של אתנה. אתנה מבקרת את בלרופון בחלום ומעניקה לו רסן מוזהב. בעזרת הרסן הזה בלרופון לוכד את פגסוס, ושניהם עפים כדי למצוא את הכימרה. מתחולל קרב. פגסוס עף מסביבה ומשגע אותה. בלרופון אינו מסוגל להתקרב אליה מכיוון שהיא נושפת אש, בעזרת גוש עופרת שהוא מצמיד לקצה החנית שלו בלרופון מתגונן, ומסתער על הכימרה ותוקע את גוש העופרת הזה בגרונה. הנשיפה של הכימרה ממיסה את העופרת שקמה עליה וחונקת אותה למוות. לאחר הקרב, בלרופון ופגסוס חוזרים למלך איובאטס, שמסרב להאמין להם.
3. פרפקציוניסט.
החשש הגובר מהעדר כוח לעמוד במשימה וכישלון נוכח חיצי ביקורת שנשלחים לכאורה אל היוצא לדרך פורצים מקרביו בכל צעד בדרכו ומקים צורך בלתי פוסק
להגיע ליעד מהר ככל האפשר כדי לנוח משהושג. פרפקציוניזם ושאיפה לשלמות נוצר עקב לחץ אדיר להימנע מביקורת.
מופע ה"פרפקציוניזם" כהתנהגות מפעיל מגוייסות בלתי פוסקת וההתמודדות עם כישלון אפשרי. האדם נמהר, יוצא למשימה מיד ולא מניח לה עד שמצליח לעמוד בה. הטיפול במצב זה בעזרת ביקורת נפוץ, הרסני ומשיג את ההפך. הצורך להוכיח יכולת ל"מושלמות" הופך נטל ואמצעי התשה בלתי רגיל. עבור הפרפקציוניסט הוא מלווה בהתמכרות להשגת מטרות והוכחה בלתי פוסקת שהוא בסדר כי "שום דבר איננו מספיק טוב" יכול לקבל מענה רק בפעולה במציאות. מדובר בכוח אדיר וניסיון נואש להימנע מכל צורה של להיות לא בסדר, להיות מעורב במחדל, נוכח ביקורת עתידית לדרכי פעולתו או מחשבתו מה שיוצא מכך לבד מבדידות חברתית, וסטרס, יתר קורטיזול, בעיות תזונתיות ואדם שמגיע ליכולות על אנושיות והישגים יוצאי דופן. פרפקציוניזם יכול להביא לא רק חוֹסֶר אִזוּן בחיים האישיים ובמרחב הקריירה גם לכאורה לכבוד. אלא שהישגיו האדירים ויוצאי הדופן, בדרך כלל לא זוכים לכבוד המיוחל, נושא בו ידובר בסעיף הבא: ריחוק ממחמאות והכרה לצד לחץ מתמיד ובהמשך, רגשי אשמה ותחושה שהאני לא בסדר [מקור] יתר קורטיזול [מקור] שמוביל לסוכרת, יתר לחץ דם ואי ספיקת כליות [מקור], מעורבות בהורות נעדרת ולחיצת שיניים מתמדת בזמן מנוחה או ריכוז במשימה שמוביל לקשיי בליעה בגיל המבוגר ותחושת מחנק [מקור], נושא עליו פרסמתי – כאן. לחץ דם גבוהה מסיבות נפשיות ויתר סטרס בחיי האדם –כאן, כאן וכאן יתר לחץ דם – כאן, ביקורת עצמית בלתי פוסקת [מקור], וחרדה קיומית [מקור], דמנציה ואי ספיקת כליות [מקור].
למאמרי – תחושת מחנק, דיספגיה – נתקע לי בגרון
ביקורת מבזה
4 . דחיית מחמאות – שבחים מנופחים משפילים או מסיתים את האדם מקו המטרה אל עצמו. דברי כבוד מוציאים את האדם ממסלול מחשבתו ומפעילותו להשגת המטרה. מחמאה יכולה לגרום לדאגת יתר לגבי ה"מה אנשים אחרים חושבים עליו" לעתים רחוקות אדם רב השראה משתוקק להכרה, להתרגש ממחמאה אבל המחמאות לא חודרות ללב משום שאינה מגיעה בזמן הנכון, ונתפסת שם כשבחים מנופחים והפרעה לעבודתו או מחשבתו [מקור].
כשמישהו אומר לילד שנחשף לביקורת ממושכת בתחילת חייו משהו נחמד, הוא עלול למצוא מיד דרך להסיט אותה הצידה – לעתים קרובות הוא מסלק מחמאה עם ביקורת עצמית (הפתעה) [מקור]. כך אם אוהבים את החולצה החדשה, למשל, יסלק בהגד שזה לא הצבע שבאמת רצה לקנות אבל זה פשוט מה שהיה בחנות במידה שלו. בדרך זו או אחרת, אדם שמחפש את האמת מנטרל כל הגד חיובי שמופנה כלפיו, כי הוא עצמו נתון ומגוייס למטרה אחרת. הנושא מסתבך כאשר חברים ובני משפחה מביעים את אהבתם, עמוק בפנים בוגר כזה פשוט לא מאמין להם וחושד פעמים רבות, שהוא בפועל משעמם אותם ואולי שהוא נמאס עליהם [מקור]. הנושא מסתבך עוד יותר אם מסרים מעורבים ולא יציבים כמו אם מתבצעת עשיה רצויה, בעיקר כמו סיוע להשגת מטרה. מסר כזה רב משמעות בעיני "דוחה המחמאות" זו חביבות ממיסה שיכולה לעודד את קו העשייה ולהעצים את ההשראה, אף לעורר אהבה ממש כלפי שותף בעבודה, וברגע אחד כמו פגיעת ברק מילה יכולה להסיט מקו המטרה, להאט את מהלכה של החשיבה (של מקבל המחמאה) ולאיים עליו ולהישמע קשה מאוד בקרבו של אדם שספג ביקורת מתמשכת רבה מדי בילדותו והדברים יכולים להגיע לידי כך שיביא את עצמו לשפל, אבדן ביטחון עצמי, חרדה [מקור] ולהסתלק משם [מקור1, מקור2, מקור3, מקור4, מקור5, מקור6, מקור7].
5. מביך עצמו חברתית נוכח הכרה בהישגיו.
אנשים שחווים בושה כרוכים בתחושה שיש בהם פגם יסודי [מקור]. בעוד שבושה קשורה ב"אני לא בסדר" יש והיא עולה מתי שה"אני החברתי" של האדם מאוים, בגלל אובדן מעמד או קשרים חברתיים והוא מבקש להנכיח איום זה כדבר שיש בו הצדקה. המבקר הפנימי עשוי לקום עליו, ולומר לו בפשטות: "אתה אדם רע, חסר ערך, או שאין לך שום ערך". האמת היא, שעד כמה עמוק תגיע הרגשת הבושה, לעתים קרובות אין לה הרבה קשר לכישוריו, יכולותיו או ערכו וכל הישיגיו או מה שעשה ברגיל רוב העשייה מעל ומעבר, בוודאות שהיא בסדר.
מושגים נפוצים שחופפים לבושה כוללים מבוכה, השפלה עצמית ותחושת אשמה. כתוצאה מהד הביקורת הממושכת ויחס חיובי של אחרים, שנמצא כניגוד מוחלט אליה [מקור]. ניגוד כזה יוצר לעתים מאבק פנימי שקורע בכאב את הנשמה. השפלת עצמו מאחד אותה מחדש.
בוגר שסבל מביקורת מתמדת בילדותו מסוגל להביך את עצמו בחברה, בעבודה, ולעשות משהו שמשפיל את עצמו במרחב הציבורי, והדברים מוזרים עד כדי כך שהוא עצמו לא מבין מהיכן כל זה צץ – כאב הילדות שאוחז בו כה גדול ומאיים שהצורך ב"חיבור מחדש" מנצח. הפעולה של האיחוד באמצעות השפלה עצמית, לא רק שיכולה להיראות מביכה ולעורר שיחות היא לא מפסיקה לעורר שיח פנימי ביקורתי לאורך כל חייו, כך הד העבר ממשיך ולא גווע [מקור.
פעולת הבכה שכזו יכולה למחוק את ההישגים האדירים שהאדם הגיע אליהם, מבחינת הוא עצמו, במקרה שזכה להכרה
[מקור]. בהמשך הדבר פוגע עוד יותר בחוסן העצמי והתחושה הכללית שאין לו על מי לסמוך, לא מבחוץ, ולא מבפנים . תחושה שמעודדת חרדה מצד אחד [מקור], חיפוש אחר האמת מצד שתיים [מקור] ובדידות נושא עליו פרסמתי – כאן.
5. אמפתיה ונתינת יתר
נדיבות יכולה לשפר את ההערכה העצמית של ה"אני" הרמוס ומהווה אינדיקטור חשוב למערכת יחסים מתמשכת. אנשים שספגו ביקורת תכופה בילדותם מפתחים לעתים קרובות תחושת אמפתיה מוגברת וחווים נתינת יתר. נתינה שהיא חסרת גבולות ונושקת ל"בורדר ליין".
האמפתיה קשורה בדרך כלל במערכת היחסים עם האם [מקור], אבל ישנם מקרים חריגים בהם
האמפתיה שולטת בחיי הרגשות והאדם מתמסר לקליטת סבלי הזולת.
מדובר ביותר מפיתוח יכולת להבין ולהשתתף ברגשותיהם של אחרים. אדם שסבל מביקורת מתמשכת בילדותו נשאב לכאב הזולת, ולוקח על עצמו משימת על להנמיך את הכאב הזה שם, גם אם מדובר בכאבם של בעלי חיים, נהרות או עצים, וכמובן כאבם של ילדים ובני-אדם [מקור]. כמי שלא ינוח עד שהמטרה תושג, כך גם כאן. הדבר עולה ומעורר התגייסות גדולה מצידו כשהוא מנסה לפעול במהירות שהסובל עצמו מתקשה לקבל ולהבין אותה [מקור]. הוא חש את הסכנה לבריאותם של הסובלים ונאבק למענם, עד כדי כך שהכל מתערבב ומקשה על חייו הוא. מדובר בהבנה אינטואיטיבית של הסכנה האפשרית שעומדת לפני אנשים זרים, שסובלים, או בחשש מוצדק למה שמישהו מהם לא הם עצמם עלול לעבור, כאשר מדובר בבעל יכולת ריפוי שפוגש מחלה או על רגישות יתר להגשמת הרצון של הזולת כמו במצבים בהם אי אפשרות לגייס אמצעים להשלים את המשימה, למשל של אמן גדול, כל כולו שם לסייע וכאמור הכל יכול להערם ולהסתבך. הוא זוחל מותש מתחנן להושיע, לא מרפה, עד שכמעט נצלב. יש ומתפתחות בו יכולות נדירות שעומדות בהמשך לטובת החברה. נושא שזכה לכותרת "נתינת יתר מתוגמלת באלימות".
למאמרי – מגיע לי – העדר הכרה במאמץ של השועט קדימה, יכולה להרוס אותך
אפיגנטיקה ומזון כתרופה ביולוגית להחלמה ממחלות גנטיות

6 – העדר ביטוי רגשי
הבעת רגשות משפיעה על הבריאות שלנו [מקור1, מקור2]. אבל, הבעת רגשות לילדים קשה מאשר לילדות. כאשר לילד או ילדה שחיו בסביבה ביקורתית היא אפילו לפעמים די מסוכנת ונתפסת כהפגנת חולשה [מקור]. ידוע שילד שמתלונן על עוולות שנעשו לו יכול להיחשף לנזיפה מהוריו, פשוט לא יאמינו לו. אב, כזה יכול להשיב "תכה אותם בחזרה", במקרה הטוב, במקרה הרע יצליף בו. למבוגרים שנאבקים להביע את רגשותיהם יש דבר אחד במשותף; כילדים, הם למדו שזה לא בטוח להמשיג את רגשותיהם [מקור].
רוב המבוגרים לא באמת הכשירו השתקה רגשית, הורים אולי לימדו כמחאה נגד מודל של הדורות שלפניהם ש"טוב להמשיג ולבטא רגשות", אבל הביקורת הכללית והגדים מניפולטיביים כגון: "זה לא כל כך נורא" או "אתה תהיה בסדר" ורע מכך "במה נכשלת?" הכריע אותם. כך, ילד לומד לא לבטא את הצרכים הרגשיים שלו כאשר רגשותיו בפועל בוטלו לעתים קרובות. יותר מכך אם חבורת הילדים הקניטו אותו או לעגו לו על שנפלט לו ביטוי רגשי [מקור].
הרגש הנפוץ הוא עליזות וכעס. יוצא מכך שילדים רבים חווים שהם צריכים להיות עליזים, שמחים או מאושר כל הזמן. פרפקציוניזם רגשי הוא מטרה שקל להיכשל בה. בלתי אפשרי לשלוט ברגשות, לכן, לעתים קרובות אדם שהמטרה קדושה בעיניו, פשוט מסווה את כל הרגשות שלו. המאמץ הזה אדיר, אבל לא להיראות חלש או פתטי מכבד אותו בניצחון שקל לו להזדהות איתו [מקור].
ביקורת מבזה
עד כמה שהילד הזה סבל בתחילת דרכו מביקורת מבזה וממושכת הוא עצמו אינו יכול להסתלק ממנה ועד כמה שהסבל מציף אותו, כשהביקורת תוקפת וכשהיא מתקרבת אליו ויורה בו את חיציה, או כשהוא עצמו נוכח מה שאיננו מספיק טוב אין אדם שיותר קשה לו להימנע ממנה בעצמו והילד הזה כשבגר נעשה הרסני, ביקורתי וזועם [מקור]. חקר האמת קורס, הראיה למעמקים נדחקת, הראיה המרחבית, עליה אנשים כאלו עמלו כל חייהם, נרמסת והמנגנון הילדותי של "מטרה" מטרת על ולהוכיח את האמת קם ומוצא באופן אוטומטי את דרכו לראות פגמים באנשים אחרים, דעות קדומות, גזענות, זעם נוכח האחר הכל מתערבל ועולה גם הביקורת העצמית קמה ופורצת ומשתקפת בעמדות השוללות את העשיה, אופן המחשבה, וגם את אורחות חייהם של אחרים – נושא זה מביא להרחקת חברים ושותפים למשימה ולבדידות. נושא שמככב במרחבי עשיה, אמנות, מדע והניכור החברתי קורע, הבדידות מתרחבת ולוחצת מכל הצדדים [מקור].
חשוב להכיר בכּוֹשֵׁר הִתאוֹשְׁשׁוּת מדהים שאנשים כאלה מתפתחים לעתים קרובות. בהבדל מהחשש מהכרה ומחמאה, הרס המשימה מניעה אותם קדימה בעוצמה, שהיא בלתי נתפסת ונראית מבחוץ כפיתוחם של מנועי צמיחה אישית ודהירה אחר הצלחה מול מכשולי החיים הבוגרים כעוצמה פנימית בלתי מעורערת ונערצת.
נשארו לך שאלות
אשמח להשיב על כל שאלה
לטופס פנייה ישירה אל ירון מרגולין – נא להקליק – כאן
בבקשה לא להתקשר משום שזה פשוט לא מאפשר לי לעבוד – אנא השתמשו באמצעים שלפניכם –
למען הסר ספק, חובת התייעצות עם רופא (המכיר לפרטים את מצבו הבריאותי הכללי של כל מטופל או שלך) לפני שימוש בכל תכשיר, מאכל, תמצית או ביצוע כל תרגיל. ירון מרגולין הוא רקדן ומבית המחול שלו בירושלים פרצה התורה כאשר נחשפה שיטת המחול שלו כבעלת יכולת מדהימה, באמצע שנות ה – 80 לרפא סרטן. המידע באתר של ירון מרגולין או באתר "לחיצות ההחלמה" (בפיסבוק או MARGOLINMETHOD.COM ), במאמר הנ"ל ובמאמרים של ירון מרגולין הם חומר למחשבה – פילוסופיה לא המלצה ולא הנחייה לציבור להשתמש או לחדול מלהשתמש בתרופות – אין במידע באתר זה או בכל אחד מהמאמרים תחליף להיוועצות עם מומחה מוכר המכיר לפרטים את מצבו הבריאותי הכללי שלך ושל משפחתך. מומלץ תמיד להתייעץ עם רופא מוסמך או רוקח בכל הנוגע בכאב, הרגשה רעה או למטרות ואופן השימוש, במזונות, משחות, תמציות ואפילו בתרגילים, או בתכשירים אחרים שנזכרים כאן.
For the avoidance of doubt, consult a physician (who knows in detail the general health of each patient or yours) before using any medicine, food, extract or any exercise. The information on Yaron Margolin's website or the "Healing Presses" website (on Facebook or MARGOLINMETHOD.COM), in the above article and in Yaron Margolin's articles are material for thought – philosophy neither recommendation nor public guidance to use or cease to use drugs – no information on this site or anyone You should always consult with a qualified physician or pharmacist regarding pain, bad feeling, or goals and how to use foods, ointments, extracts and even exercises, or other remedies that are mentioned as such
מאמרים אחרונים
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- כישורי חיים יוצאי דופן בקרב ילדים שספגו ביקורת רבה מדי בילדותם
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- התקף לב / אירוע לבבי בעקבות מחלת כליות – מסלול איתות שמגן על הלב בשם "VEGFA" משתבש בגלל מחלת כליות כרונית.
- מלטונין הוכח שהורמון השינה נוגד חמצון רב עוצמה ויעיל כתרופה בקרב חולי כליה
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- תעוקת חזה מיקרו-וסקולרית
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- תחושת מחנק, דיספגיה – נתקע לי בגרון.
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- 8 חסרים תזונתיים שכיחים
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- תוסף מזון על האסטקסנטין astaxanthin
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין A?
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- דיוקסינים במזון
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- רוצה להחלים מאי ספיקת כליות – יש להגיע לטיפול מחלים כליות מהר ככל האפשר
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- צרבת כרונית – רוצה להחלים ללא תרופות?
- מהי תסמונת מטבולית (MetS)?
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- ממצאים חדשניים למקור הגאוט
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- צרבת כרונית – רוצה להחלים ללא תרופות?
- יתר שומנים בדם היפרליפידמיה – חשש לצורך בצנתור
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ’יינג’
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- התרופות והרע – לחץ דם
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מזון למוח – המזון הבריא למוח תומך בגמישות מערכת העצבים שלו וביכולת הלמידה, שומר על הזכרון, ומונע מחלות כגון אלצהיימר.
- מרחבי חיים מאריכי חיים – האזורי הכחולים
- קשר הגלוטן – אלרגיה לגלוטן והאם הימנעות מגלוטן מוצדקת?
- מהן עיניים אדומות?
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- הדמימה – מה היא דמימה
- אורפאוס – דמימה בניהול קרירה שמשתקפת ככיווץ שרירים בבית החזה ובשורש כף היד
- כואבות לי הידיים נורא – היכולת לנצח, להתגאות או לשמור על מקומך בפסגה משתקפת באמות הידיים שלך
- כאבי אוזניים – מסתוריות האוזניים הכואבות
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- טיפול טבעי בכליות – מה אתם יודעים על קורדיספס מיליטריס
- מהי תסמונת מטבולית (MetS)?
- גלוטתיון כל האמת
- כיווץ שרירים כרוני וטיפול
- מקצועי יצרו דרך לזהות את סרטן הלבלב (PC) וגם את ההתפתחות של סרטן הערמונית באמצעות בדיקת שתן, בדיקה שיכולה לעזור בגילוי מוקדם.
- סוכר פירות – האם פרוקטוז יכול לתרום להתפתחות אלצהיימר?
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- איך להוריד את רמת האינסולין בגוף באופן טבעי ופשוט
- חזרה לבסיס – עקרונות צירופי המזון
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- גודש נוזלים בריאות – בקרב חולי כליה
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- על ההשפעה האיומה של חלבון מן החי על הכליות
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- ריפוי פצעים וצמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית לצורך תרומה או טיפול
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מרק גרין קארי – מתכון
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- התה הטחון – מאצ'ה Matcha מתכונים
- – אורז מותסס בבית מתכון
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- אגוז מרפא ביבהיטקי
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- על ההשפעה האיומה של חלבון מן החי על הכליות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- התרופות והרע – ומי הורס לך את ה-Q10
- מחסור בויטמין בי-1 מייצר סיוטי לילה וחלומות זוועה B1
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הפאסטיון המאהב של אלכסנדר הגדול Hphaestion
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- חרדה
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- למה אני לא מצליח להתמיד – והסוכר
- ניתוק רגשי – על הקורוציונה
- נמאס לי מהחיים מה עושים
- התודעה השלילית
- מגיע לי – העדר הכרה במאמץ של השועט קדימה, יכולה להרוס אותך
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- דיוקסינים במזון
- אכל נקי
- הקורטיזול וכאבים בבית החזה וביד שמאל
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- התרופות והרע – ויטמין D3
- התרופות הטובות והרע – אבץ
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- תזונה תאית
- אף סתום או גודש באף – תוסיפו מלח
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- איך להיראות צעיר מגילך – כל הסודות
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- תוסף מזון על האסטקסנטין astaxanthin
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- קריאת הגוף – מה אומרות פניך
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- מחסור בברזל
- מהו אימון שלפוחית השתן?
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- חלבון בשלב אקוטי
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- גלוטתיון Glutathione ו-N-אצטיל-ציסטאין (NAC)
- תסמונת היד הסוכרתית – רמות גבוהות של A1c קשורות להתפתחות של נפיחות באצבעות היד שגורמת כאב ומכונה תסמונת התעלה הקרפלית (גם תסמונת מנהרת שורש כף היד).
- אריתרופויטין (EPO) Erythropoietin
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- סודה של דיאטה מצליחה תמיד
- סבל מהרגלים רעים – רוצה להתפתח? !
- תוספי סידן – זהירות – סיכון לשבץ מוחי
- למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה.
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- (תירואיד)
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- קרום התא – הממברנה והדלקת הכרונית
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מפרקינסון
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- שחיקת סחוס, למה לסבול? – ללא ניתוח ללא תרופות – טיפול להחלמה
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מיתר לחץ דם?
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- טריגר – הסיוט שאינו נגמר
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- תעוקת חזה מיקרו-וסקולרית
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- ירידה בתפקוד הכליות
- פיטר דה הוך – גאון ומוביל דרך
- מזרקת האריות – מורוסיני Morosini Lions Fountain – Eleftheriou Venizelou Square
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- מבנה (אנטומיה) של מערכת הסינון של הדם בכליות ויצירת השתן, ודרכים חדשות להחלמת מפגעיה
- 8 חסרים תזונתיים שכיחים
- מלטונין הוכח שהורמון השינה נוגד חמצון רב עוצמה ויעיל כתרופה בקרב חולי כליה
- מיטוכונדריה – במיטוכונדריון מתחילה מחלת הכליות
- התקף לב / אירוע לבבי בעקבות מחלת כליות – מסלול איתות שמגן על הלב בשם "VEGFA" משתבש בגלל מחלת כליות כרונית.
- אבחון מוקדם של תפקוד הכליות מאפשר אריכות חיים.
- סמנים ביולוגיים (Novel Biomarkers) ובדיקת כליות מוקדמת ככל האפשר – מצילה חיים
- תעוקת חזה מיקרו-וסקולרית
- חומוס מזין, מרגיע ונוגד חרדות – מתכונים
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- 8 חסרים תזונתיים שכיחים
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- תוסף מזון על האסטקסנטין astaxanthin
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין A?
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- דיוקסינים במזון
- למה חולים שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- רוצה להחלים מאי ספיקת כליות – יש להגיע לטיפול מחלים כליות מהר ככל האפשר
- הצלבת איברים – הדרך להחלמה ממחלת כליות קשה מאוד
- רוצה להחלים ללא תרופות ממחלת מחלת כליות נפרופתיה אימונוגלובולין איי?
- ממצאים חדשניים למקור הגאוט
- צרבת כרונית – רוצה להחלים ללא תרופות?
- מהי תסמונת מטבולית (MetS)?
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- ממצאים חדשניים למקור הגאוט
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- צרבת כרונית – רוצה להחלים ללא תרופות?
- יתר שומנים בדם היפרליפידמיה – חשש לצורך בצנתור
- סיבו Sibo צמיחת יתר של חיידקי המעי הדק
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תובנות חדשות אי-ספיקת כליות תלויה במצבו של ציר FGF23-Klotho
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ’יינג’
- מחלת כליות פוליציסטית אוטוזומלית דומיננטית (ADPKD)
- רככת היפופוספטמית (זרחן נמוך מהנורמה) – מחלת כליות כרונית – או הפרעת עצם מינרלית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- התרופות והרע – לחץ דם
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- מזון למוח – המזון הבריא למוח תומך בגמישות מערכת העצבים שלו וביכולת הלמידה, שומר על הזכרון, ומונע מחלות כגון אלצהיימר.
- מרחבי חיים מאריכי חיים – האזורי הכחולים
- קשר הגלוטן – אלרגיה לגלוטן והאם הימנעות מגלוטן מוצדקת?
- מהן עיניים אדומות?
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- זרחן – Phosphorous, והאם מוכרחים להתחיל בדיאליזה טרם נבחנה רמתו של גורם צמיחה פיברובלסט 23
- קרום התא – הממברנה והדלקת הכרונית
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- הדמימה – מה היא דמימה
- אורפאוס – דמימה בניהול קרירה שמשתקפת ככיווץ שרירים בבית החזה ובשורש כף היד
- כואבות לי הידיים נורא – היכולת לנצח, להתגאות או לשמור על מקומך בפסגה משתקפת באמות הידיים שלך
- כאבי אוזניים – מסתוריות האוזניים הכואבות
- גלוטמין (Gln) -המגן הגדול על בריאות האדם – כל מה שחשוב לדעת
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- טיפול טבעי בכליות – מה אתם יודעים על קורדיספס מיליטריס
- מהי תסמונת מטבולית (MetS)?
- גלוטתיון כל האמת
- כיווץ שרירים כרוני וטיפול
- מקצועי יצרו דרך לזהות את סרטן הלבלב (PC) וגם את ההתפתחות של סרטן הערמונית באמצעות בדיקת שתן, בדיקה שיכולה לעזור בגילוי מוקדם.
- סוכר פירות – האם פרוקטוז יכול לתרום להתפתחות אלצהיימר?
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- איך להוריד את רמת האינסולין בגוף באופן טבעי ופשוט
- חזרה לבסיס – עקרונות צירופי המזון
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- גודש נוזלים בריאות – בקרב חולי כליה
- רעלים אורמיים מקדמים דיאליזה – הוכח לאחרונה שרעלנים אורמיים קשורים למיקרוביוטה של המעי הגס – איך להחלים ללא תרופות ולהימנע מדיאליזה.
- על ההשפעה האיומה של חלבון מן החי על הכליות
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- אבנים בכליות – אוקסלטים, היפרוקסלוריה ויתר חומצה אוקסלית – רוצה להחלים ללא תרופות?
- זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- ריפוי פצעים וצמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית לצורך תרומה או טיפול
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מרק גרין קארי – מתכון
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- Tsamba שתי כוסות גרגרי שעורה דגנים מלאים, רצוי אורגניים – מתכון צ'מפה למבקשים להחלים מאי ספיקת כליות
- התה הטחון – מאצ'ה Matcha מתכונים
- – אורז מותסס בבית מתכון
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- אגוז מרפא ביבהיטקי
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- על ההשפעה האיומה של חלבון מן החי על הכליות
- למה מדידת הויטמין B12, רחוקה מלהיות מדויקת?
- ירקות ירוקי עלים לרוב טובים לבריאותנו, לפעמים הם לא – רוצה לדעת מתי כדאי לצרוך עלים ירוקים?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- התרופות והרע – ומי הורס לך את ה-Q10
- מחסור בויטמין בי-1 מייצר סיוטי לילה וחלומות זוועה B1
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הפאסטיון המאהב של אלכסנדר הגדול Hphaestion
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- חרדה, סטרס, מצב רוח שלילי ותרופות פסיכיאטריות שלא עוזרות בכלל.
- חרדה
- איך מורידים לחץ וחרדות באופן טבעי? התמודדות עם סטרס ולחץ נפשי
- טיפול נפשי ללא תרופות – חרדות, פחדים וייאוש – תסמינים שיש להם פתרון טבעי, מדויק ומהיר
- למה אני לא מצליח להתמיד – והסוכר
- ניתוק רגשי – על הקורוציונה
- נמאס לי מהחיים מה עושים
- התודעה השלילית
- מגיע לי – העדר הכרה במאמץ של השועט קדימה, יכולה להרוס אותך
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- דיוקסינים במזון
- אכל נקי
- הקורטיזול וכאבים בבית החזה וביד שמאל
- האם תוסף ויטמין D בולם את מחלת הכליות בקרב סוכרתיים?
- התרופות והרע – ויטמין D3
- התרופות הטובות והרע – אבץ
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- תזונה תאית
- אף סתום או גודש באף – תוסיפו מלח
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- פאראצטמול (PARACETAMOL) גם פרצטמול או אצטאמינופן (Acetaminophen) – הידוע גם בשם אקמול, רוקסט ודקסמול עלול לפגוע בכליות ובכבד ואסור לשימוש לחולי כליה
- מקצבים בעולם החי – שעון ביולוגי בתאי הגוף
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- גמילה מאלכוהול – תהליך קשה, תסמינים איומים
- איך להיראות צעיר מגילך – כל הסודות
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- הגל החדש של בדיקות דם בהחלט רוצה לייעל את הביצועים הספורטיביים שלך, לשפר את הרווחה הכללית ולהרחיב או להאריך את תוחלת החיים גם לסייע להחלמתך ללא תרופות ממחלות כרוניות
- מדללי דם טבעיים – חומרים אנטי-תרומבוטיים: נאטוקינאז, ויטמין E, פלפל קאיין, כורכום, קינמון, וספורט מאפשרים טיפול בנוזלי הדם ללא תרופות.
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- תוסף מזון על האסטקסנטין astaxanthin
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- קריאת הגוף – מה אומרות פניך
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- טיפול בכאב עם אופיואידים גורר אותך לצרות צרורות למשל עצירות איומה. מה לעשות?
- גאוט הוא לא רק יתר פורין – החיים עם גאוט תלוי גיל ומין – האם אפשר לנצח גאוט בלי לבלוע הורמוני מין?
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- הומוציסטאין, ויטמינים ומניעת מחלות כלי דם
- חומצה אלפא לינולנית משפרת את תוחלת החיים – צריכה גבוהה של חומצות שומן מצמחים נחשפה כגורם שמאריך את החיים.
- מחסור בברזל
- מהו אימון שלפוחית השתן?
- התרופות מקבוצת הסטטינים להורדת כולסטרול יכולות להביא אותך למחלת כליות איומה, יתר חומצת שתן, כאבי שרירים, סוכרת וזו רשימה חלקית
- השבועה ההיפוקרטית – העדויות על קשרים פיננסיים של רופאים עם תעשיית התרופות, הולכות ורבות, האם השבועה מופרת כיום?
- חלבון בשלב אקוטי
- סגולותיהם של זרעי החרדל
- דרכים חדשות לוויסות יעיל של טריגליצרידים (Triacylglycerols) בדם
- שוויון בריאותי?
- טיפולים מבוססי רירית לזיהומים נגיפיים וחיידקיים
- ציר המעיים-מוח פסיכוביוטיקה psychobiotics
- גלוטתיון Glutathione ו-N-אצטיל-ציסטאין (NAC)
- תסמונת היד הסוכרתית – רמות גבוהות של A1c קשורות להתפתחות של נפיחות באצבעות היד שגורמת כאב ומכונה תסמונת התעלה הקרפלית (גם תסמונת מנהרת שורש כף היד).
- אריתרופויטין (EPO) Erythropoietin
- זאורקראוט – מתכון בסיסי ופשוט לכבישת כרוב בבית
- סודה של דיאטה מצליחה תמיד
- סבל מהרגלים רעים – רוצה להתפתח? !
- תוספי סידן – זהירות – סיכון לשבץ מוחי
- למה חולי כליה, שנוטלים כדורים להפחתת לחץ דם גבוה, יגיעו בוודאות לדיאליזה.
- החשמל הביולוגי – ביו-אלקטריק, חשמל שנוצר בגוף האדם כתרופה
- רוצה להחלים בצורה פשוטה ביותר, ללא תרופות ממחסור בטסטוסטרון או מירידה במדד ה SHBG ?
- שימושים מהפכניים בגלעיני תמרים במזון, בקפה וכתרופה
- האם בוטנים, קליפות בוטנים ומוצריהן הם מזון על?
- להוביל לתת פעילות של בלוטת התריס (תירואיד)
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- פיקנוגנול – כל האמת על רפואת עץ האורן והכנת התה ממחטיו
- אומגה 3 צמחית (שמן חרדל, שמן מרווה מרושתת) עולה על צורות אחרות של אומגה 3 ויש והן לבדן תורמות לבריאות בעוד האחרות עלולות להזיק יותר משלהועיל לך
- (תירואיד)
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- קרום התא – הממברנה והדלקת הכרונית
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- האם תזונה נוגדת דלקת יכולה לעזור?
- חידושים ומהפכות בנושא יתר לחץ דם.
- נוגדני ANF – גורם אנטי גרעיני ונוגדן אנטי-ציטופלזמי של נויטרופיל – ANCA
- תעוקת חזה מיקרו-וסקולרית
- "מגיפת המאה העשרים ואחת", מיתוסים רפואיים: כל מה שחשוב לדעת על אלרגיות
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מפרקינסון
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- סלניום Se התגלה כאנטי- אייג'ינג ומגן מפני מחלות כרוניות
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- שחיקת סחוס, למה לסבול? – ללא ניתוח ללא תרופות – טיפול להחלמה
- לסדרת מאמרי – מבוא לתורת הגוף-נפש המודרנית – חלק א
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- פרנצ'סקו מסינה Francesco Messina אלהים באדם שחיפש אחר היופי
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- עורקים גמישים – הסוד והדרך לזכייה בבריאות מחדש
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- רוצה להחלים בצורה מלאה מסוכרת
- רוצה להחלים מיתר לחץ דם?
- עשרת המזונות הבריאים ביותר לחולי כלייה על האצות והפוקוקסנטין, חלק 7.
- שכיחות של דיכאון וחרדה בקרב חולי כליות
- אוראה – למה האוראה מוגברת ומופחת בדם Urea
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- שיחות ההחלמה ושיחות בין ידידים – על ההבדלים ביניהן
- טריגר – הסיוט שאינו נגמר
- משחה צהובה – לכאבי שרירים – משחת הפלא להפחתת כאבים
- מזון כתרופה
- האסכולה הונציאנית (ציור) חלק א' מאת ירון מרגולין
- לאוקון – יצירת מופת
- צייר גדול Jan Kupecky 1667-1740 קופצ'קי יאן
- חומציותו של הנוזל הבין תאי בגוף האדם מונעת תהליכי החלמה במחלות כרוניות קשות – מה לעשות?
- אנטיביוטיקה – על נזקיה לאנשים בכלל ובפרט לחולים
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות הא
- הפסיכולוגיה הטיפולית וההוליסטית – תולדות הפסיכותרפיה
- הגיל השלישי, תאוותיה של הזיקנה – ואיך להתבגר יפה, טוב ובריא
- בני-על – האם יש גבול ביולוגי למספר השנים שאדם יכול לחיות?
- כל מה שאתה צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- אוכלוסיית המעי הגס חיידקים טובים, דיסביוזיס ו “שומר הגנום” גן p53
- ביקורת מבזה
- חומצה אורית Uric acid צום פורינים – מצב המכונה גם היפראוריקמיה וטופי.
- להוריד קריאטינין, אוריאה ולהחלים ללא תרופות מאי ספיקת כליות
- גמישות היא מצב נפשי – אתגר בזרימה ושינוי – אני מבקש להתגמש
- ימי הסנאל שלי – להתגבר על אוטיזם – פרק א
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- צריך לדעת על מיקרו-תזונה – ויטמינים ומינרלים
- הפרעה אנדוקרינית
- תעוקת חזה מיקרו-וסקולרית
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- ירידה בתפקוד הכליות
- פיטר דה הוך – גאון ומוביל דרך
- מזרקת האריות – מורוסיני Morosini Lions Fountain – Eleftheriou Venizelou Square
- כולסטרול גבוהה – מדד חדש – יחסי הכולסטרול התקין הוא שקובע – כיצד להחלים ללא תרופות
- ריפוי פצעים וצמיחה של הכליה הנגדית לאחר כריתת כליה חד צדדית לצורך תרומה או טיפול
- לאוקון – יצירת מופת
- תִּסְמֹנֶת עוֹרֵק מִתְלֵה הַמְּעִי הָעֶלְיוֹן mesenteric Superior
- קכקסיה – הרזון הקטלני של חולי כליות בדיאליזה
- זרימת דם כלייתית
- השפעות של הורמון הגדילה (GH) על תפקוד הכליות בבריאות ובמחלות כליות
- anti-GAD – הנוגדנים העצמיים כנגד האנזים GAD על פני תאי ביתא בלבלב הם נציגי השטן עצמו בגוף האדם ומקור למספר רב של מחלות קשות בהן סוכרת מסוג (T1D) 1, ירידה בתפקוד בלוטת התריס, הפחתה בגאבא המיוצרת בתאי המוח מגלוטמט, התקפי חרדה ואפילפסיה
- חילוף חומרים אנרגטי, איזון רקמת השומן ובקרת תיאבון – על כוחו של הורמון לפטין
- בלוטת התריס -מחסור ביוד, חוסר סלניום או עודף פלואור במים גם דמימה בשרירים שנצמדים לעצם הלשון עלולים להוביל לתת פעילות של בלוטת התריס (תירואיד)
- מסלול איתות חדש במוח שמווסת אכילה מופרזת
- דיכאון וחרדה בקרב חולי כליות
- הפרעה אנדוקרינית
- מחלת שינוי מינימלי Minimal Changes Disease מינימל צ'יינג'
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- חומץ אננס – רוצה לדעת כיצד להכין תרופה ביתית, אנטי-דלקתי מקליפות האננס?
- תחמוצת החנקן (NO) כיווץ תאי האנדותל, מחלות כרוניות קשות – ודרכי ריפוי חדשות
- תרופה ישראלית חדשה לקורונה
- יתר לחץ דם – שינוי פרדיגמה וגישות חדשות – לחץ דם גבוה וטיפול טבעי ללא תרופות לאחר שטיפול תרופתי נערץ כשל
- מזון כתרופה – שמן זית ושמן קנולה או חרדל הצילו מאות ילדים בעולם.
- מחשבון מדידה והערכת קצב הסינון הגלומרולרי (GFR) אשר מבוסס על קריאטינין, נתוני גוף, גיל, גזע ומין.
- מזון כתרופה – אפשר להחלים מאי ספיקת כליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – על השעורה (דגן) ופעולות נוגדות דלקת כולל עיכוב גורם נמק גידול אלפא – Tumor necrosis factor alpha (TNF-α).
- על הנקמה ודמימותיה
- גודש נוזלים בריאות – בקרב חולי כליה
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
- יש פתרון כולל לבעיות הקשורות לדימוי עצמי, חוסר בטחון וערך עצמי נמוך – דופמין
- תרופות ללחץ דם גבוהה נמצאו כקשורות לסיכון מוגבר לסכיזופרניה
- תרופות הרגעה שמשאירות אותך רעב וחרד – ציפּרָלֵקס, פּרוֹזַק, פלואוקסטין
- להתסיס שיבולת שועל – מתכון וכל הסודות.
- קרום התא – הממברנה והדלקת הכרונית
- איך להיראות צעיר מגילך – כל הסודות
- על ההשפעה האיומה של חלבון מן החי על הכליות
- עשרת המזונות הבריאים ביותר לחולי כלייה – קמח קליפת רימונים (PPF) .9
- Reconstruction of erythropoietin by the kidneys without drugs
- קטואנאלוג ketoanalogue


